Содержание
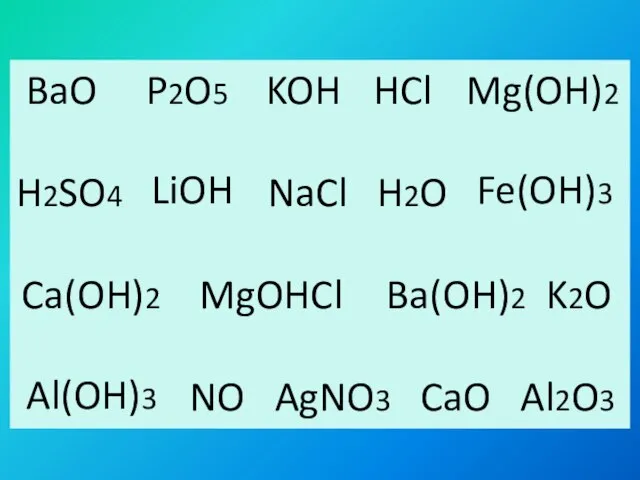
- 2. BaO P2O5 HCl H2SO4 NaCl H2O MgOHCl K2O NO AgNO3 CaO Al2O3 KOH Mg(OH)2 LiOH Fe(OH)3
- 3. Основания - это сложные вещества, состоящие из атомов металлов и гидроксильных групп ОН. Me(OH)n n =
- 4. Названия оснований КОН Mg(OH)2 LiOH Fe(OH)3 Ca(OH)2 Al(OH)3 гидроксид гидроксид гидроксид гидроксид гидроксид гидроксид калия магния
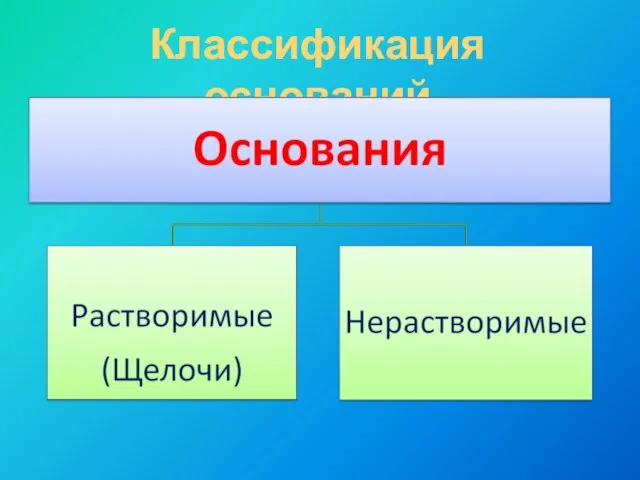
- 5. Классификация оснований
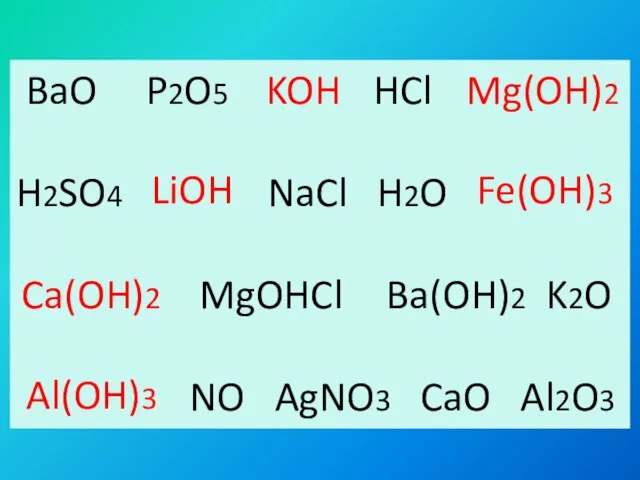
- 6. BaO P2O5 HCl H2SO4 NaCl H2O MgOHCl K2O NO AgNO3 CaO Al2O3 KOH Mg(OH)2 LiOH Fe(OH)3
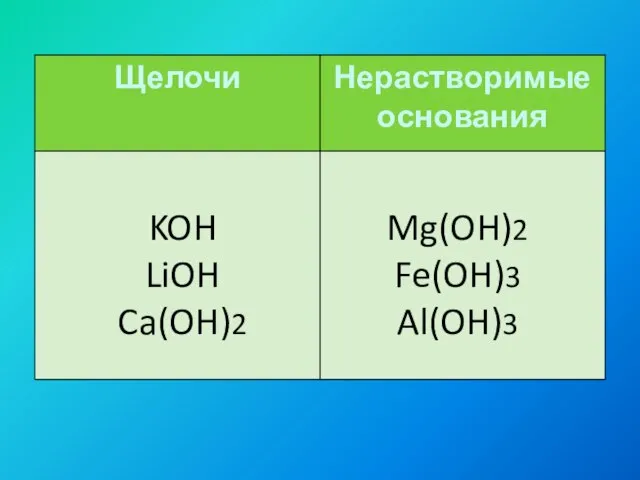
- 7. KOH LiOH Ca(OH)2 Mg(OH)2 Fe(OH)3 Al(OH)3
- 8. Физические свойства оснований Ba(OH)2 Co(OH)2 NaOH Ca(OH)2 LiOH Cu(OH)2
- 9. Получение оснований Активный металл + вода = = щелочь + водород 2Na + 2H2O = 2NaOH
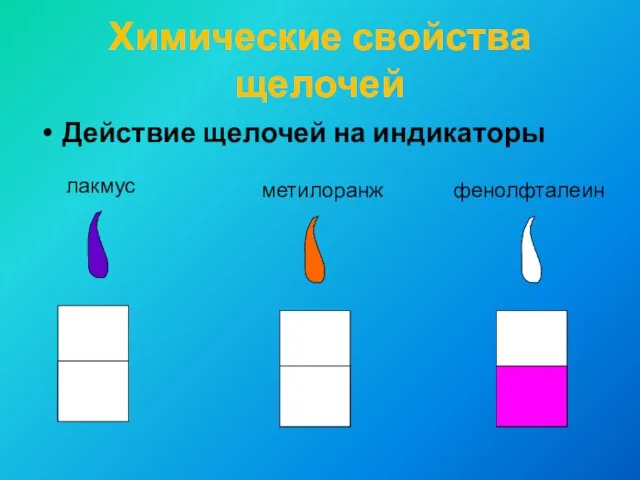
- 10. Химические свойства щелочей Действие щелочей на индикаторы лакмус метилоранж фенолфталеин
- 11. Химические свойства оснований Взаимодействие с кислотами: NaOH + HCl = NaCl +H2O 2. Взаимодействие щелочей с
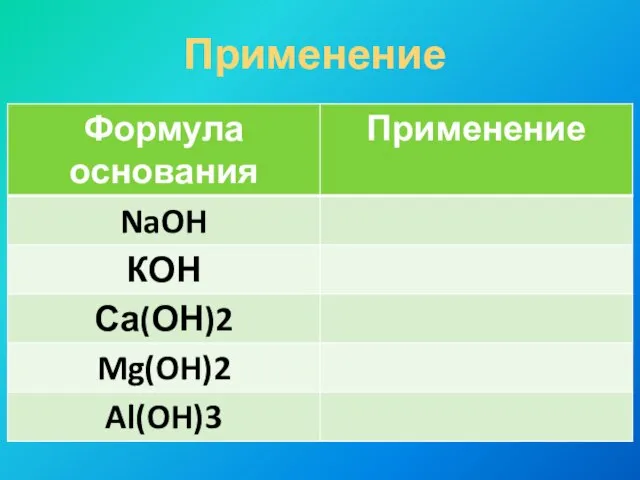
- 12. Применение
- 13. Домашнее задание §31 упр.1- 4
- 15. Скачать презентацию






 Химия в косметологии
Химия в косметологии Органические цепочки
Органические цепочки Фосфорная кислота и ее свойства
Фосфорная кислота и ее свойства Очистка поверхности медного сплава
Очистка поверхности медного сплава Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Химический элемент натрий
Химический элемент натрий Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Презентация на тему Электролиз: что полезно знать
Презентация на тему Электролиз: что полезно знать  Химические методы. CVD, СВС, термоциклирование вблизи температуры фазового перехода
Химические методы. CVD, СВС, термоциклирование вблизи температуры фазового перехода Презентация на тему Жидкий металл - ртуть
Презентация на тему Жидкий металл - ртуть  Распределение электронов по энергетическим уровням
Распределение электронов по энергетическим уровням Строение атома
Строение атома Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии Химия в жизни общества
Химия в жизни общества Исследование свойств многоатомных спиртов
Исследование свойств многоатомных спиртов Презентация на тему Благородные газы
Презентация на тему Благородные газы  Ca КАЛЬЦИЙ
Ca КАЛЬЦИЙ Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Презентация на тему Молярный объем
Презентация на тему Молярный объем  Методы исследования структуры кристаллов
Методы исследования структуры кристаллов Природные источники углеводородов
Природные источники углеводородов Введение в органическую химию
Введение в органическую химию Серная кислота
Серная кислота Ковалентная связь. Радикалы
Ковалентная связь. Радикалы Характеристика углеводородов
Характеристика углеводородов Масляная кислота
Масляная кислота