Содержание
- 2. Однажды к римскому императору Тиберию пришел незнакомец и принес в дар ему чашу из серебристого легкого
- 5. Алюминий
- 6. Цель урока: В ходе изучения темы, вы должны знать: электронное строение атома алюминия, физические и химические
- 7. Входной контроль Тестирование 1. Какой тип связи характерен для кристаллической решетки металлов: а) ионная б) ковалентная
- 8. Название элемента происходит от лат. алюмен, так в древности называли квасцы, которые использовали для крашения тканей
- 9. Англичане подарили Д.И Менделееву химические весы, в которых одна чашка была изготовлена из золота, другая -
- 10. Впервые Al был получен датским физиком Хансом Эрстедом в 1825 г.
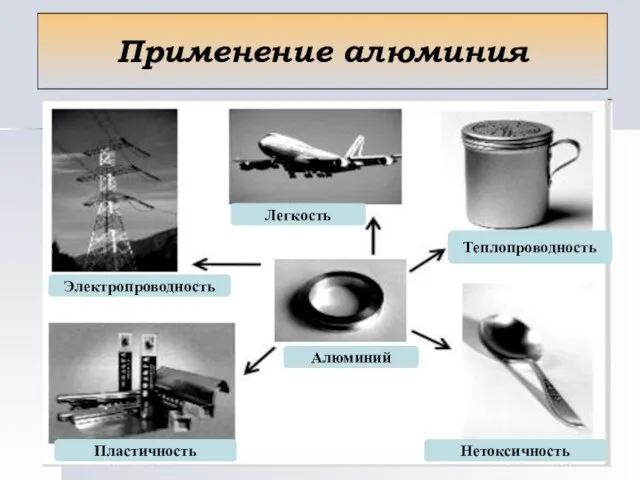
- 11. Применение алюминия
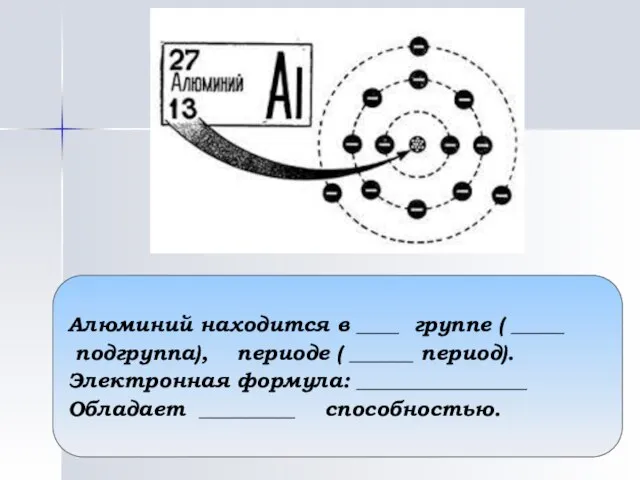
- 12. Алюминий находится в ____ группе ( _____ подгруппа), периоде ( ______ период). Электронная формула: ________________ Обладает
- 13. 1. Твердое агрегатное состояние 2. Серебристо-белый, блестящий 3. Пластичный 4. Не растворяется в воде 5. Температура
- 14. Химические свойства алюминия: Взаимодействие с простыми веществами: Взаимодействие с кислородом 4Al + 3O2 = 2Al2O3
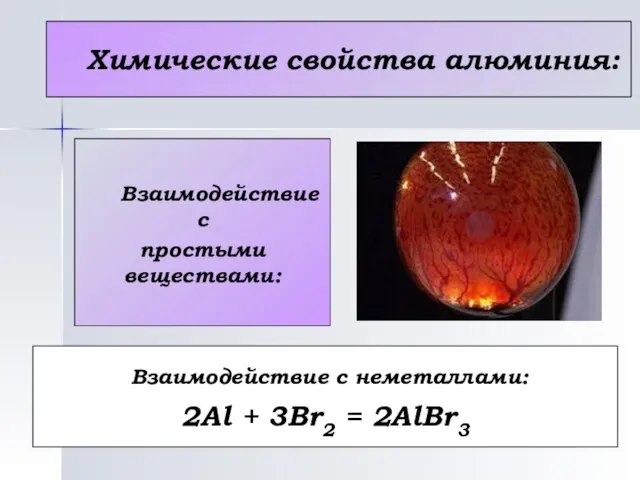
- 15. Химические свойства алюминия: Взаимодействие с простыми веществами: Взаимодействие с неметаллами: 2Al + 3Br2 = 2AlBr3
- 16. Химические свойства алюминия: Взаимодействие со сложными веществами: 1. Взаимодействие с соляной кислотой 2Al + 6HCl =
- 17. Химические свойства алюминия: Взаимодействие со сложными веществами: 3. Взаимодействие с водой (БЕЗ оксидной плёнки) 2Al +
- 19. Скачать презентацию













 Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН Спирты и их производные. Применение метанола и этанола
Спирты и их производные. Применение метанола и этанола Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Разминка
Разминка Введение в химию. История химии
Введение в химию. История химии Образование первичной структуры белка
Образование первичной структуры белка Практическое пособие по твердофазной экстракции
Практическое пособие по твердофазной экстракции Амины. Аминокислоты. Белки
Амины. Аминокислоты. Белки Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Соли. Химические свойства
Соли. Химические свойства Nanotechnology (theoretical part)
Nanotechnology (theoretical part) Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Презентация на тему Типы реакций
Презентация на тему Типы реакций  Способы получения веществ 14 (IVА) группы элементов
Способы получения веществ 14 (IVА) группы элементов Игра Что? Где? Когда?. Химия
Игра Что? Где? Когда?. Химия Реакции ионного обмена. Задания. 9 класс
Реакции ионного обмена. Задания. 9 класс Органическая химия: Жиры
Органическая химия: Жиры Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11
Получение дисперсных систем. Метод конденсации. Метод диспергирования. Эффект Ребиндера. Лекция 11 Презентация на тему Классификация неорганических веществ. Оксиды
Презентация на тему Классификация неорганических веществ. Оксиды  Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН
Изучение адсорбции аминокислот на поверхности гидроксилапатита при варьировании рН Химическая шкатулка
Химическая шкатулка Образование и получение веществ
Образование и получение веществ Биологическое значение брома и йода
Биологическое значение брома и йода Презентация на тему Щелочноземельные металлы
Презентация на тему Щелочноземельные металлы  Презентация на тему Химия и современный мир профессий
Презентация на тему Химия и современный мир профессий  Циклоалканы. Номенклатура и строение
Циклоалканы. Номенклатура и строение Угольная кислота
Угольная кислота Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды