Содержание
- 2. Визначення та поняття Розчини – це гомогенні термодинамічно стійкі системи, що складаються з 2-х і більше
- 3. Визначення та поняття Розчинність– це здатність речовини розчинятися в тому чи іншому розчиннику. Розчинник – це
- 4. Класифікація розчинів За агрегатним станом: Газоподібні (повітря – N2+O2+He+CO2) Рідкі (NaOH+H2O; NaCl + H2O) Тверді (сплави
- 5. Классифікация розчинів 3. Розчини ділять на насичені, ненасичені і пересичені. Насичені розчини - це розчини в
- 6. Розчинність Кількісно розчинність (Р) виражають відношенням маси речовини (г) до об'єму або маси розчинника ( л).
- 7. Дисперсні системи Дисперсні системи це гетерогенні системи, які характеризуються дисперсністю. Дисперсність – це величина, зворотна розміру
- 8. Ідеальні розчини Розчин складається з розчиненої речовини та розчинника (В). Між одноіменними молекулами, а також між
- 9. Фізична теорія утворення розчинів . Засновниками даної теорії є Арреніус, Оствальд та Вант-Гофф. Ці вчені розглядали
- 10. Хімічна теорія утворення розчинів Основні тези хімічної теорії були представлені в 1887 році Д. І. Менделєєвим.
- 11. Гідрати (сольвати) виникають не за рахунок основних хімічних зв'язків, а за рахунок Ван-дер-Ваальсових сил або водневого
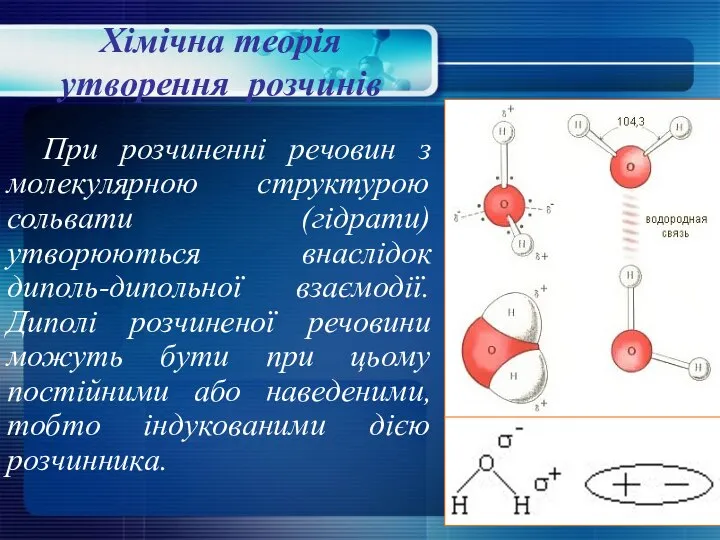
- 12. При розчиненні речовин з молекулярною структурою сольвати (гідрати) утворюються внаслідок диполь-дипольної взаємодії. Диполі розчиненої речовини можуть
- 13. Сучасна теорія утворення розчинів Сучасна теорія розчинення об'єднує фізичну і хімічну теорії і розглядає розчинення, як
- 14. Сучасна теорія утворення розчинів Стадія гідратації екзотермічна, а стадія розчинення ендотермічна. Загальний тепловий ефект процесу складається
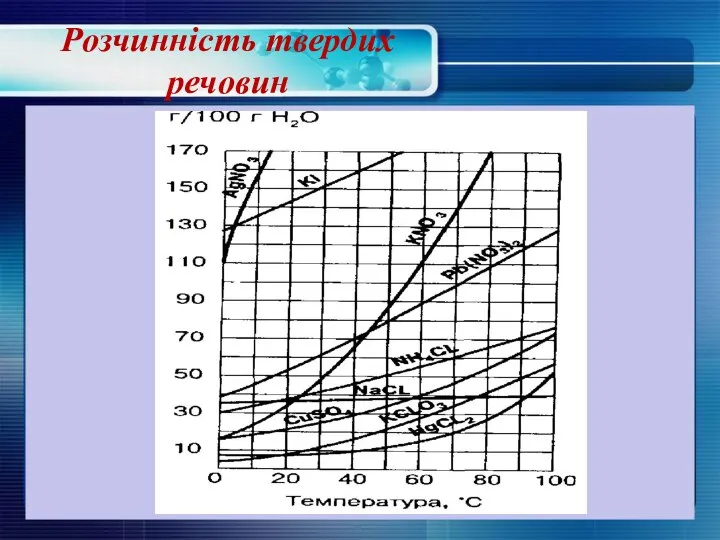
- 15. Розчинність твердих речовин
- 16. Як правило, з підвищенням температури розчинність більшості твердих речовин підвищується. При обережному охолодженні таких систем отримують
- 17. Розчинність газів На розчинність газів у рідинах впливає температура і тиск. Залежність розчинності газів від тиску
- 18. Газові закони Закон Сєченова - розчинність газів в рідинах знижується в присутності електролітів де So -
- 19. Кесо́нна хвороба — різке зниження тиску призводить до "закипання" крові через виділення розчинених в ній газів.
- 20. Гірська хвороба - виникає як кисневе голодування при підйомі в гори (перебування в розрідженому повітрі з
- 21. Способи вираження концентрації 1. Масова частка W – це відношення маси розчиненої речовини (m р-ни) до
- 22. Способи вираження концентрації 3. Молярна концентрація (См) показує яку кількість речовини (n) розчинено в 1 л
- 23. Способи вираження концентрації 6. Титр (Т) показує скільки грамів речовини (m р-ни) розчинено в 1 мл
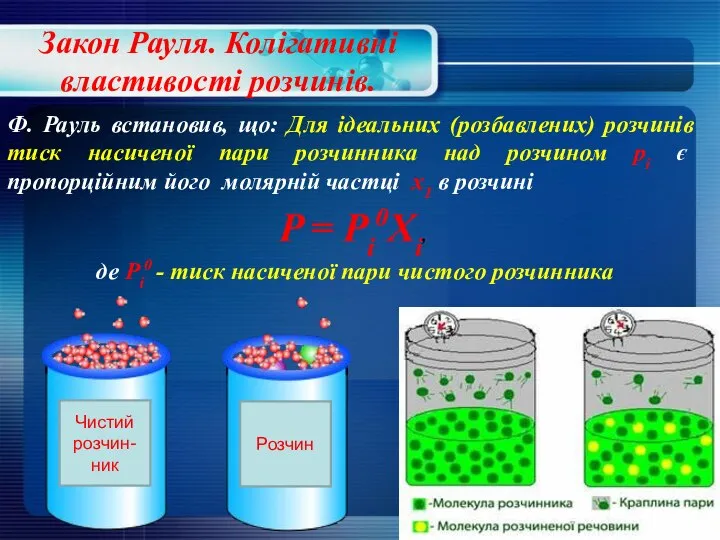
- 24. Закон Рауля. Колігативні властивості розчинів. Ф. Рауль встановив, що: Для ідеальних (розбавлених) розчинів тиск насиченої пари
- 25. Закон Рауля. Колігативні властивості розчинів. Друге формулювання цього закону: Відносне зниження тиску насиченої пари розчинника над
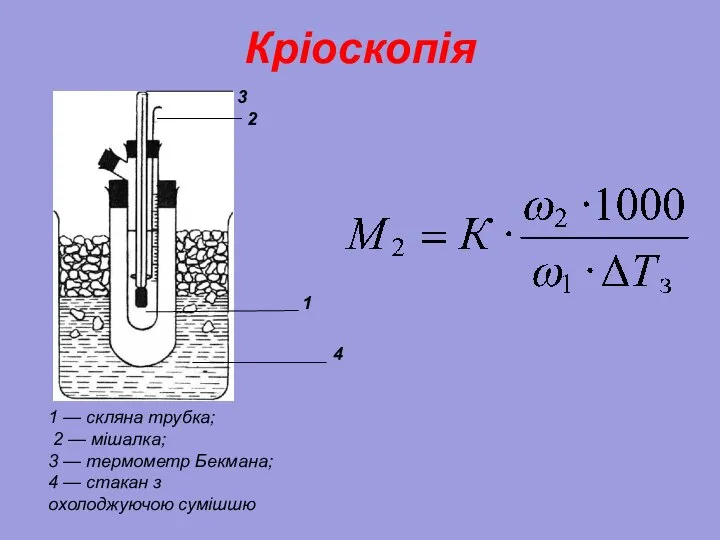
- 26. Кріоскопія Зменшення тиску насиченої пари над розчином призводить до зниження температури замерзання. Іншими словами температура замерзання
- 27. Кріоскопія
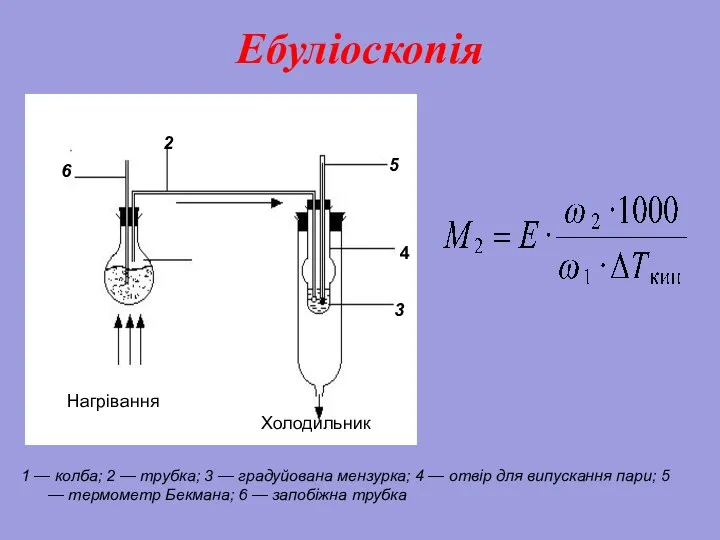
- 28. Колігативні властивості розчинів. Ебуліоскопія Підвищення температури кипіння розчинів нелетких речовин ΔTк = Tк р-ка – Tк
- 29. Ебуліоскопія 1 — колба; 2 — трубка; 3 — градуйована мензурка; 4 — отвір для випускання
- 30. Закон Рауля
- 31. Дифузія та осмос в розчинах Дифузія — це мимовільний процес вирівнювання концентрації розчиненої речовини в результаті
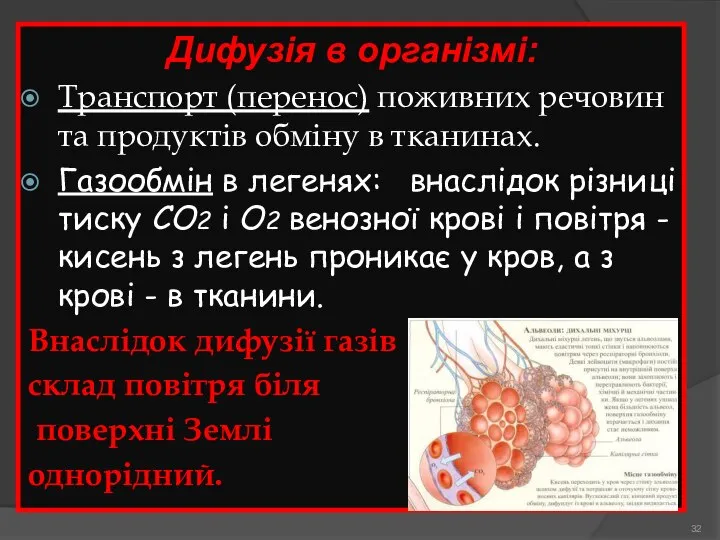
- 32. Дифузія в організмі: Транспорт (перенос) поживних речовин та продуктів обміну в тканинах. Газообмін в легенях: внаслідок
- 33. Осмос. Осмотичний тиск. Процес дифузії речовини через напівпроникну мембрану називають осмосом. А той тиск, який необхідно
- 34. Закон Вант-Гоффа Осмотичний тиск розчину дорівнює такому тиску, який мала би розчинена речовина, якщо б вона
- 35. Закон Вант-Гоффа В розчинах електролітів кількість часток в одиниці об'єму розчину більше, так як кожна молекула
- 36. Усі тканинні рідини (кров, лімфа) є водними розчинами органічних та мінеральних речовин, низько- та високомолекулярних електролітів
- 37. Частину осмотичного тиску, зумовлену білками крові (альбумінами, глобулінами) називають онкотичним тиском (3,5 – 3,9 кПа), що
- 38. Ізотонічність Кров, лімфа та інші тканинні рідини організму людини мають осмотичний тиск приблизно 800 кПа., такий
- 39. Осмотичному тиску крові людини відповідає осмомолярна концентрація розчинених в плазмі речовин, яка становить 0,287- 0,303 моль/л.
- 40. За величиною осмотичного тиску розчини поділяються на: 1. ізотонічні – мають осмотичний тиск, який рівний стандарту
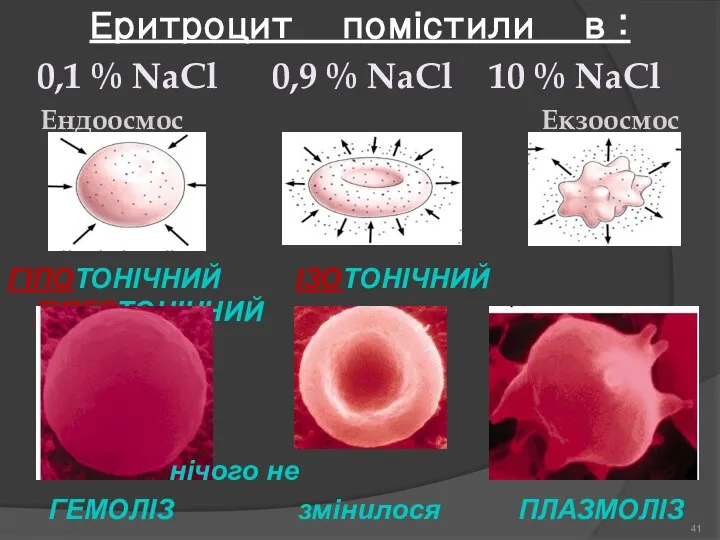
- 41. Еритроцит помістили в : 0,1 % NaCl 0,9 % NaCl 10 % NaCl Ендоосмос Екзоосмос ГІПОТОНІЧНИЙ
- 42. ГІПЕРТОНІЧНІ розчини - вводять в кров повільно в невеликих кількостях. ПЛАЗМОЛІЗ - різке зменшення об’єму та
- 43. ГІПОТОНІЧНІ розчини внутрішньовенно НЕ ВВОДЯТЬ!!! Це зумовлено явищем ГЕМОЛІЗУ -молекули води надходять всередину еритроцитів, внаслідок чого
- 44. Осмос відіграє важливу роль у багатьох біологічних процесах: Мембрана, що оточує клітину, проникна лише для молекул
- 46. Скачать презентацию




































 Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Ковалентная полярная связь
Ковалентная полярная связь Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Физический этап развития периодического закона
Физический этап развития периодического закона a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Первоначальные химические понятия
Первоначальные химические понятия Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Алканы
Алканы Медь и ее сплавы
Медь и ее сплавы Классификация силикатов
Классификация силикатов День химии
День химии Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Металлы - наши друзья или враги
Металлы - наши друзья или враги Решение расчетных задач
Решение расчетных задач Теория электролитической диссоциации
Теория электролитической диссоциации Силумины. Виды силуминов
Силумины. Виды силуминов Пористые стекла
Пористые стекла Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Звездный час по химии
Звездный час по химии Ионная полимеризация
Ионная полимеризация Повторение по теме Химические реакции
Повторение по теме Химические реакции Химия - неотъемлемая часть жизни
Химия - неотъемлемая часть жизни Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Получение и реакции пиразина
Получение и реакции пиразина Алюминий. Из истории открытия
Алюминий. Из истории открытия Бораны и карбораны
Бораны и карбораны