Содержание
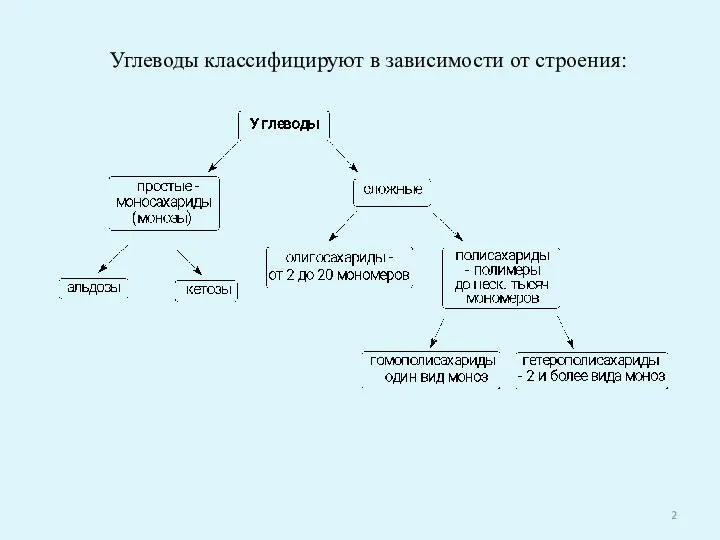
- 2. Углеводы классифицируют в зависимости от строения:
- 3. МОНОСАХАРИДЫ Моносахариды – это гетерофункциональные соединения, содержащие в молекуле одновременно карбонильную группу и несколько спиртовых гидроксильных
- 4. Классификация В зависимости от природы карбонильной группы их делят на альдозы и кетозы, а по числу
- 5. Для каждого из оптических изомеров существует только 1 антипод (энантиомер), остальные изомеры являются диастереомерами. Для изображения
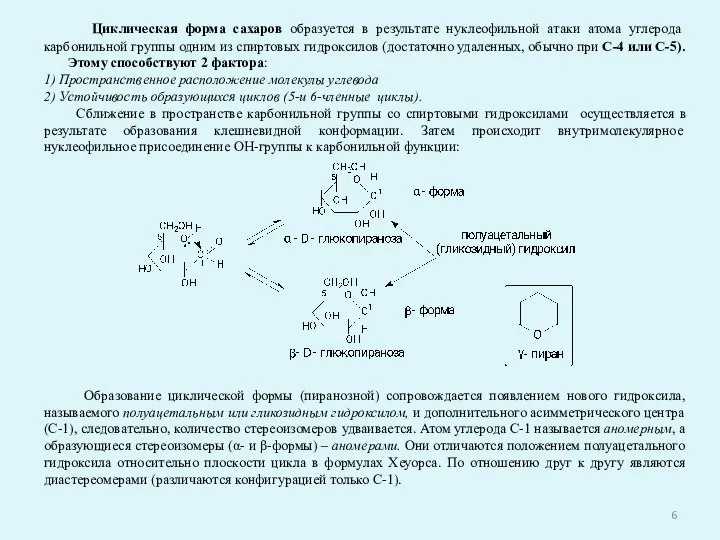
- 6. Циклическая форма сахаров образуется в результате нуклеофильной атаки атома углерода карбонильной группы одним из спиртовых гидроксилов
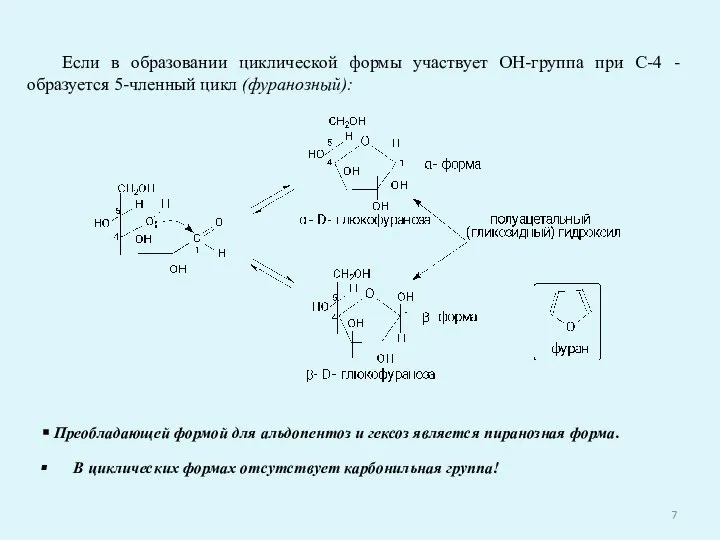
- 7. Если в образовании циклической формы участвует ОН-группа при С-4 - образуется 5-членный цикл (фуранозный): Преобладающей формой
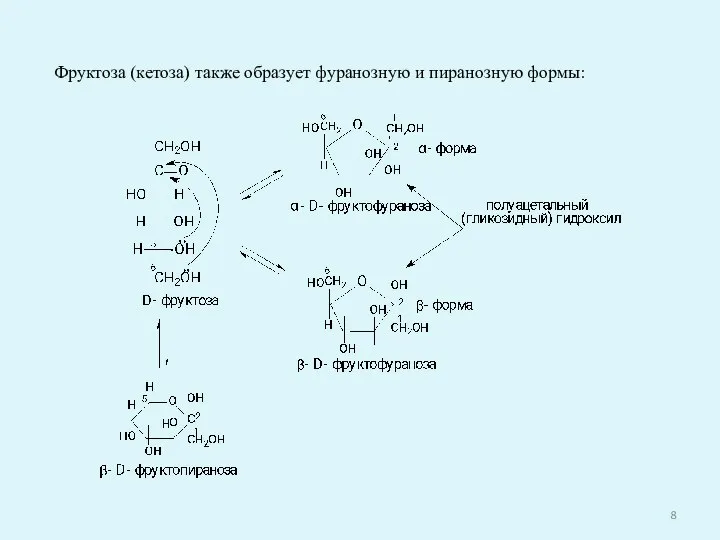
- 8. Фруктоза (кетоза) также образует фуранозную и пиранозную формы:
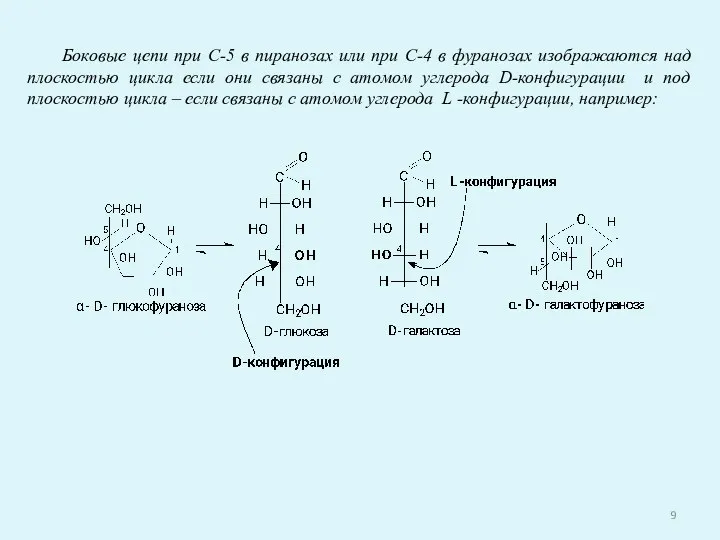
- 9. Боковые цепи при С-5 в пиранозах или при С-4 в фуранозах изображаются над плоскостью цикла если
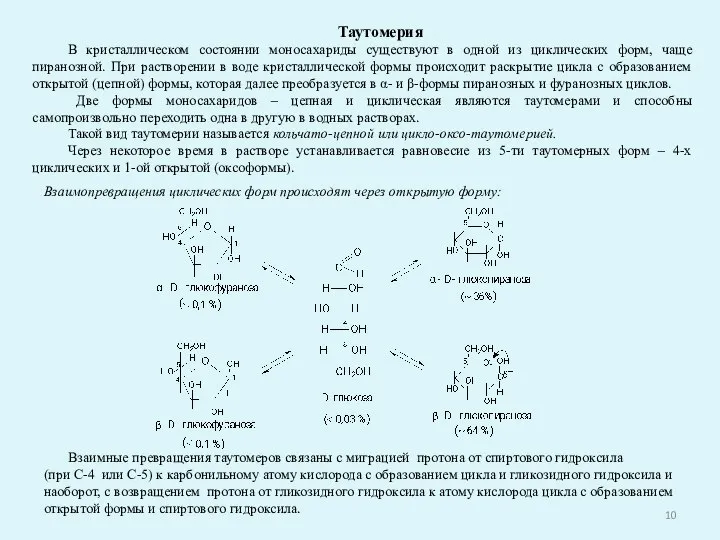
- 10. Таутомерия В кристаллическом состоянии моносахариды существуют в одной из циклических форм, чаще пиранозной. При растворении в
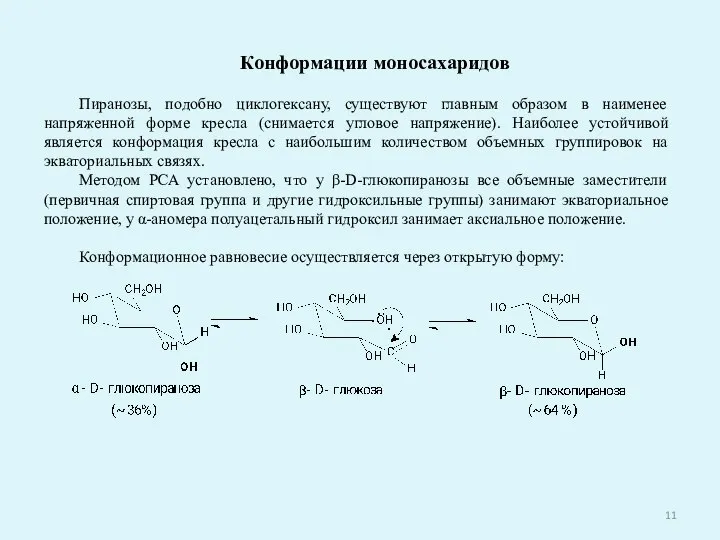
- 11. Конформации моносахаридов Пиранозы, подобно циклогексану, существуют главным образом в наименее напряженной форме кресла (снимается угловое напряжение).
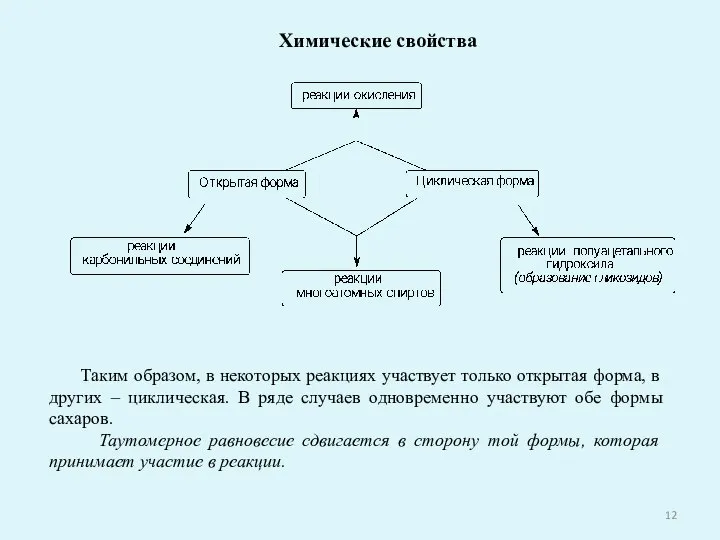
- 12. Химические свойства Таким образом, в некоторых реакциях участвует только открытая форма, в других – циклическая. В
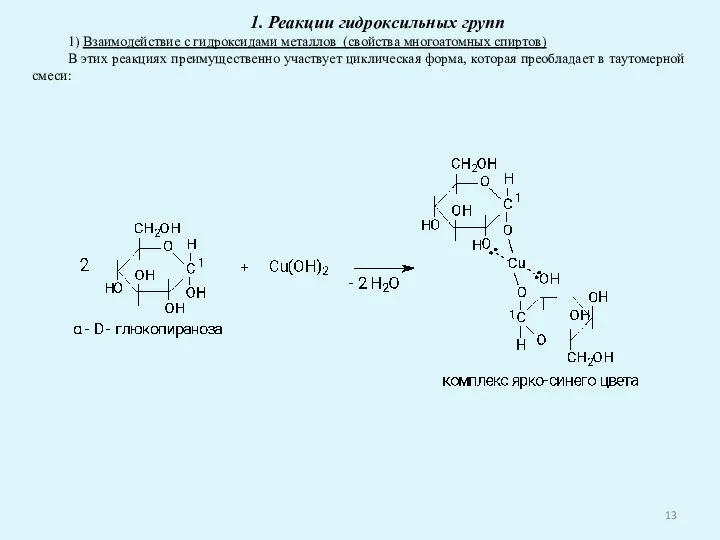
- 13. 1. Реакции гидроксильных групп 1) Взаимодействие с гидроксидами металлов (свойства многоатомных спиртов) В этих реакциях преимущественно
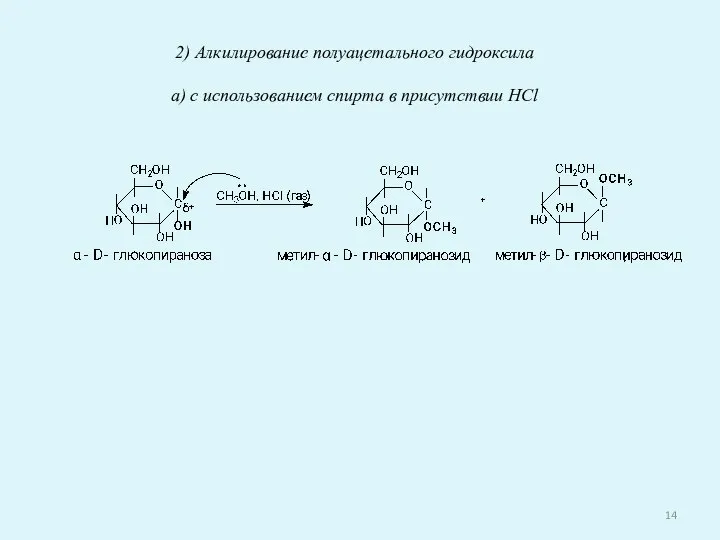
- 14. 2) Алкилирование полуацетального гидроксила а) с использованием спирта в присутствии HCl
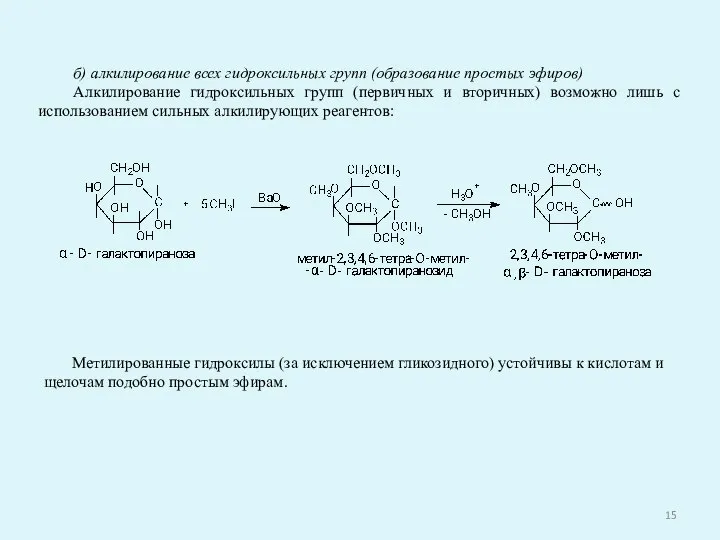
- 15. б) алкилирование всех гидроксильных групп (образование простых эфиров) Алкилирование гидроксильных групп (первичных и вторичных) возможно лишь
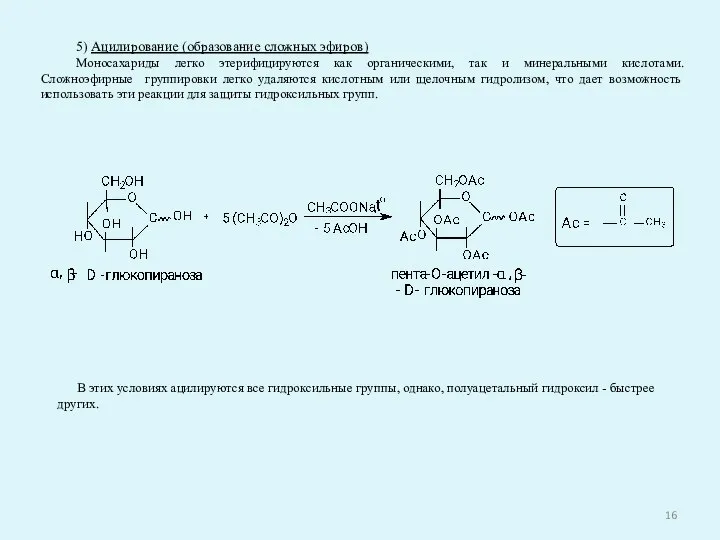
- 16. 5) Ацилирование (образование сложных эфиров) Моносахариды легко этерифицируются как органическими, так и минеральными кислотами. Сложноэфирные группировки
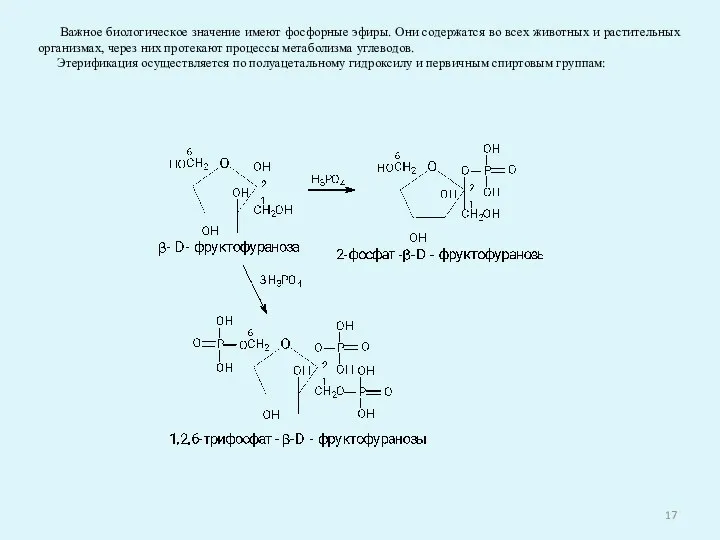
- 17. Важное биологическое значение имеют фосфорные эфиры. Они содержатся во всех животных и растительных организмах, через них
- 18. 2. Реакции по карбонильной группе (реакции открытой формы) В равновесной смеси таутомеров содержание открытой формы моносахаридов
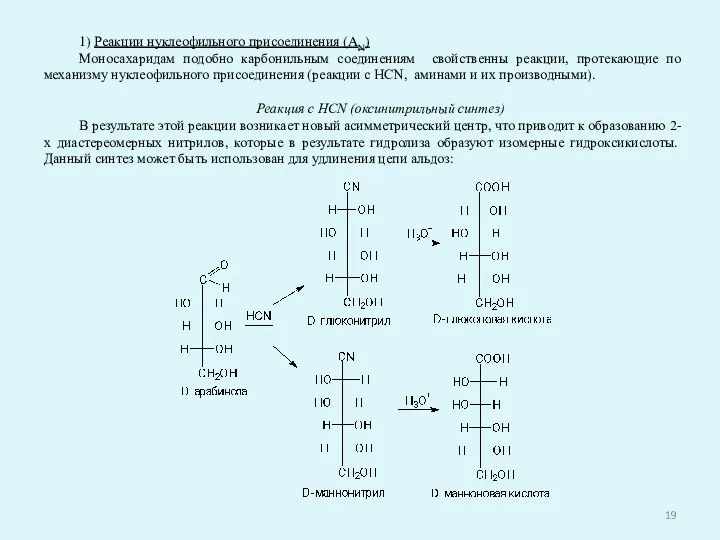
- 19. 1) Реакции нуклеофильного присоединения (AN) Моносахаридам подобно карбонильным соединениям свойственны реакции, протекающие по механизму нуклеофильного присоединения
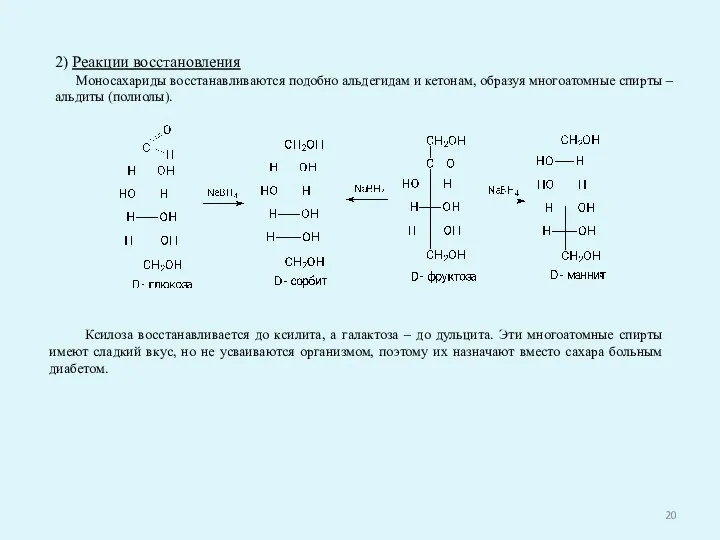
- 20. 2) Реакции восстановления Моносахариды восстанавливаются подобно альдегидам и кетонам, образуя многоатомные спирты – альдиты (полиолы). Ксилоза
- 21. 3. Реакции с участием обеих функциональных групп (реакции открытой и циклической форм) Окисление Моносахариды легко окисляются
- 22. Однако фруктоза (кетоза!) тоже дает положительную реакцию с указанными реактивами. Это можно объяснить изомеризацией альдоз и
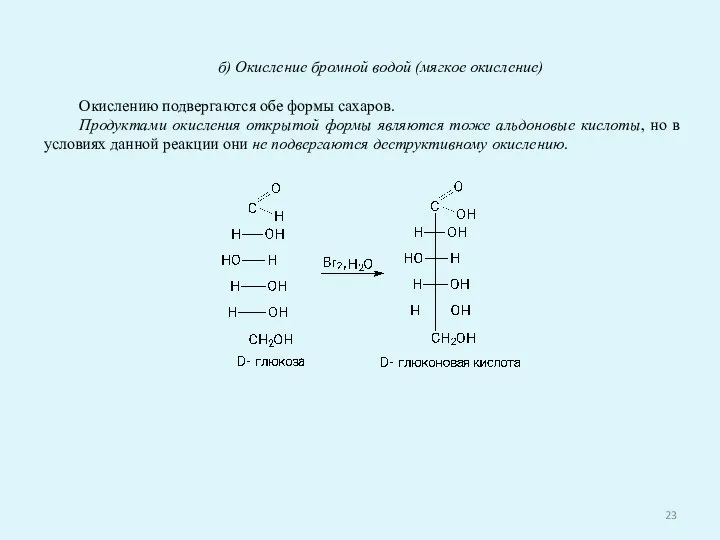
- 23. б) Окисление бромной водой (мягкое окисление) Окислению подвергаются обе формы сахаров. Продуктами окисления открытой формы являются
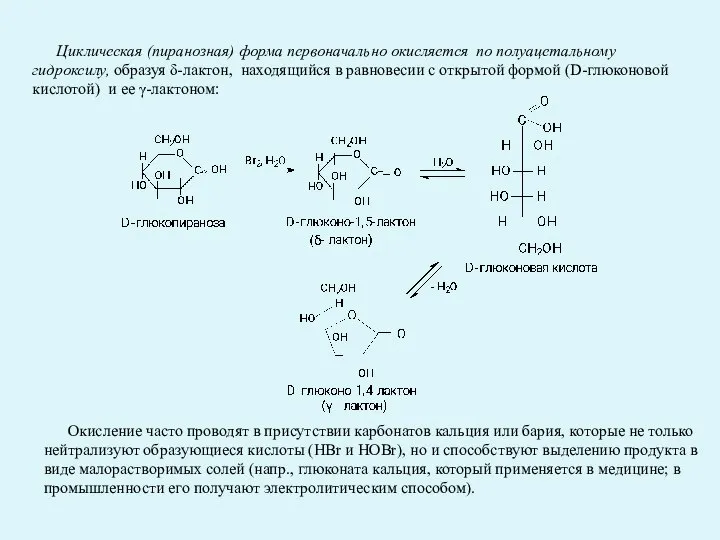
- 24. Циклическая (пиранозная) форма первоначально окисляется по полуацетальному гидроксилу, образуя δ-лактон, находящийся в равновесии с открытой формой
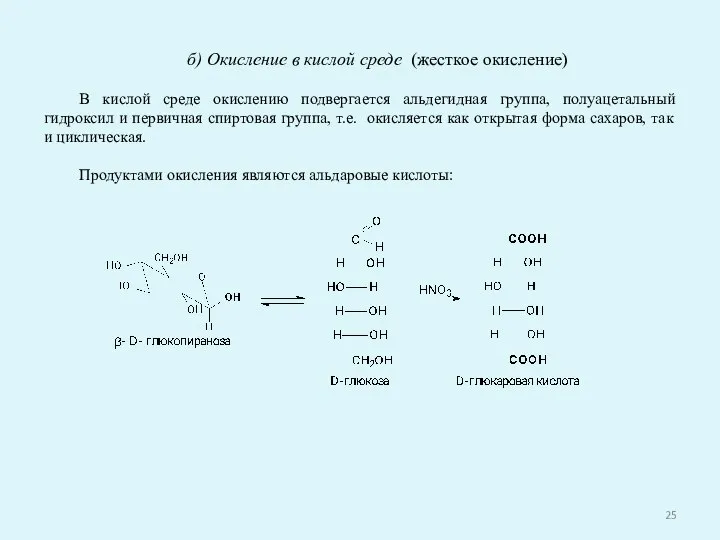
- 25. б) Окисление в кислой среде (жесткое окисление) В кислой среде окислению подвергается альдегидная группа, полуацетальный гидроксил
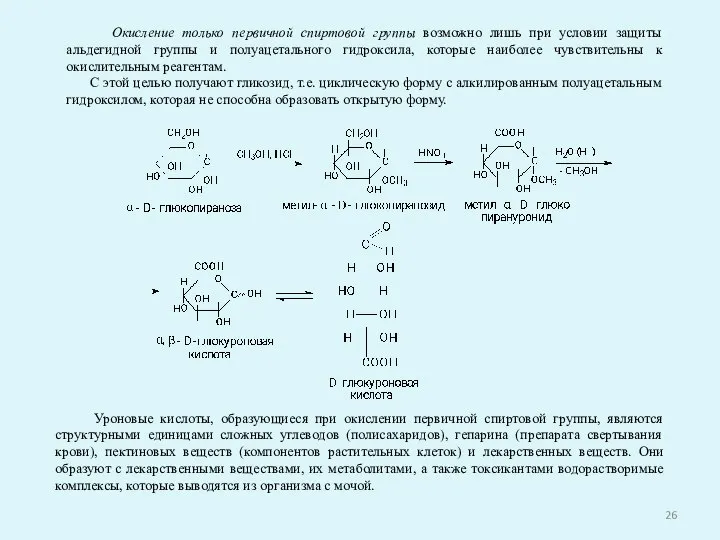
- 26. Окисление только первичной спиртовой группы возможно лишь при условии защиты альдегидной группы и полуацетального гидроксила, которые
- 27. ПРОИЗВОДНЫЕ МОНОСАХАРИДОВ К ним относят соединения, имеющие моносахаридную природу и содержащие вместо одной или нескольких гидроксильных
- 28. 2) Аминосахара (ОН-группа, обычно при С2, замещена на аминогруппу) Важнейшими аминосахарами являются производные глюкозы и галактозы,
- 30. Скачать презентацию








 Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода Сера
Сера кремний и его соединения
кремний и его соединения Нефтяные дисперсные системы
Нефтяные дисперсные системы Презентация на тему Многоатомные спирты
Презентация на тему Многоатомные спирты  Substancje chemiczne
Substancje chemiczne Оксиды в мире минералов
Оксиды в мире минералов Аттестационная работа. Многогранники: от молекулы до кристалла
Аттестационная работа. Многогранники: от молекулы до кристалла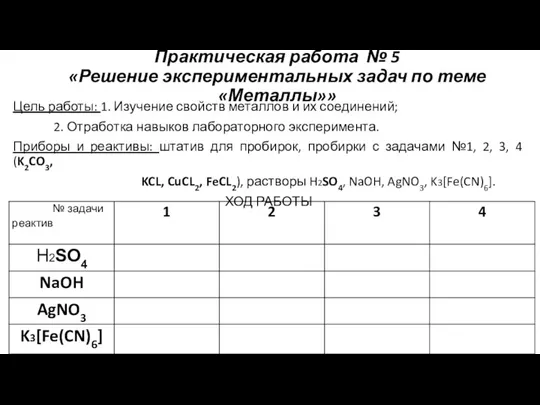 Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Химическое равновесие
Химическое равновесие Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи
Всероссийский межпредметный командный проект Изучаем химию с Агатой Кристи Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания Строение бензола
Строение бензола Свойства бензола
Свойства бензола Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Расчет энтропии образования и теплоемкости органических веществ методом Бенсона
Расчет энтропии образования и теплоемкости органических веществ методом Бенсона Типы химических реакций
Типы химических реакций Химия – это область чудес
Химия – это область чудес Химическая связь и строение молекул
Химическая связь и строение молекул Классы неорганических соединений
Классы неорганических соединений Презентация на тему Золото
Презентация на тему Золото  Комплексонометрическое титрование. Часть 2. Лекция 6
Комплексонометрическое титрование. Часть 2. Лекция 6 Движение электрона в атоме
Движение электрона в атоме Неметаллы и их соединения
Неметаллы и их соединения Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Использование катионных красителей в экстракционно-флуориметрическом анализе
Использование катионных красителей в экстракционно-флуориметрическом анализе Фосфор
Фосфор