Содержание
- 2. Сложные реакции Сложными называют реакции, состоящие из двух или большего числа простых реакций. Кинетика сложных реакций
- 3. Параллельные реакции Параллельными называют реакции, идущие одновременно по нескольким направлениям, с образованием различных продуктов. Рассмотрим простой
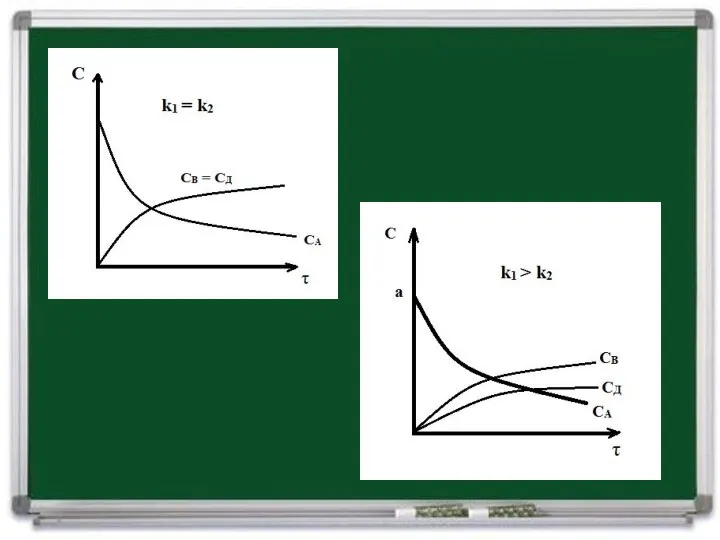
- 4. Пусть К1 и К2 - константы скорости этих стадий. Выберем отсчет времени так, чтобы при t
- 5. Следовательно, для параллельной реакции, стадии которой значительно различаются по скорости, определяющей является более быстрая стадия. Если
- 7. Обратимые реакции Обратимыми называют реакции, протекающие одновременно в двух противоположных направлениях. В этом смысле почти все
- 8. В этом случае скорость обратной реакции несоизмеримо меньше скорости прямой. Заметим, что понятие двусторонних реакций не
- 9. Учтем, что в данной реакции исчезновение определенного количества молекул исходного вещества вызывает образование точно такого же
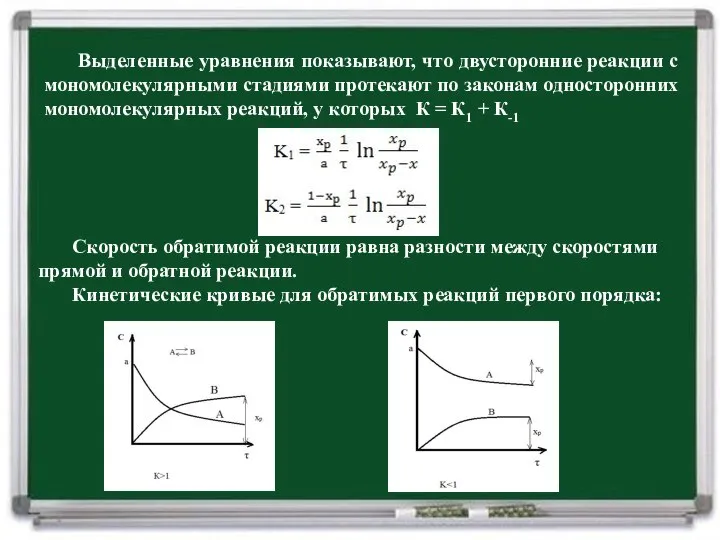
- 10. Запишем кинетические уравнения прямой и обратной стадий, используя концентрацию вещества В: скорость суммарной реакции: после интегрирования:
- 11. Выделенные уравнения показывают, что двусторонние реакции с мономолекулярными стадиями протекают по законам односторонних мономолекулярных реакций, у
- 12. Сопряженные реакции Сопряженными называют реакции типа: из которых одна, например, вторая, протекает лишь совместно с первой.
- 13. Это явление, называемое химической индукцией изучал Шилов (1905 г.) Во многих сопряженных реакциях индуктор выступает как
- 14. Примером сопряженных реакций может служить реакция между бромноватой кислотой и смесью сернистой и мышьяковистой кислот. Кислота
- 15. Пример: синтез амидов в водном растворе из кислоты и амина. Сама по себе не идет с
- 16. Явление, состоящее в том, что самопроизвольно протекающая в системе химическая реакция вызывает (индуцирует) протекание в этой
- 17. В общем случае предельное значение фактора индукции равно отношению стехиометрического коэффициента акцептора и индуктора в итоговом
- 18. Цепные реакции Цепными называются химические реакции, в которых появление активной частицы вызывает большое число превращений неактивных
- 19. К цепным реакциям относятся реакции сгорания топлива, окисление молекулярным кислородом, хлорирование и бромирование, многие процессы полимеризации,
- 20. Для течения цепных реакций, в особенности с длинными цепями очень важное значение имеет форма реакционного сосуда.
- 21. Основы теории кинетики цепных реакций Различают реакции с неразветвленными и разветвленными цепями. Неразветвленная цепь: одна активная
- 22. Теоретическое уравнение для определения скорости образования фосгена Если в результате одного элементарного акта регенерируются одна или
- 23. Образовавшиеся активные частицы в результате разветвленной цепной реакции вызывают превращение большой массы исходных веществ в конечные
- 24. Рассмотрим элементарную вероятностную теорию цепных реакций. Цепная реакция – неразветвленная. τ – время между двумя последовательными
- 25. Пусть концентрация исходных веществ поддерживается const, а продукты убираются из сферы реакции. Условия изотермические, m0 =
- 26. получим зависимость скорости цепной неразветвленной реакции от времени:
- 27. Для разветвленной цепи вероятность обрыва цепи будет меньше.
- 28. t → ∞, скорость реакции V неограниченно увеличивается по экспоненциальному закону и заканчивается взрывом при постоянной
- 30. Скачать презентацию

























 Строение атома
Строение атома Углеводороды. Урок-игра
Углеводороды. Урок-игра Проектная работа Кристаллизация
Проектная работа Кристаллизация Стеариновая кислота
Стеариновая кислота Лекция 6 Смазочные масла
Лекция 6 Смазочные масла Презентация по Химии "Фосфор - элемент жизни и мысли"
Презентация по Химии "Фосфор - элемент жизни и мысли"  Бериллий, магний и щелочно-земельные металлы
Бериллий, магний и щелочно-земельные металлы Жаңа синтетикалық есірткілер
Жаңа синтетикалық есірткілер Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Набор для выращивания монокристалла. Защита проекта
Набор для выращивания монокристалла. Защита проекта Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Чистые вещества и смеси, их разделение
Чистые вещества и смеси, их разделение Основные понятия органической химии
Основные понятия органической химии Первое начало термодинамики (Закон сохранения и превращения энергии)
Первое начало термодинамики (Закон сохранения и превращения энергии) Химический процесс: энергетика и равновесие
Химический процесс: энергетика и равновесие Электролиз растворов и расплавов неорганических и органических электролитов
Электролиз растворов и расплавов неорганических и органических электролитов Каустическая сода
Каустическая сода Кислотність бджолиного обніжжя
Кислотність бджолиного обніжжя Золото (Au)
Золото (Au) Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи
Понятие аналитической химии, её цели и задачи. Химический анализ, его задачи Оксиды
Оксиды Соединения щелочных металлов
Соединения щелочных металлов Физика полимеров Ч1
Физика полимеров Ч1 Силикатная промышленность
Силикатная промышленность ПЕРІОДИЧНИЙ ЗАКОН
ПЕРІОДИЧНИЙ ЗАКОН Углеводороды. Природный газ. Алканы
Углеводороды. Природный газ. Алканы Моющие и чистящие средства
Моющие и чистящие средства