Содержание
- 2. Движущая сила реакции – это возможность образования новой более стабильной системы, обладающей минимальной потенциальной энергией. Факторы,
- 3. Химическая реакция характеризуется 2 факторами: Термодинамическим - изменением свободной энергии; Кинетическим – скоростью превращения и его
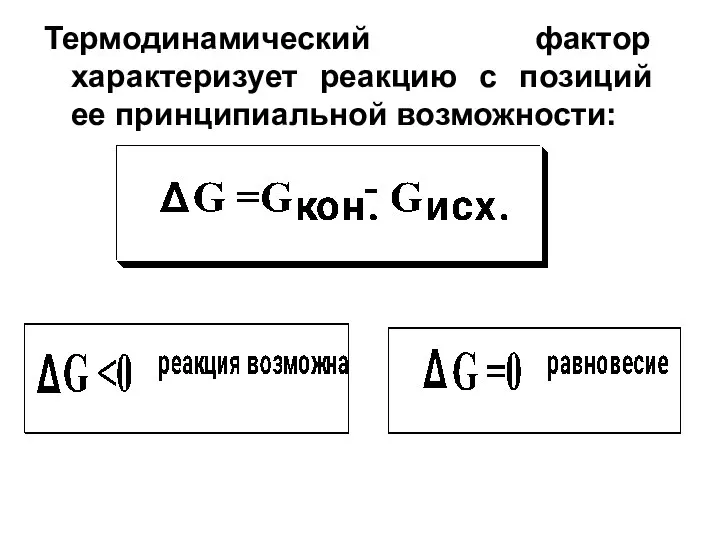
- 4. Термодинамический фактор характеризует реакцию с позиций ее принципиальной возможности:
- 5. В соответствии с уравнением Гиббса: ∆Н – изменение энтальпии (разность энергий разрывающихся и вновь образующихся связей);
- 6. Реакционная способность вещества – способность вещества вступать в ту или иную реакцию и реагировать с большей
- 7. Теория переходного состояния При переходе от исх. в-в к продуктам реагирующая система должна пройти через некоторое
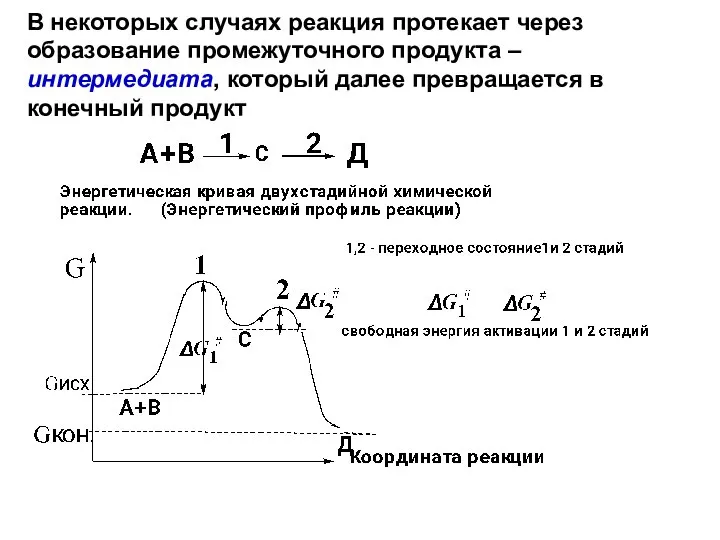
- 8. В некоторых случаях реакция протекает через образование промежуточного продукта – интермедиата, который далее превращается в конечный
- 9. Первая стадия будет лимитирующей, так как: Скорость химических реакций определяется относительной стабильностью интермедиатов, образующихся в лимитирующей
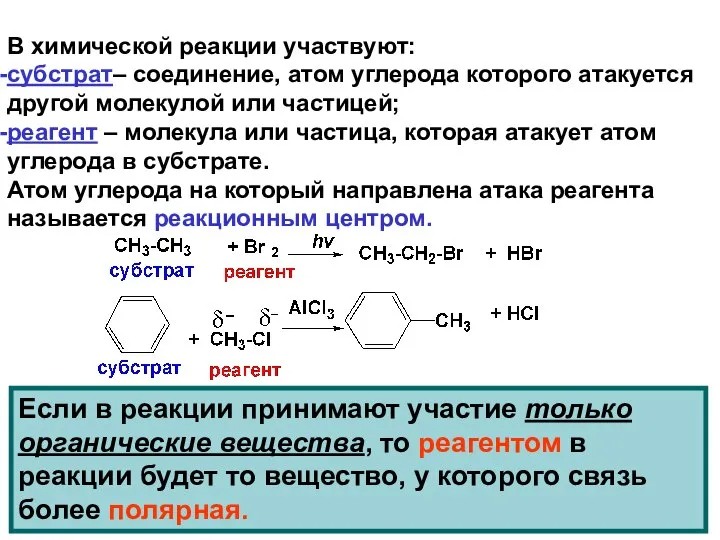
- 10. В химической реакции участвуют: субстрат– соединение, атом углерода которого атакуется другой молекулой или частицей; реагент –
- 11. Типы реагентов Радикальные – свободные атомы или частицы с неспаренным электроном (R) Электрофильные – частицы, которые
- 12. Радикалы (R) Атомы или частицы со свободными электронами: 1. Атомы: F ∙ , Cl ∙, Br
- 13. Электрофилы Е⊕ Атомы с вакантной орбиталью или частицы их содержащие: 1. Катионы: Cl⊕ , Br⊕ ,
- 14. Электрофилы можно классифицировать в зависимости от типа электрофильного атома
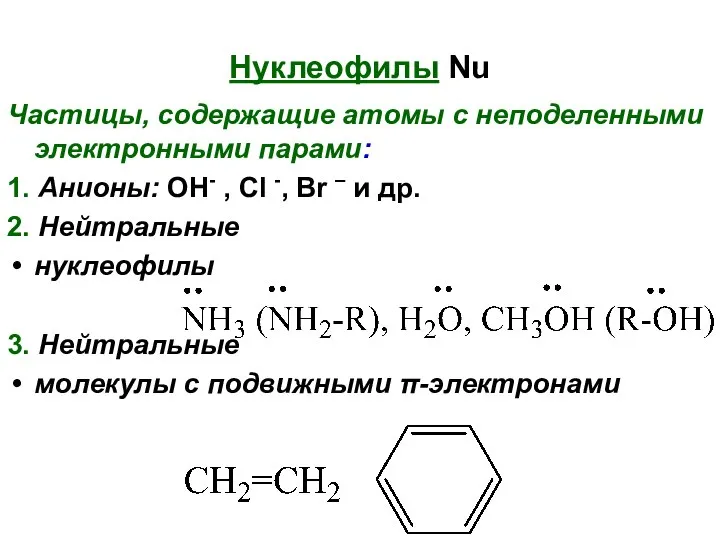
- 15. Нуклеофилы Nu Частицы, содержащие атомы с неподеленными электронными парами: 1. Анионы: OH- , Cl -, Br
- 16. Нуклеофилы можно классифицировать в зависимости от типа нуклеофильного атома
- 17. Классификация органических реакций А). По способу разрыва и образования ковалентной связи в субстрате: а) радикальные: гомолитический
- 18. б) ионные: гетеролитический разрыв связей (гетеролиз)- электронная пара связи переходит на АО только одного атома (образуются
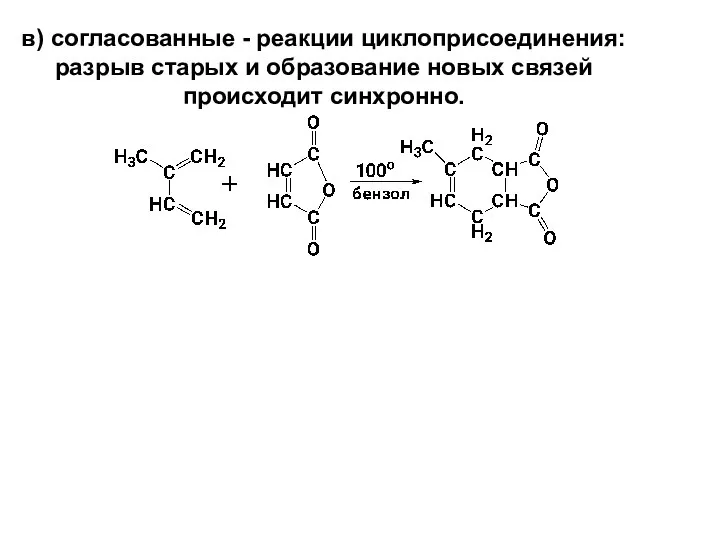
- 19. в) согласованные - реакции циклоприсоединения: разрыв старых и образование новых связей происходит синхронно.
- 20. Б. По направлению реакции, т.е. по результату конечного химического превращения: 1). Замещения (S) – происходит замещение
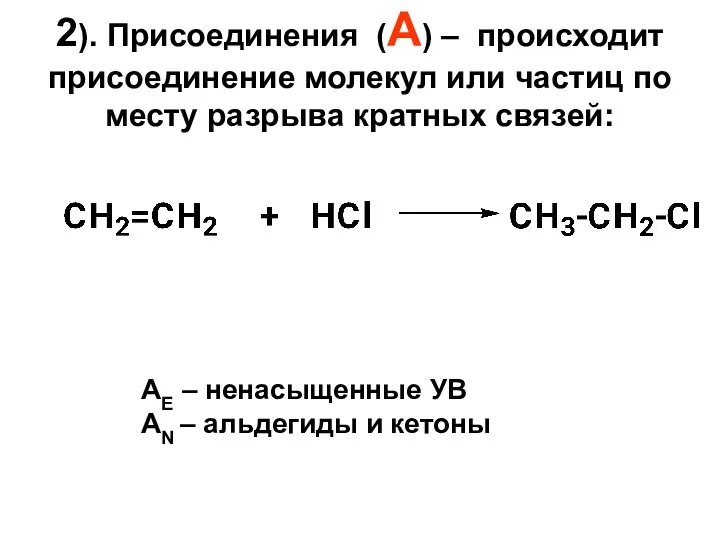
- 21. 2). Присоединения (А) – происходит присоединение молекул или частиц по месту разрыва кратных связей: АЕ –
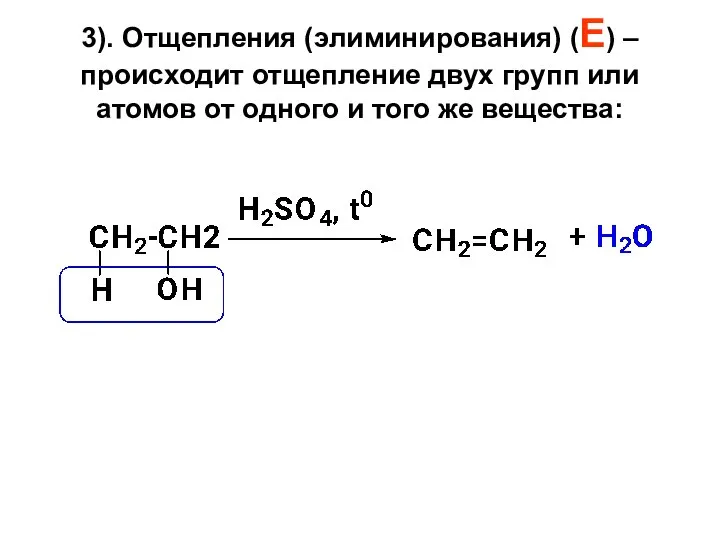
- 22. 3). Отщепления (элиминирования) (Е) – происходит отщепление двух групп или атомов от одного и того же
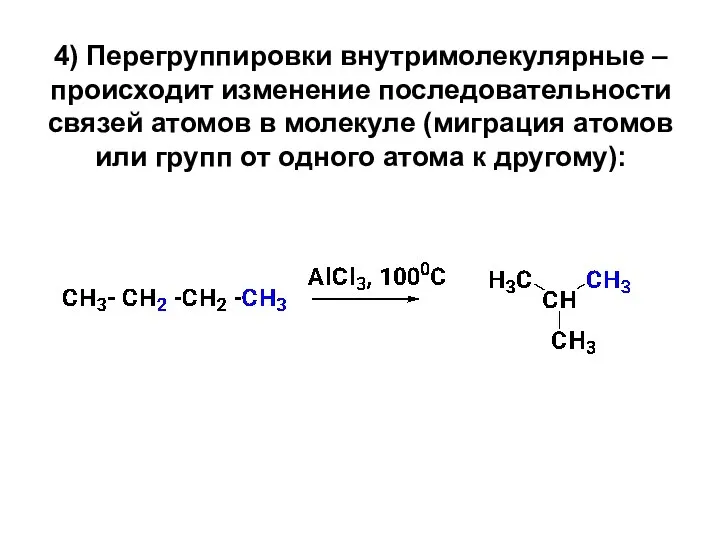
- 23. 4) Перегруппировки внутримолекулярные – происходит изменение последовательности связей атомов в молекуле (миграция атомов или групп от
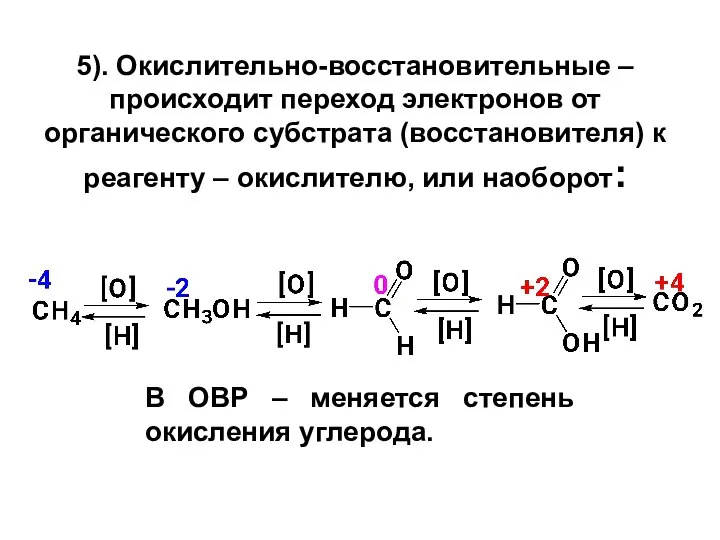
- 24. 5). Окислительно-восстановительные – происходит переход электронов от органического субстрата (восстановителя) к реагенту – окислителю, или наоборот:
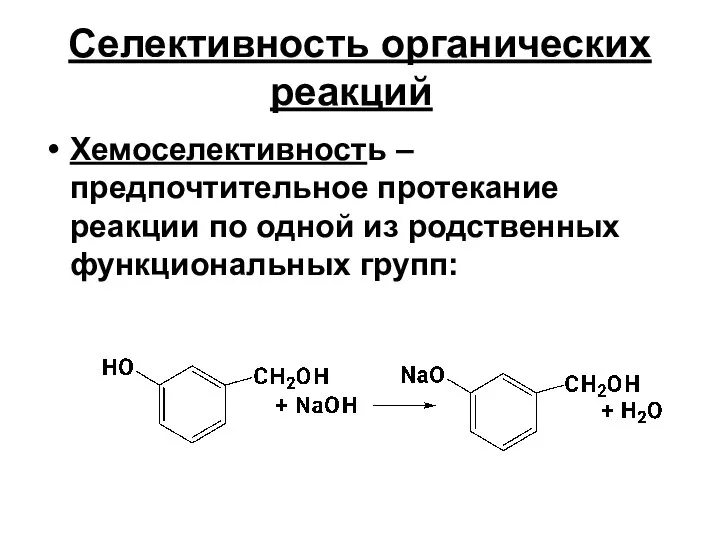
- 25. Селективность органических реакций Хемоселективность – предпочтительное протекание реакции по одной из родственных функциональных групп:
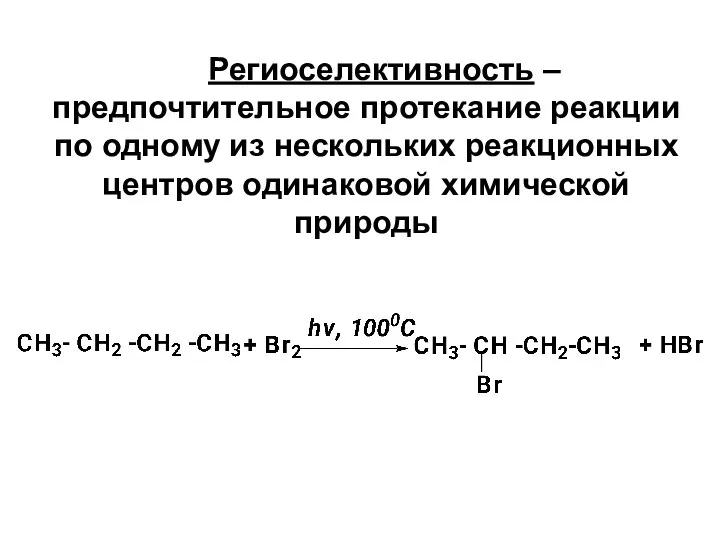
- 26. Региоселективность – предпочтительное протекание реакции по одному из нескольких реакционных центров одинаковой химической природы
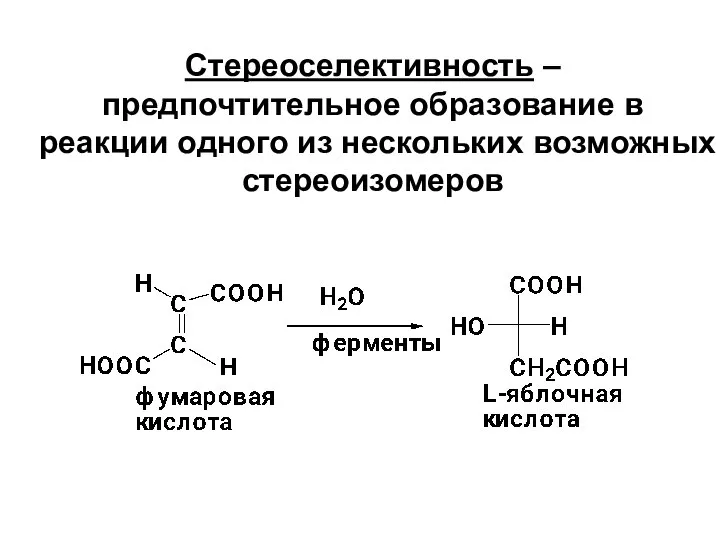
- 27. Стереоселективность – предпочтительное образование в реакции одного из нескольких возможных стереоизомеров
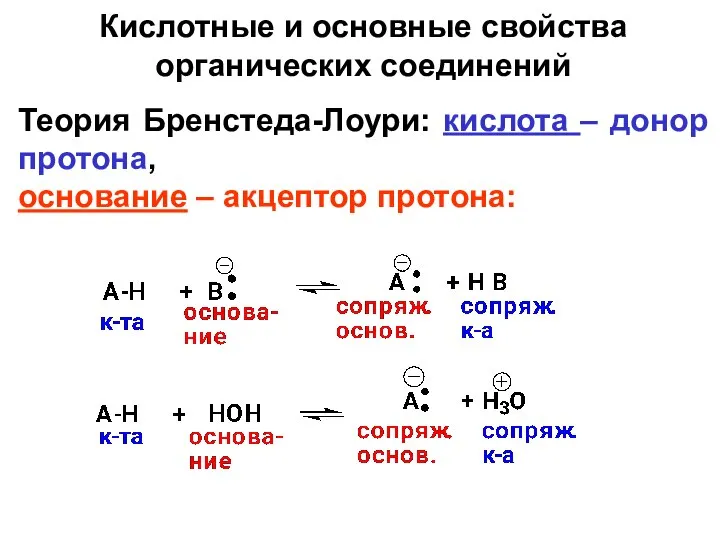
- 28. Кислотные и основные свойства органических соединений Теория Бренстеда-Лоури: кислота – донор протона, основание – акцептор протона:
- 29. Ка –характеризует силу кислоты. Показатель кислотности рКа = – lg Ka. Чем меньше показатель кислотности, тем
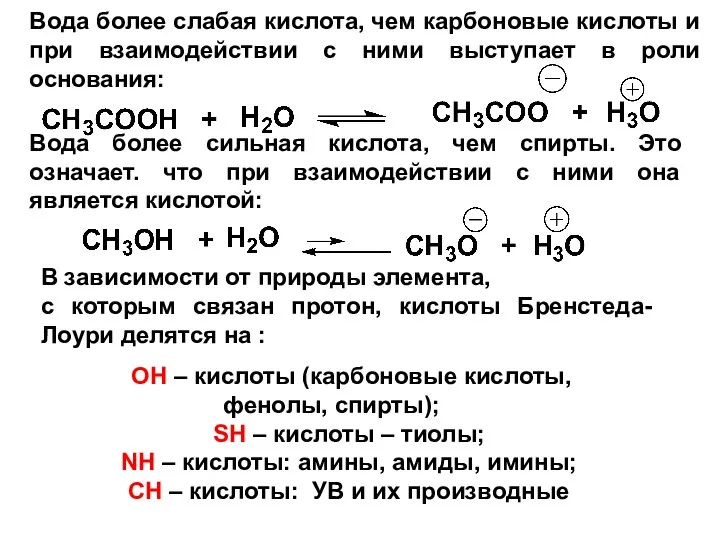
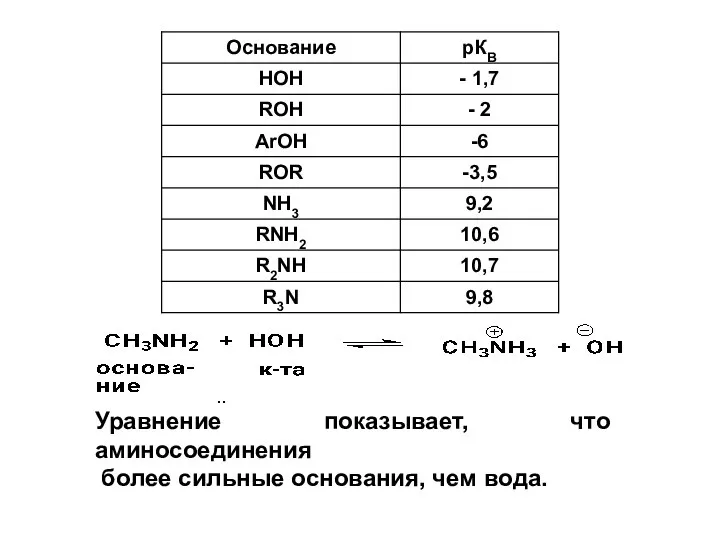
- 30. Вода более сильная кислота, чем спирты. Это означает. что при взаимодействии с ними она является кислотой:
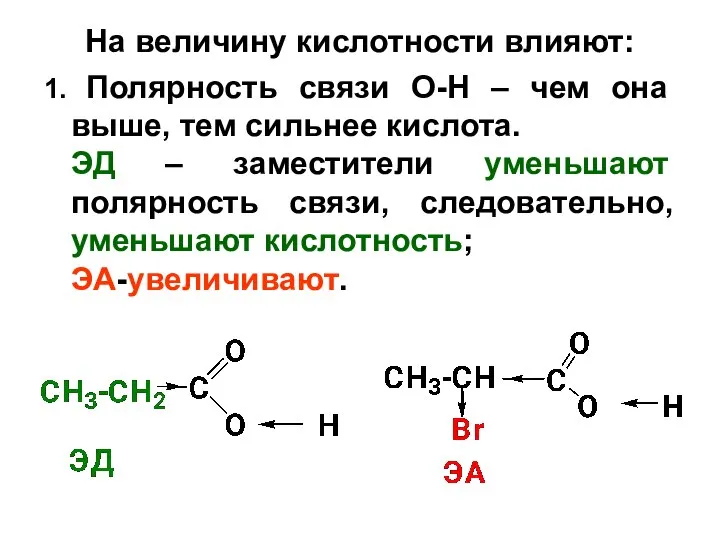
- 31. На величину кислотности влияют: 1. Полярность связи О-Н – чем она выше, тем сильнее кислота. ЭД
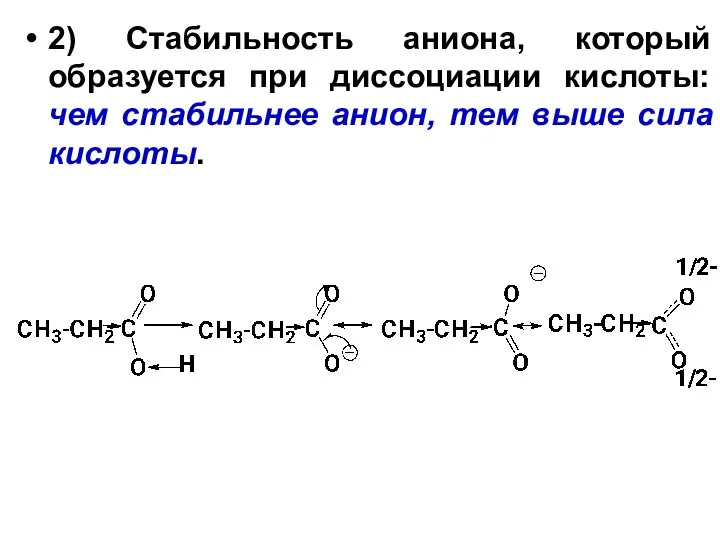
- 32. 2) Стабильность аниона, который образуется при диссоциации кислоты: чем стабильнее анион, тем выше сила кислоты.
- 33. 4) Влияние растворителя: сольватированный растворителем анион будет более стабильным, следовательно сила кислоты будет выше. 3) Тип
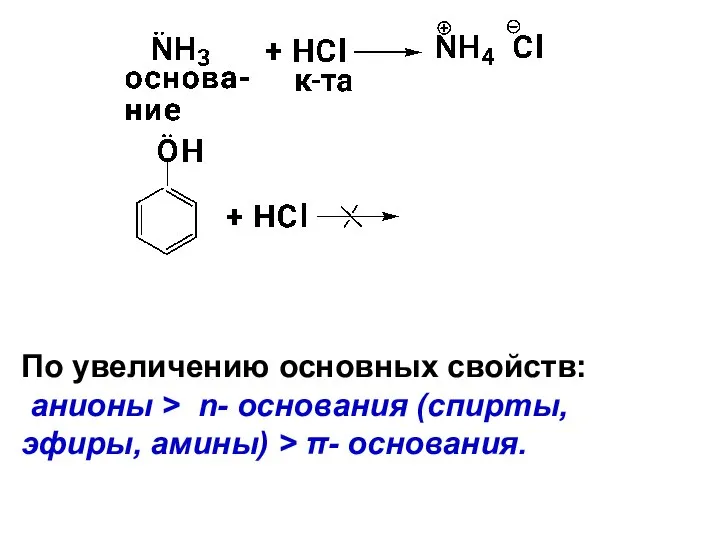
- 34. Основания Бренстеда-Лоури: n– основания, которые содержат неподеленную пару электронов: π– основания: алкены, алкины, алкадиены, арены. Для
- 35. Уравнение показывает, что аминосоединения более сильные основания, чем вода.
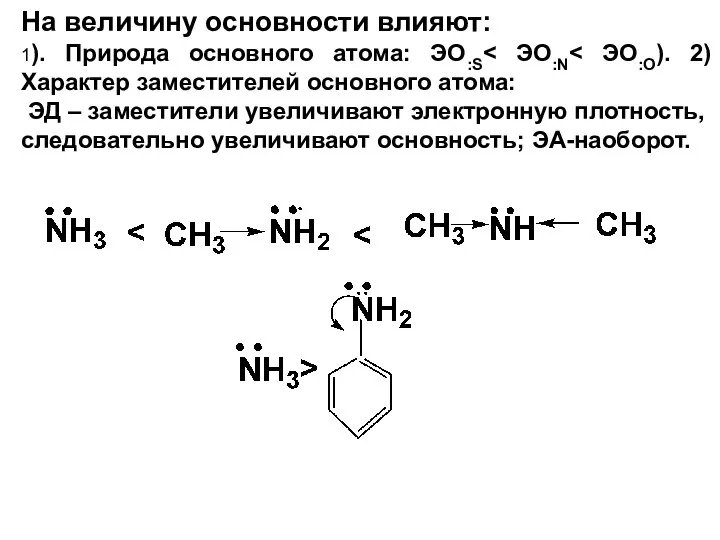
- 36. На величину основности влияют: 1). Природа основного атома: ЭО:S ЭД – заместители увеличивают электронную плотность, следовательно
- 37. По увеличению основных свойств: анионы > n- основания (спирты, эфиры, амины) > π- основания.
- 39. Скачать презентацию

















 Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса
Основой для расчета реакторов с учетом теплового режима служит уравнение теплового баланса Химические формулы CaO
Химические формулы CaO Нуклеин қышқылдары
Нуклеин қышқылдары Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Химия и космос
Химия и космос Строение бензола
Строение бензола Золь. Свойства золи
Золь. Свойства золи Пероксид водорода
Пероксид водорода Получение и применение алкадиенов
Получение и применение алкадиенов Чистые вещества и смеси
Чистые вещества и смеси Презентация на тему Алканы
Презентация на тему Алканы  Преобразование уравнения Нернста. Коэффициент Кда. Причины различия в значениях Кда для различных пород
Преобразование уравнения Нернста. Коэффициент Кда. Причины различия в значениях Кда для различных пород Презентация на тему Оксиды углерода
Презентация на тему Оксиды углерода  Лекция 3
Лекция 3 Порох: из грязи в князи
Порох: из грязи в князи Химическая связь
Химическая связь Сахар-рафинад
Сахар-рафинад Соединения Ca и Mg, представителей элементов II группы главной подгруппы
Соединения Ca и Mg, представителей элементов II группы главной подгруппы Соляная кислота и ее свойства
Соляная кислота и ее свойства тэд — без анимации(1)
тэд — без анимации(1) Полимеры. Полиэтилен
Полимеры. Полиэтилен Обнаружение крахмала
Обнаружение крахмала Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Химическая связь и строение вещества
Химическая связь и строение вещества Алкены. Физические и химические свойства
Алкены. Физические и химические свойства Цинк (Zn)
Цинк (Zn) Вода в природе. Состав, свойства и применение воды
Вода в природе. Состав, свойства и применение воды Скорость химической реакции
Скорость химической реакции