Содержание
- 2. Содержание : 1. Определение сущности процесса электролиза 2. Электролиз в расплавах: а) процессы на катоде б)
- 3. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического
- 4. Электролиз в расплавах На катоде происходит процесс восстановления • В расплавах катионы металла восстанавливаются до свободного
- 5. Электролиз в расплавах На аноде происходит процесс окисления • В расплавах анионы бескислородных кислот (кроме фторидов)
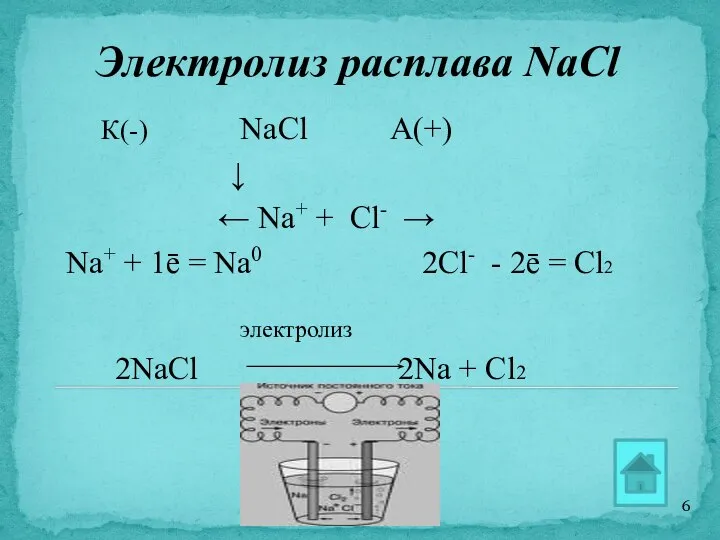
- 6. Электролиз расплава NaCl К(-) NaCl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē =
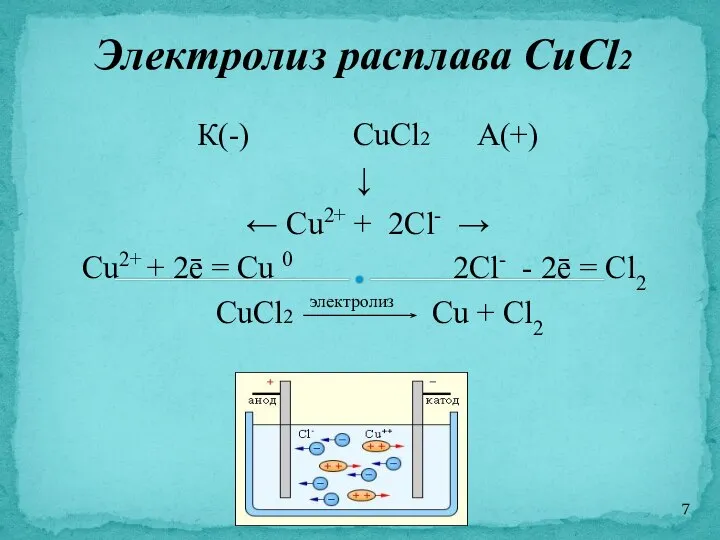
- 7. К(-) CuCl2 А(+) ↓ ← Cu2+ + 2Cl- → Cu2+ + 2ē = Cu 0 2Cl-
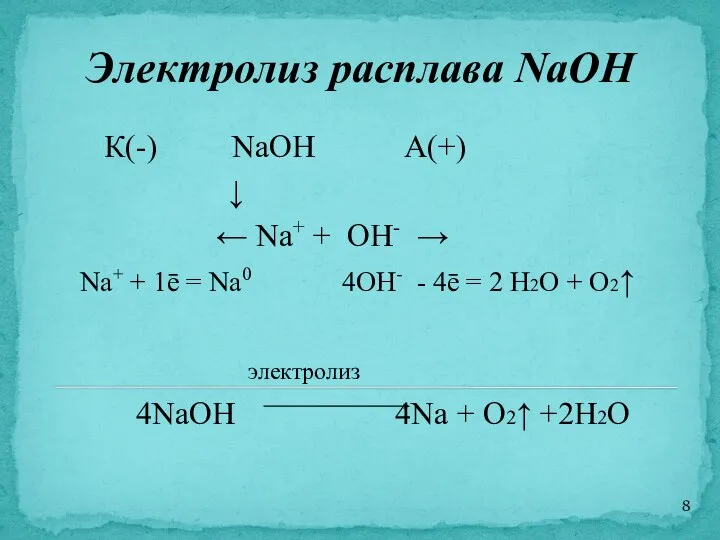
- 8. Электролиз расплава NaOH К(-) NaOH А(+) ↓ ← Na+ + OH- → Na+ + 1ē =
- 9. Электролиз в растворах (процесс на катоде) В растворах процесс на катоде не зависит от материала катода,
- 10. Электролиз в растворах (процесс на катоде) б) Если металл расположен в ряду напряжений между Al и
- 11. Процесс на аноде В растворах процесс на аноде зависит от материала анода и от природы аниона.
- 12. Процесс на аноде б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление
- 13. Электролиз раствора NaCl на инертном аноде К(-) NaCl А(+) ↓ ← Na+ + Cl- → 2Н2О
- 14. Электролиз раствора CuSO4 на инертном аноде К(-) CuSO4 А(+) ↓ ← Cu2+ + SO42- → Cu2+
- 15. Электролиз раствора NaCl на растворимом аноде К(-) NaCl А(+) ↓ (Cu) ← Na+ + Cl- →
- 16. Применение электролиза: получение чистых металлов (Алюминий, магний, натрий, кадмий получают только электролизом)
- 17. очистка металлов
- 18. получение щелочей, хлора, водорода
- 19. защита металлов от коррозии (При этом на поверхности металлических изделий электрохимическим методом наносят тонкий слой другого
- 20. копирование рельефных изделий из металлов и других материалов. Гальванопластика позволяет создавать документально точные копии барельефов, монет,
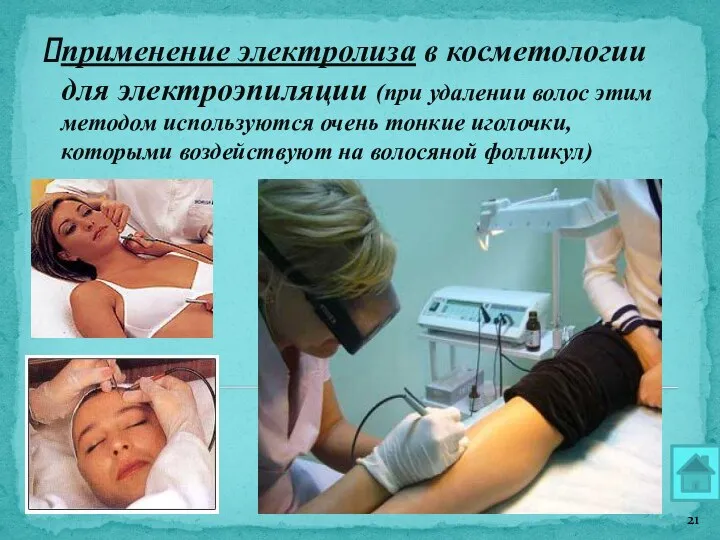
- 21. применение электролиза в косметологии для электроэпиляции (при удалении волос этим методом используются очень тонкие иголочки, которыми
- 22. Тест по теме "Электролиз" 1. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется:
- 23. 3. При электролизе расплава гидроксида натрия на аноде выделяется: а) натрий; б) водород; в) кислород; г)
- 24. 5. Процесс на катоде при электролизе растворов солей зависит от: а) природы катода; б) активности металла;
- 25. 7. При электролизе 240 г 15%-го раствора гидроксида натрия на аноде выделилось 89,6 л (н.у.) кислорода.
- 26. А теперь проверим ваши ответы! 1-б 2-б 3-в, г 4-а, г 5-б 6- в 7- в
- 27. Домашнее задание: Учебник О.С.Габриеляна Химия 11 класс § 18 (стр.217 - 222), упр. 22,23,25.
- 28. Список использованной литературы: 1. О.С.Габриелян Учебник химии для 11 класса, М., Дрофа, 2004г. Интернет – ресурсы:
- 30. Скачать презентацию























 Klas_kh_r_-ur_-urok1
Klas_kh_r_-ur_-urok1 Устройство лабораторного штатива
Устройство лабораторного штатива Презентация на тему Роль химии в жизни общества
Презентация на тему Роль химии в жизни общества  Презентация на тему Электролиты
Презентация на тему Электролиты  Триметилалюминий
Триметилалюминий Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Щелочные металлы и их соединения
Щелочные металлы и их соединения Основные понятия химической кинетики. Скорость химической реакции
Основные понятия химической кинетики. Скорость химической реакции Периодическая система Д. И. Менделеева. Знаки химических элементов
Периодическая система Д. И. Менделеева. Знаки химических элементов Комплексные соли. 11 класс
Комплексные соли. 11 класс Полный синтез метилового эфира - пенталенолактона
Полный синтез метилового эфира - пенталенолактона Химия и краски
Химия и краски Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Взвешивание. Аналитические весы
Взвешивание. Аналитические весы Значение коллодиной химии в производстве
Значение коллодиной химии в производстве Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Состав и строение атома. Изотопы
Состав и строение атома. Изотопы Классификация органических реакций, реагентов
Классификация органических реакций, реагентов Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Состояния вещества. Тест. 5 класс
Состояния вещества. Тест. 5 класс Вуглеводи. Групи
Вуглеводи. Групи К решению задач по диссоциации
К решению задач по диссоциации Ароматические системы
Ароматические системы Углеводороды: соединения, состоящие из углерода и водорода
Углеводороды: соединения, состоящие из углерода и водорода Тема: Неметаллы
Тема: Неметаллы Презентация на тему Ролевая игра "Суд над этанолом"
Презентация на тему Ролевая игра "Суд над этанолом"  Олигосахариды и полисахариды
Олигосахариды и полисахариды Исследование химического состава разных сортов картофеля
Исследование химического состава разных сортов картофеля