Содержание
- 2. Понятие об алкенах Алкены – углеводороды, содержащие в молекуле одну двойную связь между атомами углерода, а
- 3. Гомологический ряд алкенов Этен Пропен Бутен Пентен Гексен Гептен C2H4 C3H6 C4H8 C5H10 C6H12 C7H14 Общая
- 4. Изомерия алкенов Для алкенов возможны два типа изомерии: 1-ый тип – структурная изомерия: углеродного скелета положения
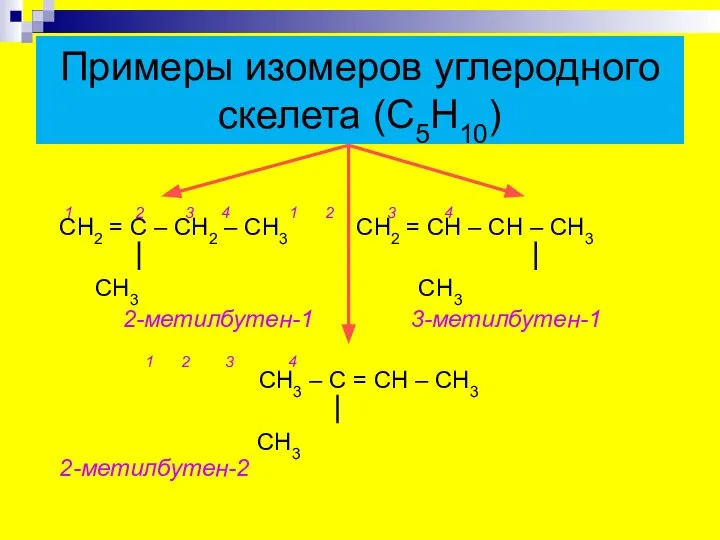
- 5. Примеры изомеров углеродного скелета (С5Н10) 1 2 3 4 1 2 3 4 СН2 = С
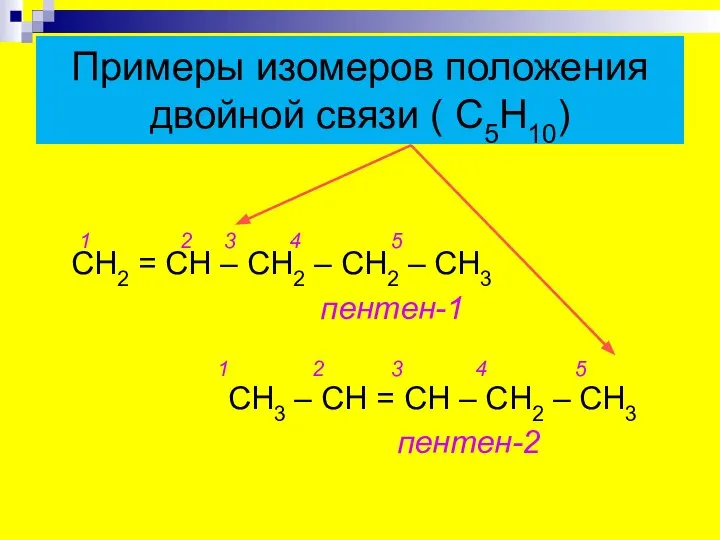
- 6. Примеры изомеров положения двойной связи ( С5Н10) 1 2 3 4 5 СН2 = СН –
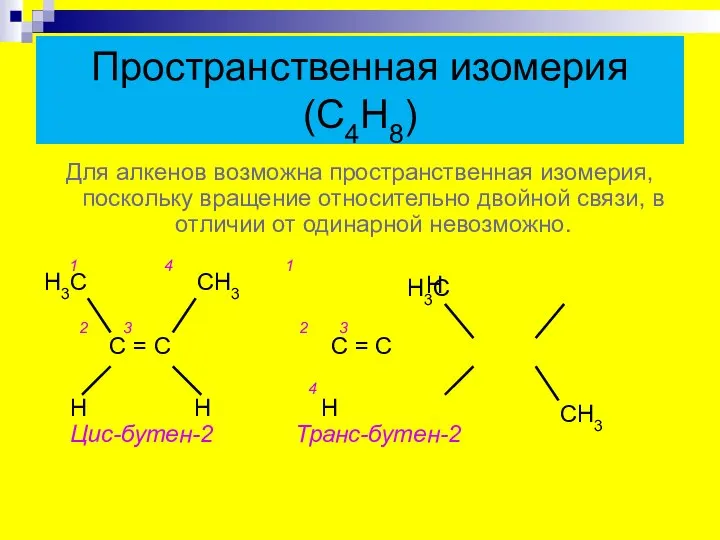
- 7. Пространственная изомерия (С4Н8) Для алкенов возможна пространственная изомерия, поскольку вращение относительно двойной связи, в отличии от
- 8. Геометрические изомеры бутена Цис-изомер Транс-изомер
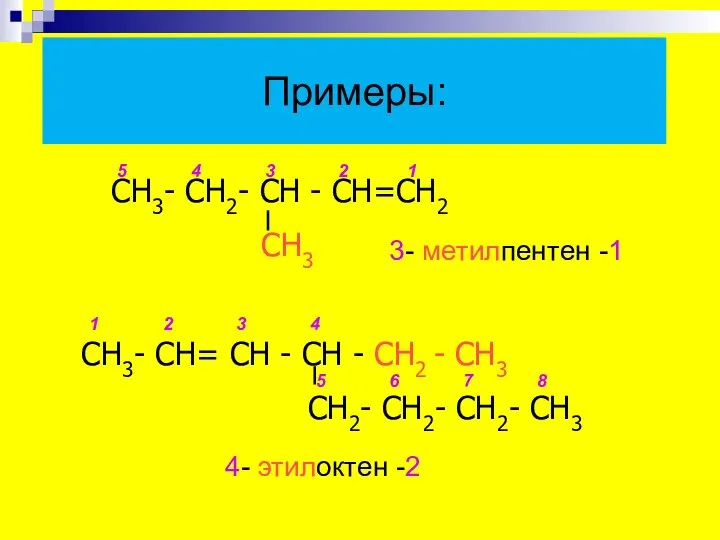
- 9. Примеры: 4- этилоктен -2 СН3- СН2- СН - СН=СН2 СН3 СН3- СН= СН - СН -
- 10. Физические свойства алкенов Алкены плохо растворимы в воде, но хорошо растворяются в органических растворителях. С2– С4
- 11. Химические свойства алкенов По химическим свойствам алкены резко отличаются от алканов. Алкены более химически активные вещества,
- 12. Типы химических реакций, которые характерны для алкенов Реакции присоединения. Реакции полимеризации. Реакции окисления.
- 13. Реакции присоединения 1. Гидрирование. CН2 = СН2 + Н2 СН3 – СН3 Этен этан Условия реакции:
- 14. Реакции присоединения 3. Гидрогалогенирование. 1 2 3 4 1 2 3 4 СН2 = СН –
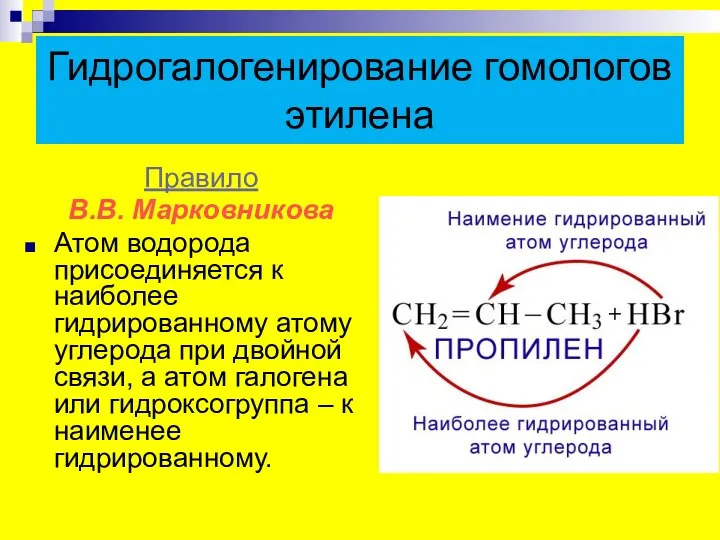
- 15. Гидрогалогенирование гомологов этилена Правило В.В. Марковникова Атом водорода присоединяется к наиболее гидрированному атому углерода при двойной
- 16. Реакции полимеризации (свободно-радикальное присоединение) Полимеризация – это последовательное соединение одинаковых молекул в более крупные. σ σ
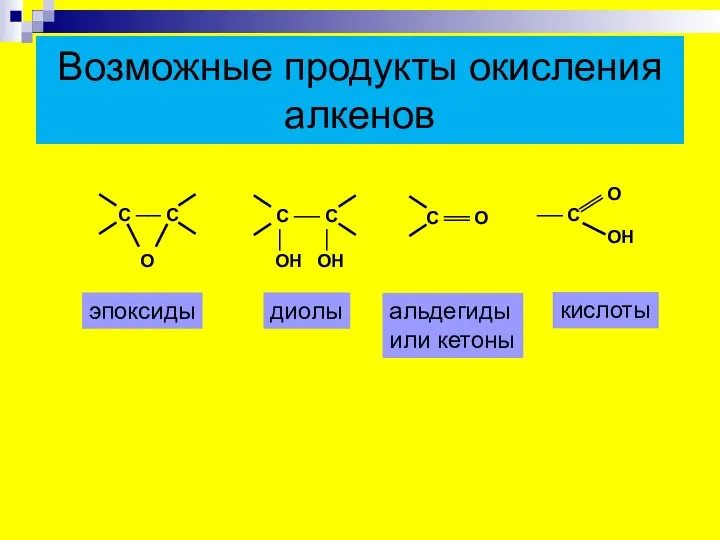
- 17. Возможные продукты окисления алкенов эпоксиды диолы альдегиды или кетоны кислоты
- 18. Реакции окисления Реакция Вагнера. (Мягкое окисление раствором перманганата калия). 3СН2 = СН2 + 2КМnО4 + 4Н2О
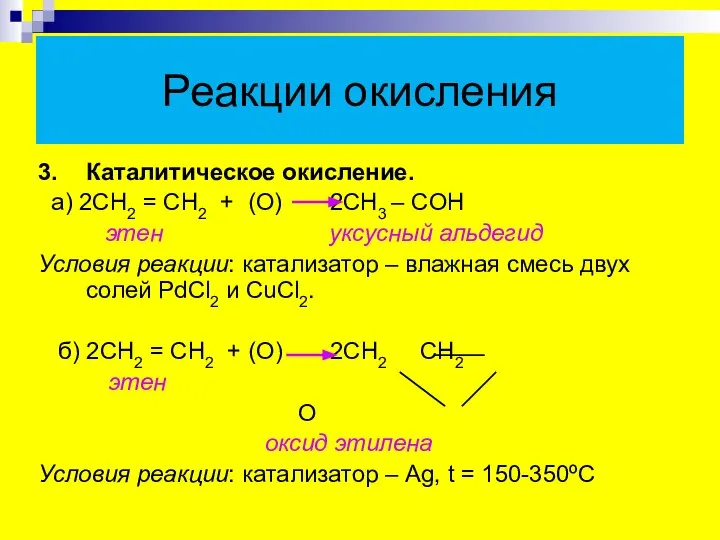
- 19. Реакции окисления 3. Каталитическое окисление. а) 2СН2 = СН2 + (О) 2СН3 – CОН этен уксусный
- 20. Горение алкенов Алкены горят красноватым светящимся пламенем, в то время как пламя предельных углеводородов голубое. Массовая
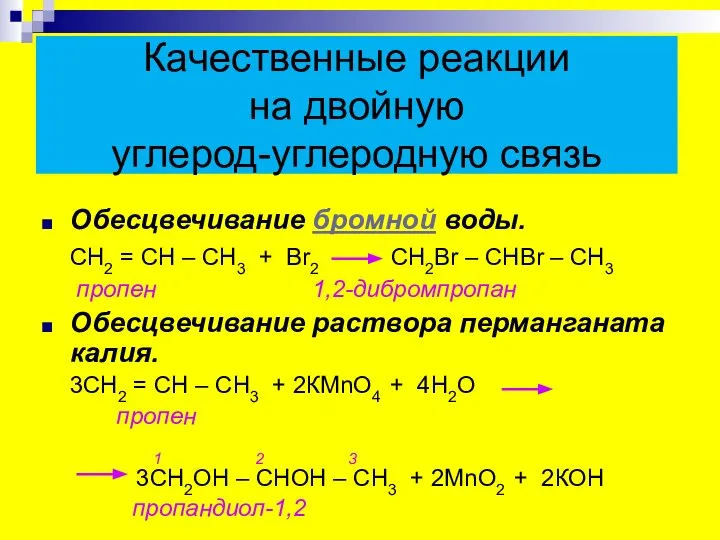
- 21. Качественные реакции на двойную углерод-углеродную связь Обесцвечивание бромной воды. СН2 = СН – СН3 + Вr2
- 22. Применение Алкены широко используются в промышленности в качестве исходных веществ для получения растворителей (спирты, дихлорэтан, эфиры
- 23. Это интересно Всем известный полиэтилен был получен был получен в 1933 году Э. Фосеттом и Р.
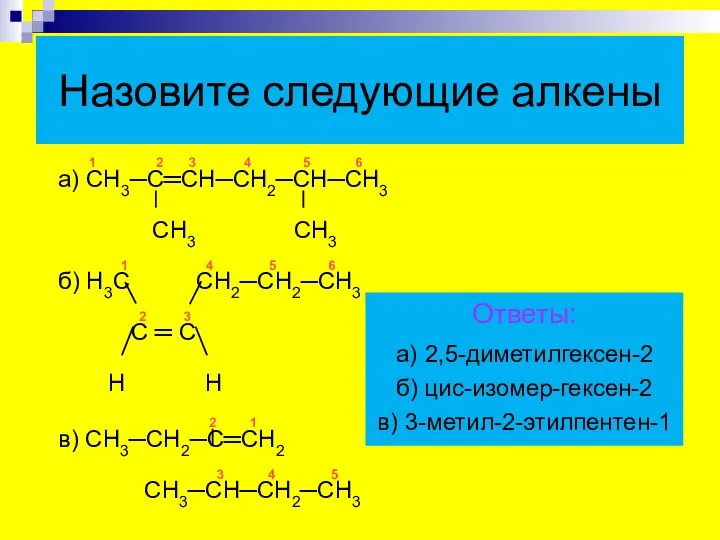
- 24. 1 2 3 4 5 6 а) СН3─С═СН─СН2─СН─СН3 СН3 СН3 1 4 5 6 б) Н3С
- 25. а) СН3-СН=СН2 + НСl → ? б) СН2=СН-СН2-СН3 + НBr → ? В) СН3-СН2-СН=СН2 + НОН
- 27. Скачать презентацию















 Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Диаграммы состояния сплавов двухкомпонентных систем
Диаграммы состояния сплавов двухкомпонентных систем Парфюмерные товары
Парфюмерные товары Комплексные соединения
Комплексные соединения Hydroxidy. Vlastnosti
Hydroxidy. Vlastnosti Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Презентация на тему Хлор
Презентация на тему Хлор  Супер-химия. Викторина
Супер-химия. Викторина Производство полимеров в РК
Производство полимеров в РК Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Презентация на тему Техника безопасности для учащихся в кабинете химии
Презентация на тему Техника безопасности для учащихся в кабинете химии  Алканы
Алканы Общие способы получения металлов
Общие способы получения металлов Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Щелочноземельные металлы
Щелочноземельные металлы Презентация по Химии "Ароматические углеводороды в природе. Области их применения"
Презентация по Химии "Ароматические углеводороды в природе. Области их применения"  Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  Коррозия металлов и ГЭ
Коррозия металлов и ГЭ Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Тест. Химическая связь
Тест. Химическая связь Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Основы МКТ
Основы МКТ Неорганические вещества в быту
Неорганические вещества в быту Пероксид водорода
Пероксид водорода Алюминий и его соединения
Алюминий и его соединения Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс) Химико-металлургические методы
Химико-металлургические методы