Слайд 2Задачи:
Изучить физические и химические свойства оснований;
Развивать умения:
сравнивать вещества,
составлять уравнения

реакций,
работать с химическими реактивами, работать в парах.
Слайд 3ЧТО ТАКОЕ ОСНОВАНИЯ?
Основания- сложные вещества, состоящие из атома металла, связанного с одной

или несколькими гидроксогруппами -ОН.
Слайд 5Общая формула оснований:
Ме(ОН)n, где
Ме - металл
n-число гидроксогрупп и одновременно валентность металла.

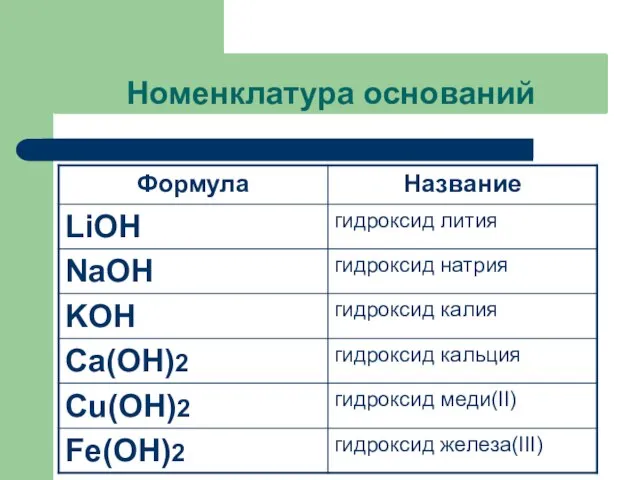
Слайд 6Номенклатура оснований
Название оснований=
Гидроксид + название металла в родительном падеже + валентность

римскими цифрами (переменная)
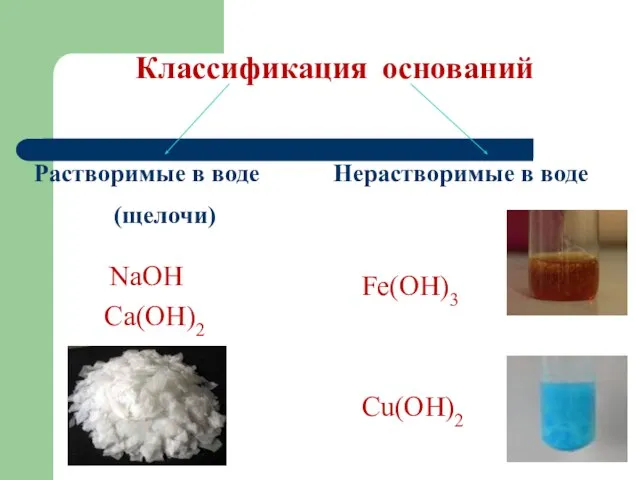
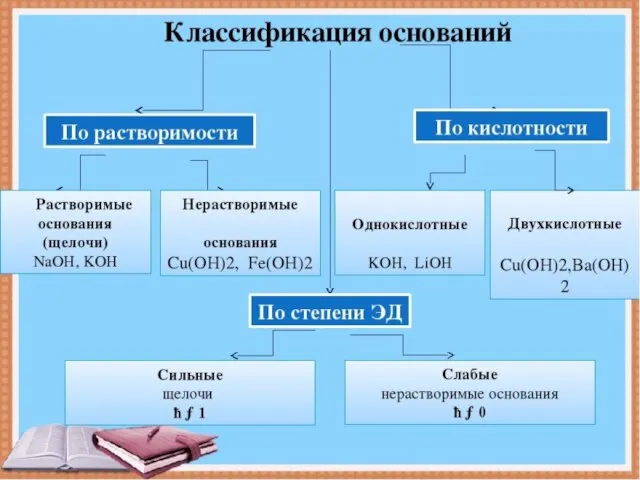
Слайд 9Классификация оснований
Растворимые в воде
(щелочи)
Нерастворимые в воде
NaOH
Ca(OH)2
Fe(OH)3
Сu(OH)2
Слайд 10Физические свойства
Основания - твердые кристаллические вещества.
В воде растворимы щелочи:
LiOH

, NaOH, KOH, CsOH, RbOH, Ca(OH)2, Sr(OH)2,Ba(OH)2,
другие - малорастворимы.
Слайд 11Физические свойства
Основания – твердые вещества.
Щелочи растворяются в воде ( к ним

относят основания металлов 1 и 2 а подгрупп, кроме магния и бериллия), мылки на ощупь.
Щелочи очень едкие вещества, могут разъедать ткани и кожу, поэтому обращаться с ними нужно очень осторожно. При попадании на кожу щелочь нейтрализуются слабым раствором уксусной, борной кислот и смывают большим количеством воды.
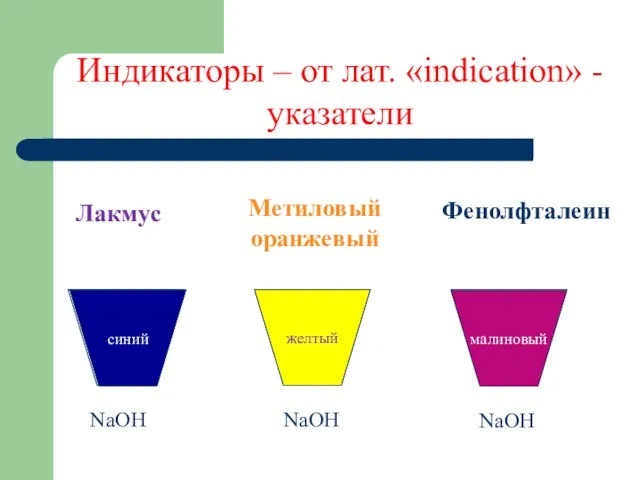
Слайд 12Индикаторы – от лат. «indication» - указатели
NaOH
NaOH
NaOH
Лакмус
Метиловый оранжевый
Фенолфталеин
желтый
малиновый
синий
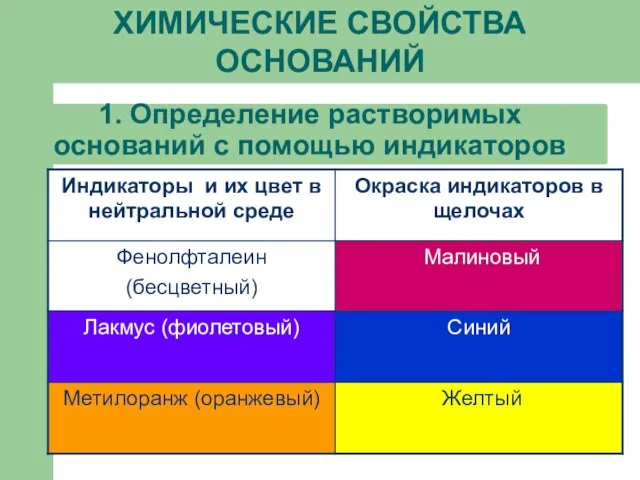
Слайд 131. Определение растворимых оснований с помощью индикаторов
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
Слайд 14Важнейшие представители и их применение
NaOH, KOH, Ca(OH)2:
твердые, очень едкие вещества, растворимые

в воде, мылкие на ощупь. При попадании на кожу их следует нейтрализовать слабым раствором борной или уксусной кислоты и смыть водой.
NaOH - гидроксид натрия или едкий натр. Используют при производстве мыла, в кожевенной и фармацевтической промышленности.
KOH - гидроксид калия или едкое кали. Применяют при производстве жидкого мыла, стекла.
Ca(OH)2 - гидроксид кальция или гашеная известь. Немного растворимо в воде. Прозрачный раствор гидроксида кальция называется известковой водой. Ее используют для обнаружения углекислого газа (при пропускании СО2 известковая вода мутнеет, т.к. образуется нерастворимый карбонат кальция) Гидроксид кальция применяется в строительстве, для побелки, получения дезинфицирующего средства (хлорной извести)
Слайд 15Щелочи в быту
Гидроксид натрия, техническое название едкий натр или каустическая сода.

Едкий натр кристаллическое вещество белого или желтоватого цвета, изготавливают в промышленности в виде гранул. Обладает сильнейшим моющим действием, хорошо растворяет жиры. Используется очистки масляных пятен с различных изделий, для прочистки от жировых отложений в канализационных трубах.
Гидроксид кальция, техническое название -гашеная известь. Используется в строительстве для штукатурки стен внутри помещений, для побелки стен бытового и технического назначения.
Раствор аммиака (нашатырный спирт)-жидкость с раздражающим слизистые оболочки носа и глаз запахом. В быту используется 25% раствор. Применяется для стирки шерстяных изделий, для удаления пятен органического происхождения: молока, смол, жиров. Находит широкое применение в средствах для мытья стекол. Обладая хорошим моющим действием нашатырный спирт не оставляет разводов на поверхности. Раствор аммиака можно использовать для очистки изделий из золота и серебра, опуская их в нагретый раствор. Аммиак образует с металлами растворимые в воде соединения.
.
Слайд 16ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
2.Взаимодействие с кислотами
KOH+HCl=KCl+H2O
Cu(OH)2+2HCl=CuCl2+2H2O

Слайд 17Взаимодействие с кислотами:
2NaOH + H2SO4 → Na2SO4 + 2H2O
реакция нейтрализации

Слайд 19ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
3.Взаимодействие с кислотными оксидами
2KOH+CO2=K2CO3+H2O

Слайд 20Взаимодействие с кислотными оксидами
Са(ОН)2 + СО2 → СаСО3↓ + Н2О
реакция обмена

Слайд 21ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
4.Взаимодействие с амфотерными оксидами
2KOH+ZnO=K2ZnO2+H2O

Слайд 22ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание

2NaOH+CuCl2=Cu(OH)2 = 2NaCl
Слайд 23
CuSO4 + 2NaOH→Cu(OH)2↓+ Na2SO4
FeCl3 + 3NaOH→Fe(OH)3↓+ 3NaCl
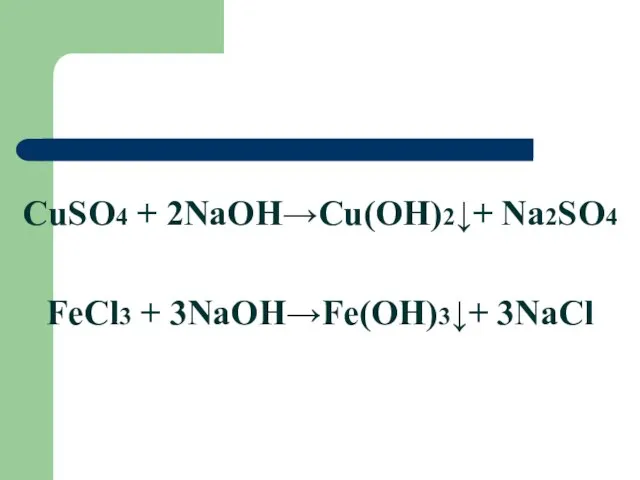
Слайд 24ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
6.При нагревании разлагаются
(кроме LiOH):
Cu (OH)2 = CuO+H2O
t

Слайд 25 Отношение оснований к нагреванию
Cu(OH)2 → CuO↓ + H2O
t

Слайд 26ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
7. Амфотерные гидроксиды Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3
и другие

взаимодействуют с кислотами
Zn (OH)2+2HCl=ZnCl2+2H2O
Взаимодействуют с щелочами Al(OH)3+NaOH=Na[Al(OH)4]
Слайд 28Домашнее задание:
Выучить §41, задания в доп.материалах



















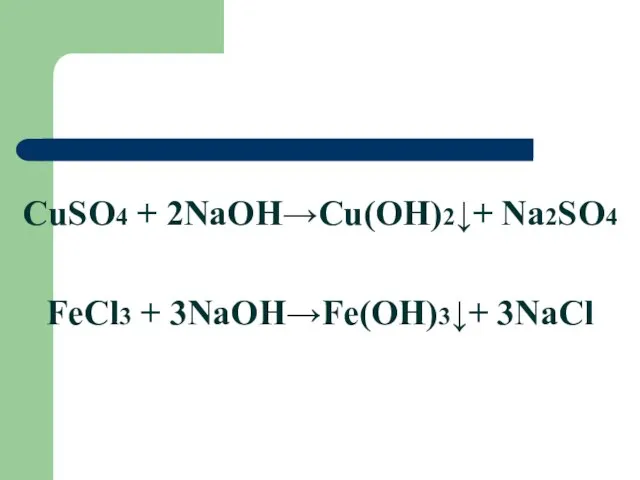





 Степень окисления. Составление формул бинарных соединений. 8 класс
Степень окисления. Составление формул бинарных соединений. 8 класс Химиялық есептердің кеңістіктік шешімдері
Химиялық есептердің кеңістіктік шешімдері Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу Пример выполнения проверочной работы по теме углеводороды
Пример выполнения проверочной работы по теме углеводороды Физико-химические свойства нефтепродуктов
Физико-химические свойства нефтепродуктов Образование дипептида
Образование дипептида Химия и жизнь
Химия и жизнь Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Сравнительная характеристика стиральных порошков
Сравнительная характеристика стиральных порошков Энергетические уровни
Энергетические уровни Морфологія та походження мінералів. Елементи кристалографії
Морфологія та походження мінералів. Елементи кристалографії Железо
Железо Белки
Белки Суд над химическим элементом Углерод
Суд над химическим элементом Углерод Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Открытия в химии
Открытия в химии Газ тәрізді өнімдер бромды сутек
Газ тәрізді өнімдер бромды сутек Электролиз
Электролиз Концентрированная серная кислота
Концентрированная серная кислота Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  хімія
хімія Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Основные свойства и опасности нефти. Безопасность для танкеров
Основные свойства и опасности нефти. Безопасность для танкеров Жиры
Жиры Карбораны. Особенности строения молекулы. Получение и химические свойства
Карбораны. Особенности строения молекулы. Получение и химические свойства