Содержание
- 2. Содержание Виды оксидов азота. Оксид азота( Оксид азота(I) Оксид азота(I). Оксид азота( Оксид азота(II) Оксид азота(II).
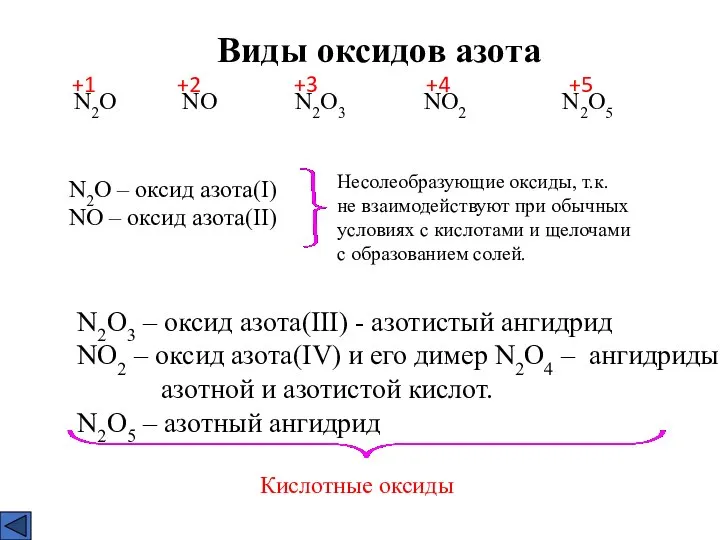
- 3. Виды оксидов азота N2O NO N2O3 NO2 N2O5 +1 +2 +3 +4 +5 N2O – оксид
- 4. Оксид азота(I) - N2O (“веселящий газ”) Физические свойства. Бесцветный газ с тошнотворным cладковатым запахом, обладает анестезирующим
- 5. Оксид азота(II) - NO Физические свойства. Бесцветный газ, при низких температурах - голубая жидкость. В твердом
- 6. Оксид азота(III) - азотистый ангидрид Физические свойства. Это синяя жидкость при обычных условиях. В твердом состоянии
- 7. Оксид азота(IV) - NO2 и его димер N2O4 Физические свойства. Это красно-бурый газ с резким запахом.
- 8. Химические свойства NO2 . Взаимодействие с водой: 2NO2 + H2O(хол) = HNO3 + HNO2 Взаимодействие с
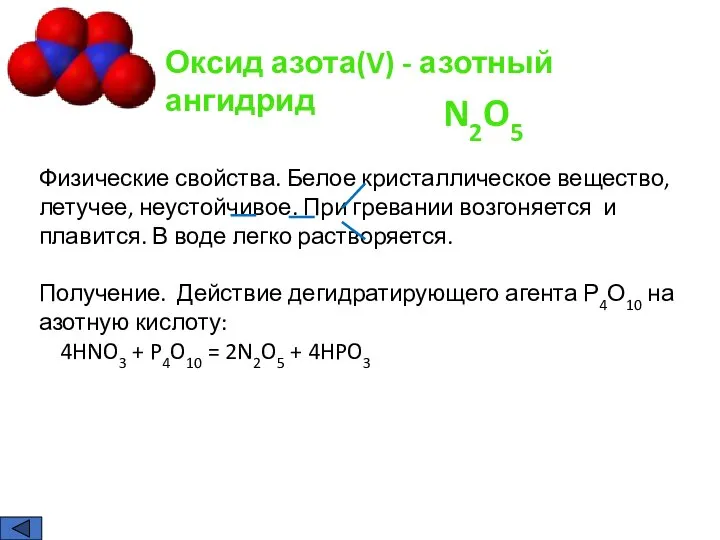
- 9. Оксид азота(V) - азотный ангидрид Физические свойства. Белое кристаллическое вещество, летучее, неустойчивое. При гревании возгоняется и
- 11. Скачать презентацию






 Щелочные металлы
Щелочные металлы Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли  Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1
Вычислительные методы в химии. Что такое вычислительная (компьютерная) химия. Лекция 1 Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Презентация на тему Соли угольной кислоты
Презентация на тему Соли угольной кислоты  ліпіди
ліпіди Занимательная химия в 8 классе
Занимательная химия в 8 классе Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)
Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6) Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Презентация на тему Кристаллы
Презентация на тему Кристаллы  Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Мицелла. Строение мицеллы
Мицелла. Строение мицеллы Многоядерные Арены
Многоядерные Арены Биогеотехнология
Биогеотехнология Основания. 8 класс
Основания. 8 класс Из опыта использования интерактивной доски на уроках химии
Из опыта использования интерактивной доски на уроках химии Презентация на тему Полимеры и их получение
Презентация на тему Полимеры и их получение  Соли. Состав и классификация
Соли. Состав и классификация Степень окисления
Степень окисления Строение атома
Строение атома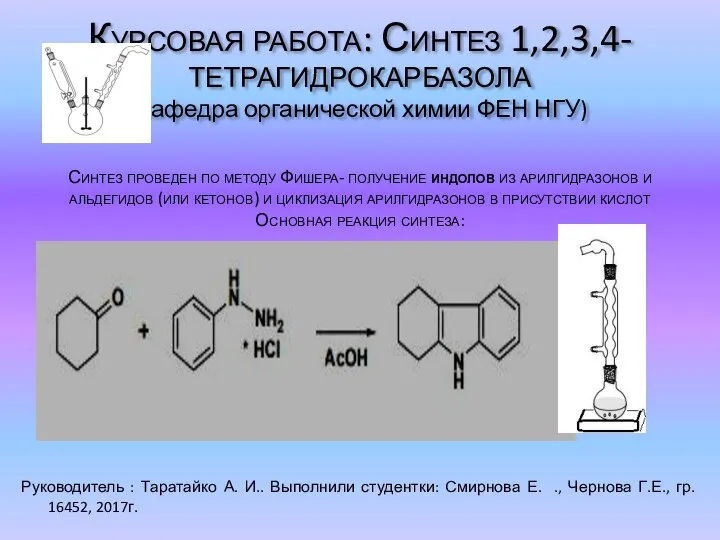 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Производство серной кислоты
Производство серной кислоты Способы получения металлов
Способы получения металлов Мышьяк (As)
Мышьяк (As)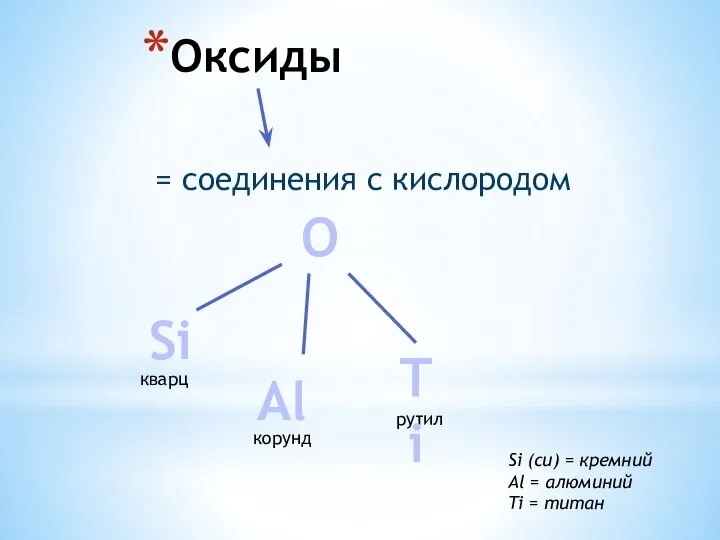 Оксиды. Кварц (SiO2). Корунд (Al2O3)
Оксиды. Кварц (SiO2). Корунд (Al2O3) Биосинтез гема
Биосинтез гема