Содержание
- 2. План. Проблема. Историческая справка. Химический элемент. Простое вещество. Химические свойства. Применение. Круговорот азота.
- 3. Проблема. «Безжизненный» Элемент жизни
- 4. Историческая справка. В 1772 году выделен из воздуха Даниэлем Резерфордом. Не поддерживал горение, дыхание. В 1787
- 5. Жан Антуан Шаптал «Нитрогениум» - рождающий селитру
- 6. Карл-Вильгельм Шееле
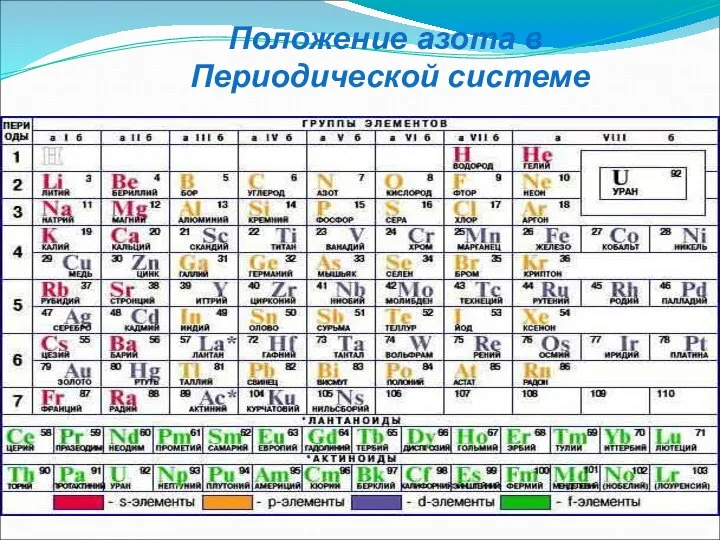
- 7. Положение азота в Периодической системе
- 8. Химический элемент. Природные изотопы: 14N(99 ,6%) 15N(0 ,04%) Входит в состав: NaNO3 натриевой(чилийской) селитры, Белков и
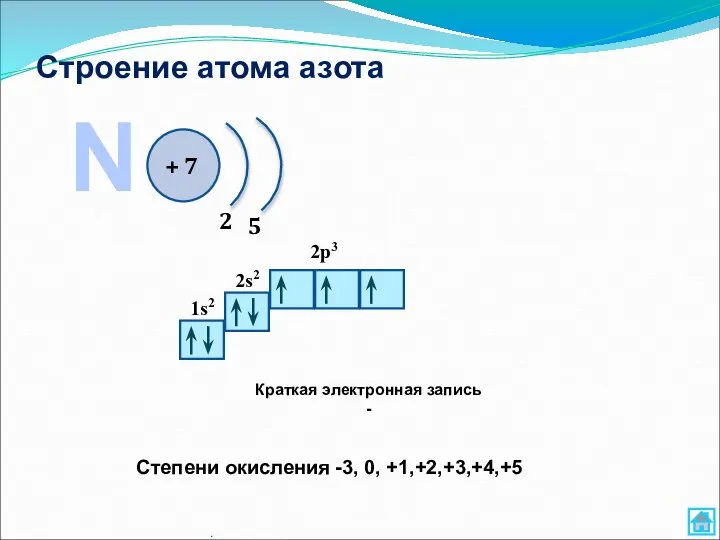
- 9. Строение атома азота . N + 7 2 5 1s2 2s2 2p3 Краткая электронная запись -
- 10. Задание Определим степень окисления азота в соединениях. NH3, N2O5, Mg2N3, NO, HNO3, HNO2, N2
- 11. Простое вещество. Азот-газ, без цвета, без запаха, легче воздуха, плохо растворим в воде. t(с.)=-195,8; t(зам.)=-210. Входит
- 12. Химические свойства азота Для разрыва связи N≡N требуется большое количество энергии, поэтому азот малоактивен Азот –
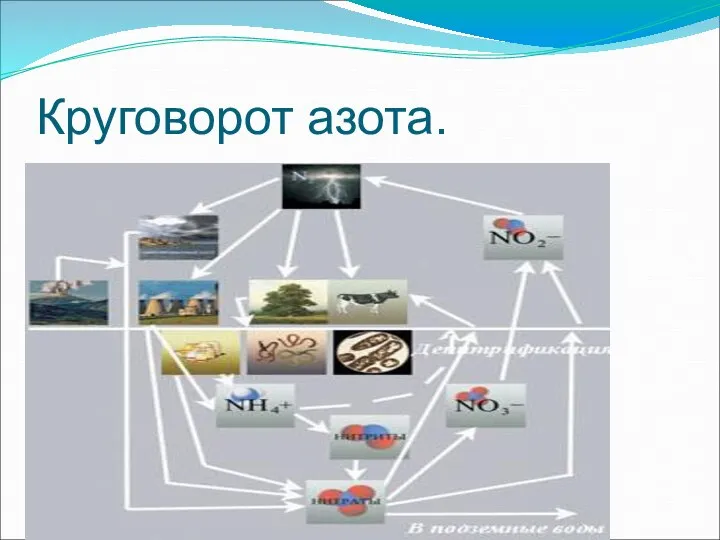
- 13. Круговорот азота.
- 14. Применение. Для охлаждения. Для создания инертной среды. Получение удобрений.
- 16. Скачать презентацию










 Физические свойства
Физические свойства Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Аппаратура ионообменных процессов
Аппаратура ионообменных процессов Получение метанола из синтез-газа
Получение метанола из синтез-газа In aqua veritas. Правда в воде. Задача 12
In aqua veritas. Правда в воде. Задача 12 Изучение процесса замерзания воды
Изучение процесса замерзания воды Химическая связь
Химическая связь Органические соединения в быту. Понятие о бытовых химикатах
Органические соединения в быту. Понятие о бытовых химикатах Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  В1 витамині
В1 витамині Альдегиды. Кетоны
Альдегиды. Кетоны Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Диаграмма состояния системы железо - углерод
Диаграмма состояния системы железо - углерод Презентация на тему Азотная кислота и ее соли (9 класс)
Презентация на тему Азотная кислота и ее соли (9 класс)  Periodická tabuľka prvkov PTP
Periodická tabuľka prvkov PTP Морфологогия минералов
Морфологогия минералов 3 Серная кислота
3 Серная кислота Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Амины и анилин
Амины и анилин Физическая химия
Физическая химия Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов Число химических связей, способных образовать данный атом
Число химических связей, способных образовать данный атом Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит
Иттрий-алюминиевый гранат и иттрий-алюминиевый перовскит Простагландины. Воздействие фосфолипаз на фосфолипид
Простагландины. Воздействие фосфолипаз на фосфолипид Драгоценные камни
Драгоценные камни Полимеры
Полимеры Разветвленные цепные реакции
Разветвленные цепные реакции Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb)