Содержание
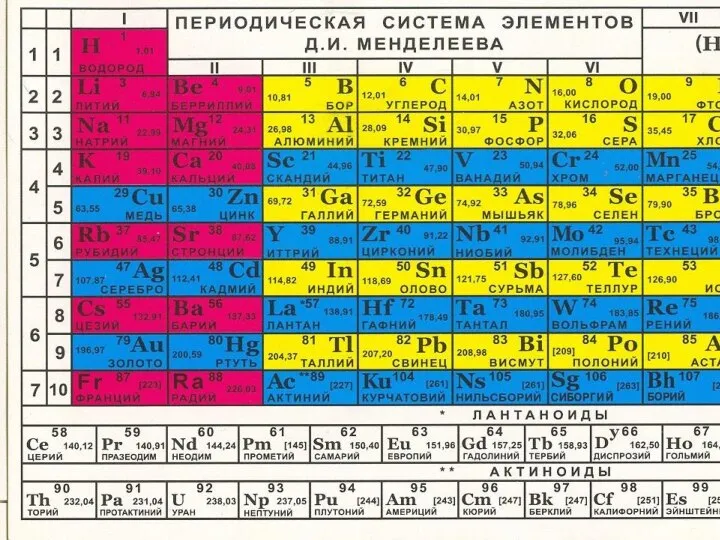
- 3. Химический элемент Порядковый номер 1 Группа – I Период – 1 Электронная формула 1s1 Степени окисления:
- 4. Начало всех начал – водород!
- 5. Водород в космосе
- 6. Ближайшая к нам звезда Галактики, которую мы знаем под именем «Солнце», на 70 % своей массы
- 7. Водород на Земле Вода Нефть Природный газ
- 8. История открытия и названия Водород был обнаружен немецким ученым Т.Парацельсом в XVI веке, когда он погружал
- 9. Физические свойства Водород – газ, без цвета, вкуса и запаха. Намного легче воздуха. В виду малой
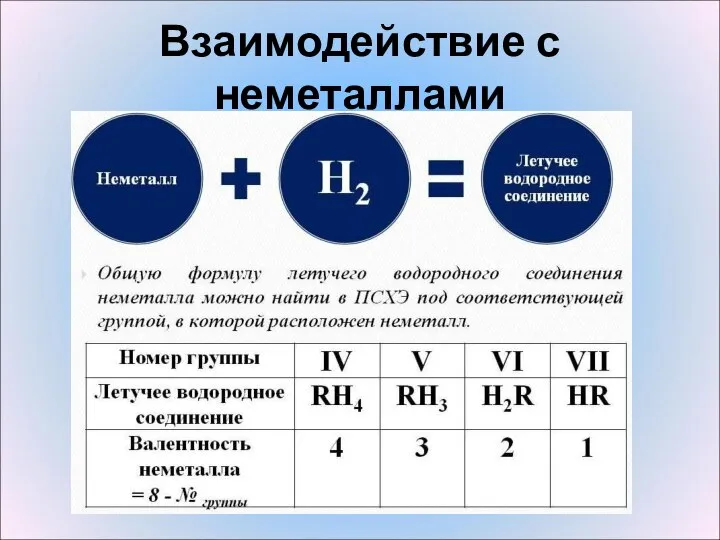
- 10. Взаимодействие с неметаллами
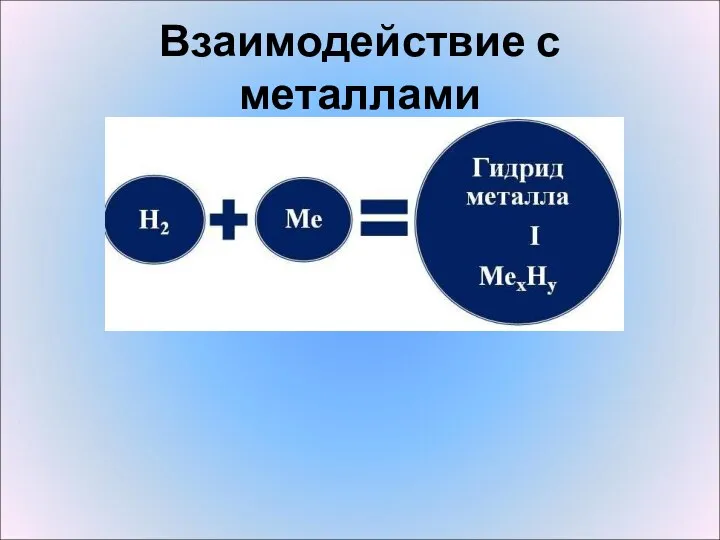
- 11. Взаимодействие с металлами
- 12. Химические свойства С галогенами H2 + F2 = 2HF H2 + Cl2 = 2HCl↑ 2. С
- 13. Получение водорода Взаимодействие кальция с водой: Гидролиз гидридов: Действие разбавленных кислот на металлы:
- 14. Получение в промышленности В технике водород чаще всего получают 1. Из природного газа: CH4 = C
- 15. Применение Синтез хлороводорода. Восстановление металлов. Топливо в двигателях. Синтез аммиака. (минеральные удобрения) Получение маргарина. Водородная сварка
- 17. Скачать презентацию










 Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения
Роль М.В. Ломоносова и Дж. Дальтона в создании атомно-молекулярного учения Характеристика высших гидроксидов по положению в ПСХЭ
Характеристика высших гидроксидов по положению в ПСХЭ Термохимические эффекты реакций
Термохимические эффекты реакций Катаболизм пуриновых нуклеотидов
Катаболизм пуриновых нуклеотидов Витамины и их роль в жизни людей
Витамины и их роль в жизни людей Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Амины
Амины Многоатомные спирты
Многоатомные спирты Агрегатные состояния веществ
Агрегатные состояния веществ Углеводороды. Характеристика
Углеводороды. Характеристика Алкены
Алкены Номенклатура алкенов. Теория
Номенклатура алкенов. Теория Энергетика хим процессов
Энергетика хим процессов Презентация на тему Интерактивная игра "Химический лабиринт"
Презентация на тему Интерактивная игра "Химический лабиринт"  Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Полимеры. Виды полимеров
Полимеры. Виды полимеров Природные источники углеводородов
Природные источники углеводородов Составление ионных уравнений
Составление ионных уравнений Оксид серы (VI) SO3
Оксид серы (VI) SO3 Презентация на тему Аминокислоты. История их открытия
Презентация на тему Аминокислоты. История их открытия  Применение алкенов
Применение алкенов Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов
Правила работы и хранения щелочных металлов. Утилизация остатков щелочных металлов Минеральные воды Старой Руссы
Минеральные воды Старой Руссы Что такое бинарные соединения?
Что такое бинарные соединения? Свине́ц (Plumbum;Pb)
Свине́ц (Plumbum;Pb) Задачи. Периодическая система. Строение атома. Повторение
Задачи. Периодическая система. Строение атома. Повторение Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела
Кристаллическое строение металлов и сплавов. Аморфные и кристаллические тела