на теории радикалов, он сформулировал понятие о минимальной структурной единице, входящей в состав всех белков. Эту единицу, которой приписывался состав 2C8H12N2 + 50, Г. Мульдер назвал протеином (Рг), а свою концепцию - теорией протеина.
Позднее состав протеина был уточнен - C40H62N10O12; дополнительно к протеинным единицам некоторые белки содержали серу и фосфор. Формула белков, предложенная Мульдером в 1838 г., выглядела так:
Г. Мульдер пользовался структурными формулами и для обозначения ряда физиологических процессов. В своем учебнике физиологической химии (1844) он рассматривал дыхание как окисление протеина, пищеварение - как перестройку белка с изменением содержания S, Р, Са и т. п.
Работы Г. Мульдера способствовали широкому распространению взглядов о единстве всех белков, их фундаментальном значении в мире живой природы.
Однако вскоре наступают трудные времена для теории протеина. В 1846 г. Н. Э. Лясковский, работавший в лаборатории Ю. Либиха, доказал неточность многих приведенных Г. Мульдером анализов. Свои сомнения в правильности теории публично высказал Ю. Либих. Г. Мульдер пытался корректировать формулу протеина , но в конце концов уступил под натиском новых фактов и открытий.
белок сыворотки крови 10Pr S2P







 Коррозия металлов
Коррозия металлов Органическая химия: пищевые добавки
Органическая химия: пищевые добавки Ионная связь
Ионная связь Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Химическая связь
Химическая связь 10_kl_klas-ya
10_kl_klas-ya Срспальфа-олефинсульфанаттар
Срспальфа-олефинсульфанаттар Презентация на тему Химическая связь
Презентация на тему Химическая связь  Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Электролиз. Применение электролиза
Электролиз. Применение электролиза Растительные источники жиров и жирных масел
Растительные источники жиров и жирных масел Periodická soustava prvků
Periodická soustava prvků Презентация на тему Кристаллические решетки 9 класс
Презентация на тему Кристаллические решетки 9 класс  Ароматические углеводороды. Галогенопроизводные
Ароматические углеводороды. Галогенопроизводные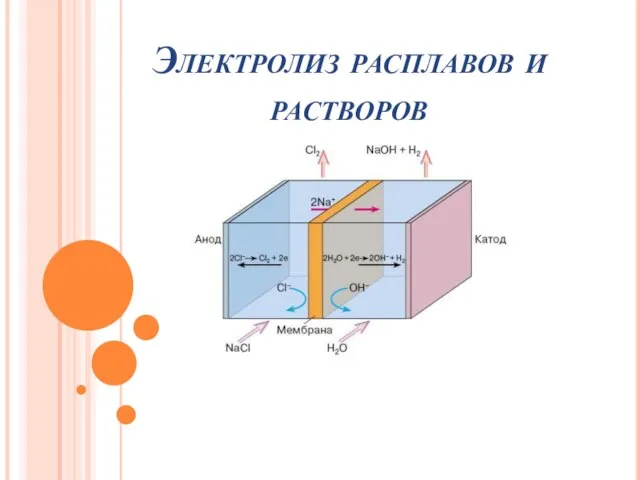 Электролиз расплавов растворов
Электролиз расплавов растворов Углеводы (сахара). Строение, свойства, участие в функционировании живых систем
Углеводы (сахара). Строение, свойства, участие в функционировании живых систем Реакция полимеризации
Реакция полимеризации Роль элементов 5 группы
Роль элементов 5 группы Вермикулитовый концентрат
Вермикулитовый концентрат Метод проектов: организация деятельности по химии
Метод проектов: организация деятельности по химии Творческий отчет кружка Юные химики
Творческий отчет кружка Юные химики Системно-деятельностный подход в обучении химии
Системно-деятельностный подход в обучении химии Aurul, caracteristici, stare
Aurul, caracteristici, stare Опасные химические вещества и их поражающее действие на организм человека
Опасные химические вещества и их поражающее действие на организм человека Современные способы защиты ОТТ
Современные способы защиты ОТТ Катализ в нефтепереработке
Катализ в нефтепереработке Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C Чистые вещества и смеси
Чистые вещества и смеси