Содержание
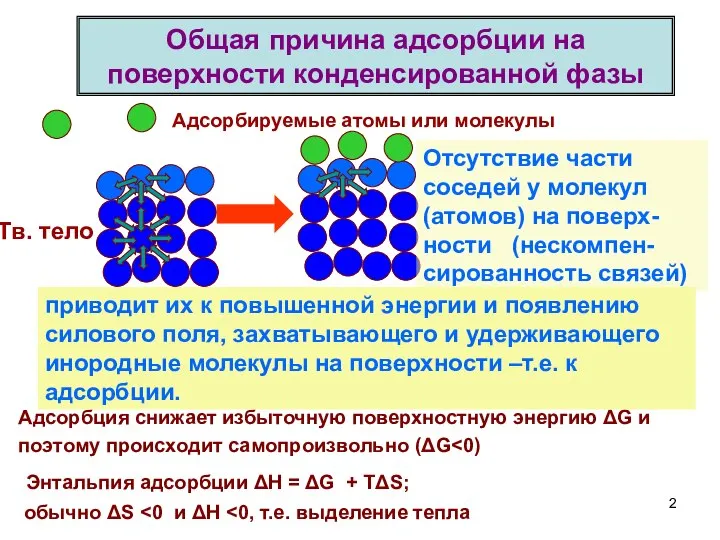
- 2. Общая причина адсорбции на поверхности конденсированной фазы Тв. тело
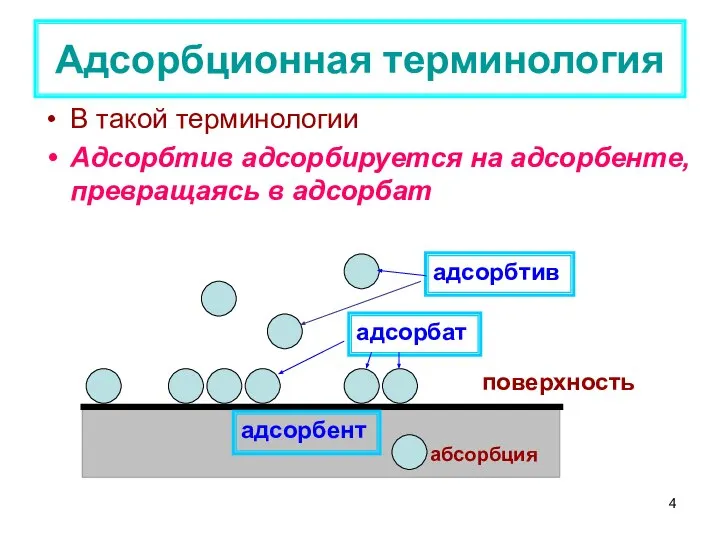
- 3. Адсорбционная терминология Адсорбция – самопроизвольное концентрирование компонентов из объема сопредельных фаз на межфазовой поверхности раздела (от
- 4. В такой терминологии Адсорбтив адсорбируется на адсорбенте, превращаясь в адсорбат Адсорбционная терминология адсорбтив адсорбат адсорбент абсорбция
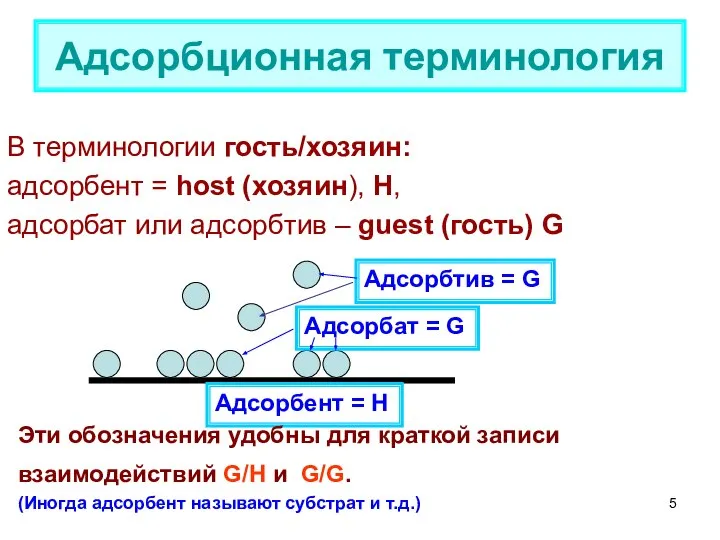
- 5. В терминологии гость/хозяин: адсорбент = host (хозяин), Н, адсорбат или адсорбтив – guest (гость) G Адсорбционная
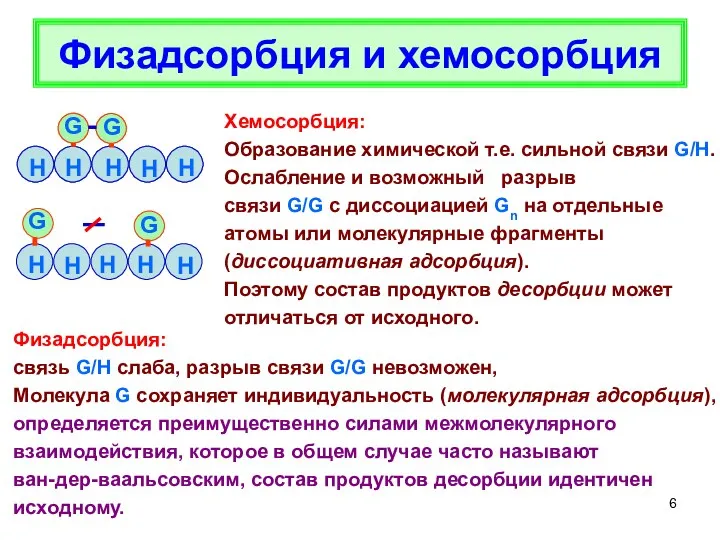
- 6. H Физадсорбция и хемосорбция Хемосорбция: Образование химической т.е. сильной связи G/H. Ослабление и возможный разрыв связи
- 7. Ван-дер-ваальсовские (физические) взаимодействия При моделировании их сводят к взаимодействию индуцированных и постоянных диполей с выделением 3
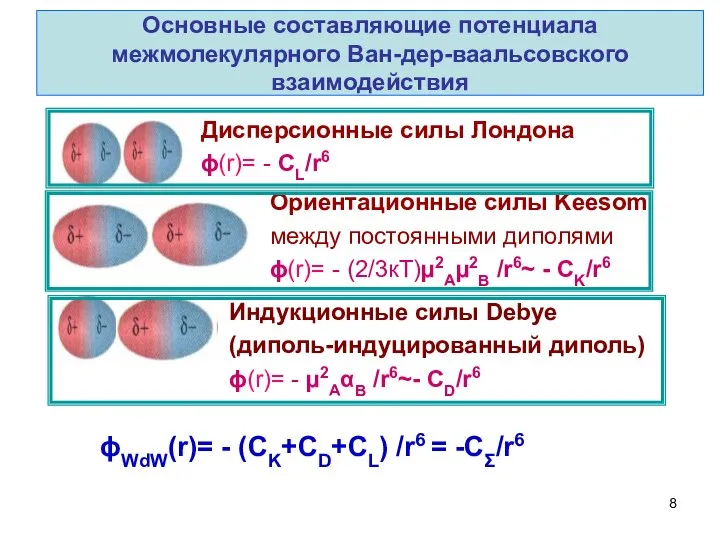
- 8. Основные составляющие потенциала межмолекулярного Ван-дер-ваальсовского взаимодействия
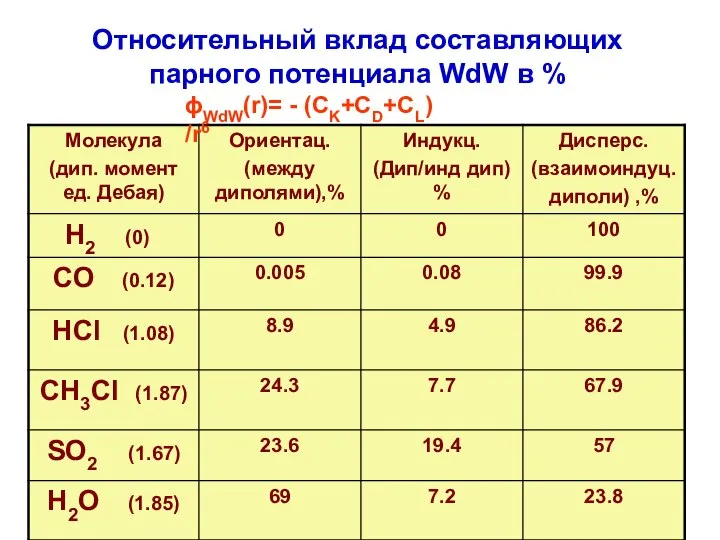
- 9. Относительный вклад составляющих парного потенциала WdW в % ϕWdW(r)= - (СK+СD+СL) /r6
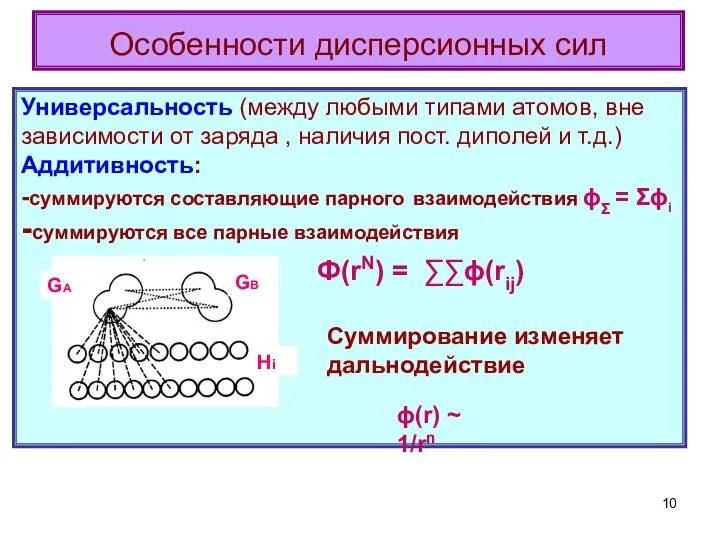
- 10. Особенности дисперсионных сил Универсальность (между любыми типами атомов, вне зависимости от заряда , наличия пост. диполей
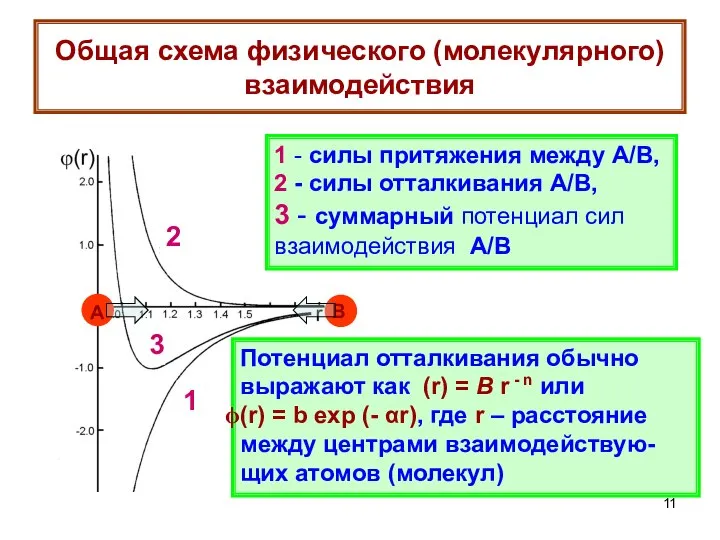
- 11. Общая схема физического (молекулярного) взаимодействия
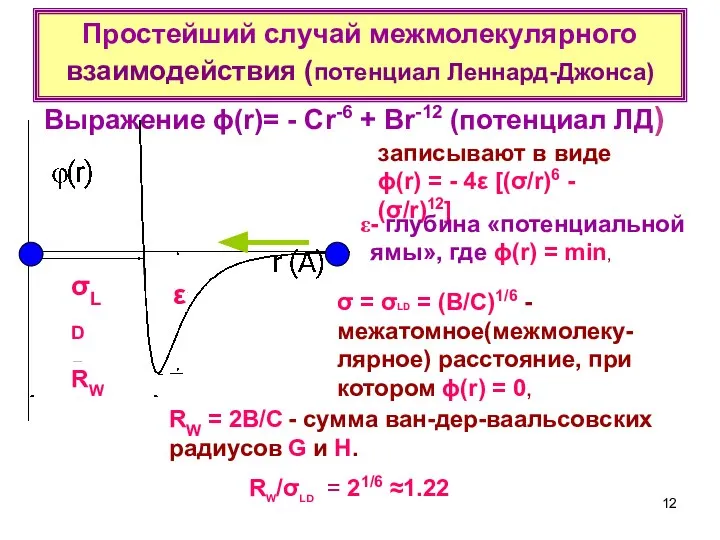
- 12. Простейший случай межмолекулярного взаимодействия (потенциал Леннард-Джонса) RW/σLD = 21/6 ≈1.22 записывают в виде ϕ(r) = -
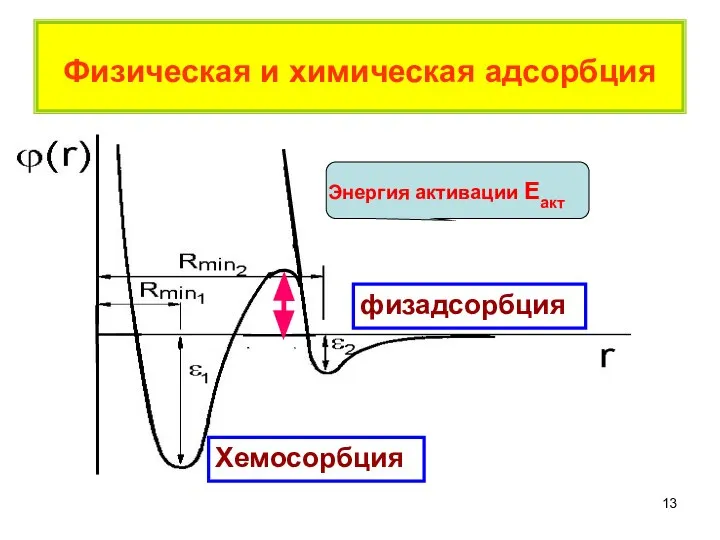
- 13. Физическая и химическая адсорбция Хемосорбция
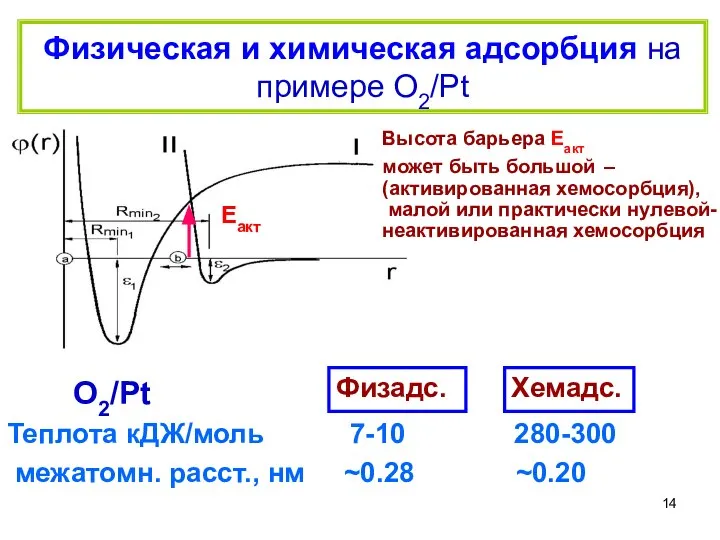
- 14. Физическая и химическая адсорбция на примере О2/Pt
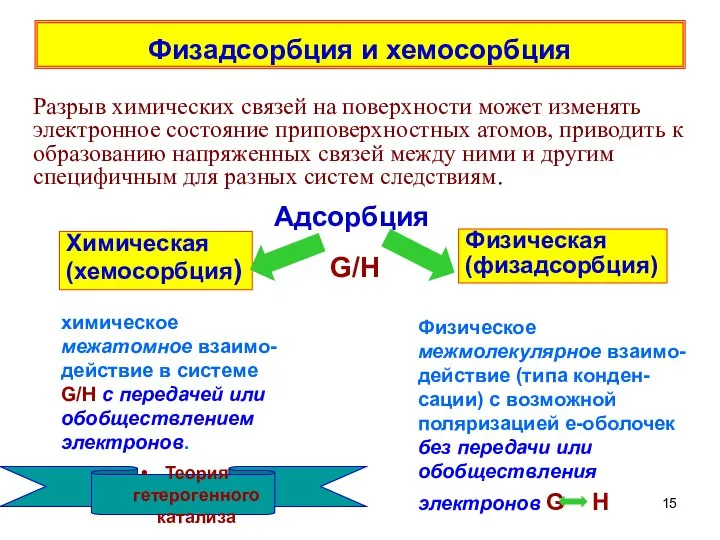
- 15. Физадсорбция и хемосорбция Разрыв химических связей на поверхности может изменять электронное состояние приповерхностных атомов, приводить к
- 16. Основные различия между типичной физической и химической адсорбцией Но существует много особых случаев….
- 17. Обычно хемосорбция при высоких, а физадсорбция - низких Т . Но постоянные газы (N2, О2 и
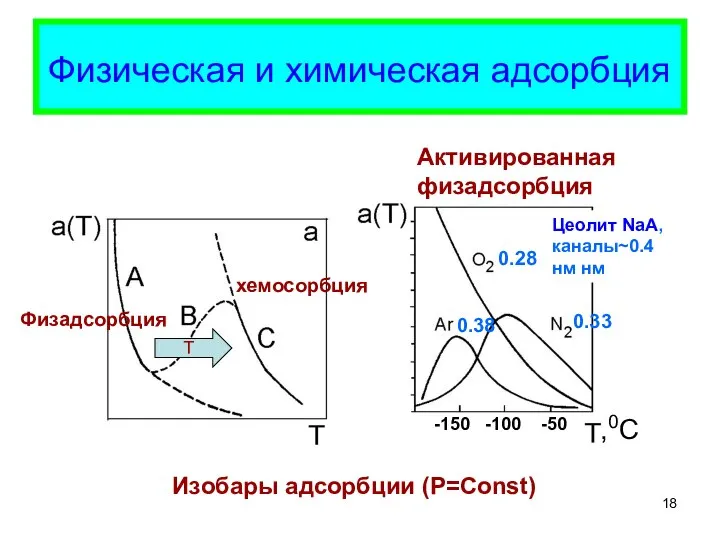
- 18. Физическая и химическая адсорбция
- 19. Дисперсность и избыточная свободная поверхностная энергия В первом приближении избыточная свободная энергия пропорциональна доле поверхностных атомов
- 20. Дисперсность Термин дисперсность – производный от лат. dispersus (рассеянный, рассыпанный), характеризует величину, обратную размеру частиц (чем
- 21. Простейший пример: дисперсность NA/Nv частицы в виде куба из N атомов с размером ребра Х=aN1/3
- 22. Дисперсность выпуклых тел анизотропной формы
- 23. Дисперсность Ультрадисперсные частицы 0.3 (кластеры) по свойствам находятся на границе между молекулярными системами и обычными объемными
- 24. Дисперсность Грубодисперсные частицы (> 100 нм): избыточные свойства сохраняются лишь непосредственно у поверхности, но могут еще
- 25. В нашем курсе основное внимание – на высокодисперсные системы с характерным размером частиц Х ≥ 2
- 26. В нашем курсе основное внимание – на высокодисперсные системы с характерным размером частиц Х ≥ 2
- 27. Высокодисперсные системы Х ≥ 2 нм, ψN Для таких систем переход от A/V = 6/X к
- 28. Эффективность использования промышленного катализатора определяется активностью единицы объема слоя катализатора в реакторе: Wv = ak A
- 29. Для модельного катализатора с тем же хим. и фазовым составом, но предельно оптимизированными текстурными характеристиками Wv,опт
- 31. Скачать презентацию















 Стронций(Sr)
Стронций(Sr) Скорость химических реакций
Скорость химических реакций Силикатная промышленность
Силикатная промышленность Почему химия важна в профессии ювелира?
Почему химия важна в профессии ювелира? Инертные газы
Инертные газы Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Химическая связь и строение молекул
Химическая связь и строение молекул Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"  Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка
Опыт тепло и холод. Поглощение тепла и кристаллическая ёлочка Презентация на тему Натуральные волокна
Презентация на тему Натуральные волокна  Лекция № 1
Лекция № 1 Углерод 9 класс Подготовила учитель химии СШ№16 Самойлова Регина Львовна
Углерод 9 класс Подготовила учитель химии СШ№16 Самойлова Регина Львовна Алкены. Решение задач и упражнений
Алкены. Решение задач и упражнений Минеральные вещества и здоровье
Минеральные вещества и здоровье Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества Открытие Менделеева Д. И
Открытие Менделеева Д. И Неорганические вещества в быту
Неорганические вещества в быту Основные понятия в химии
Основные понятия в химии Металловедение
Металловедение Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Смазывающие вещества
Смазывающие вещества Классификация реакций в органической химии
Классификация реакций в органической химии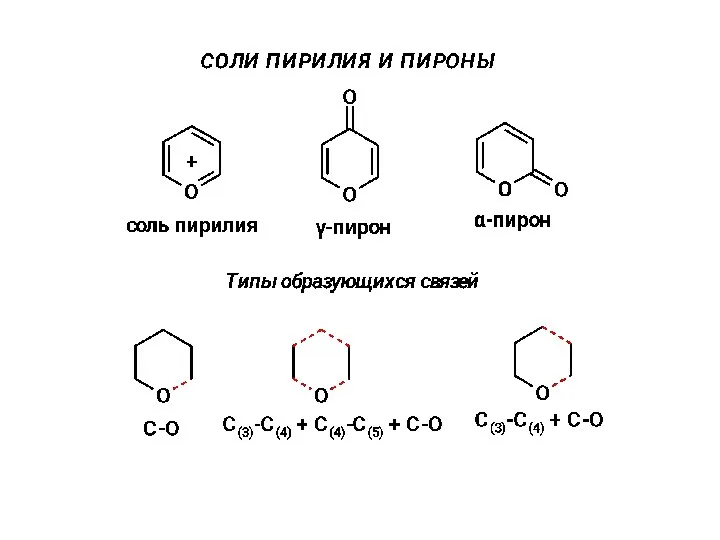 Соли пирилия и пироны
Соли пирилия и пироны Химические уравнения
Химические уравнения Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Алмаз. Свойства алмазов
Алмаз. Свойства алмазов Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Презентация на тему Многообразие карбоновых кислот
Презентация на тему Многообразие карбоновых кислот