Содержание
- 2. Что читать? Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Ахметов Н. С. Общая
- 3. Закон Ломоносова-Клапейрона Уравнение состояния идеального газа: PV = nRT где n – число молей газа; P
- 4. Система СИ Уравнение состояния идеального газа: PV = nRT где n – число молей газа; P
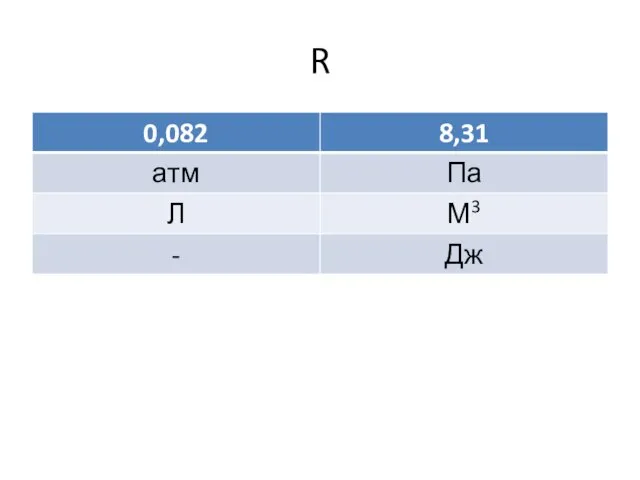
- 5. R
- 6. 1 моль газа занимает объем 22,4 литра при 1 атмосфере и 0 OС (273,15 К) (н.у)
- 7. Различные толкования ст. у. Ст. у. в современной химической термодинамике не привязаны к температуре, и соответствуют
- 8. В наших учебниках и задачках Стандартные условия (ст. у.) – температура 25 °С (298,15 К, сотые
- 9. Энтропия S Мера хаоса (не совсем верно/понятно) Мера возможностей системы
- 11. S, S°, ΔS.
- 13. Скачать презентацию









 Предельные углеводороды насыщенные, парафины, алканы
Предельные углеводороды насыщенные, парафины, алканы Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Алюминий и его соединения
Алюминий и его соединения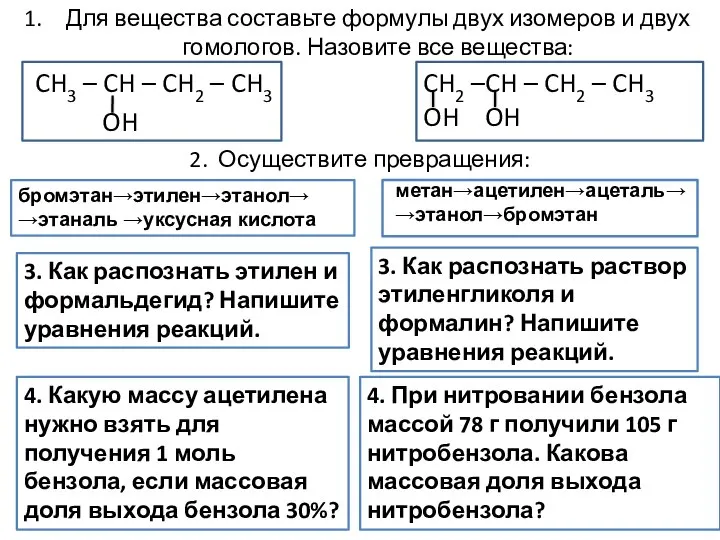 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Нанотехнологии в быту
Нанотехнологии в быту Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Биохимия крови
Биохимия крови Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Лекция № 1
Лекция № 1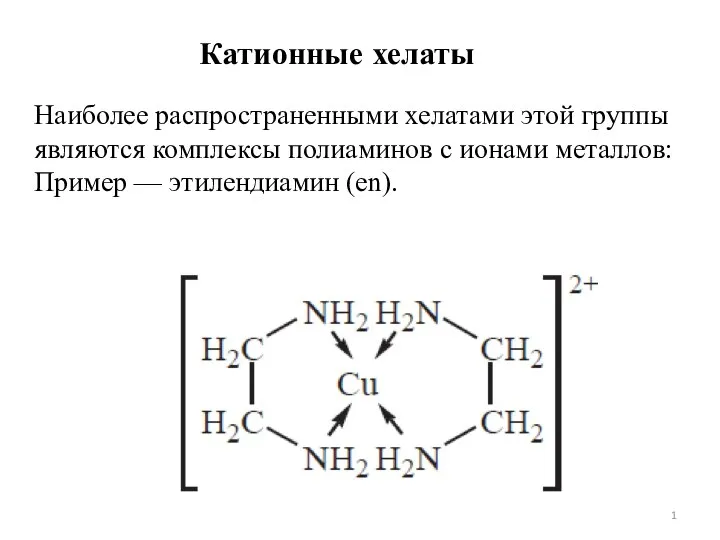 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Классификация углеводородов
Классификация углеводородов Массовые доли веществ задачи
Массовые доли веществ задачи Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Спирты. Общая формула, номенклатура
Спирты. Общая формула, номенклатура Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Вещество. Свойства веществ
Вещество. Свойства веществ Минералы
Минералы Относительная атомная масса
Относительная атомная масса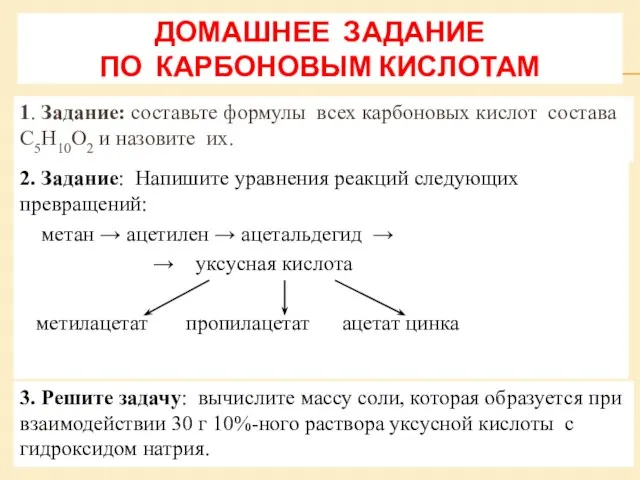 Карбоновые кислоты
Карбоновые кислоты