Содержание
- 2. Во внешнем электронном слое атомы галогенов содержат семь электронов – два на s- и пять на
- 3. Галогены, вследствии их большой химической активности, находятся в природе исключительно в связанном состоянии – главным образом
- 4. Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия и магния. Бромиды металлов
- 5. Иод встречается также в виде солей калия – иодата KIO3 и периодата KIO4, сопутствующих залежам нитрата
- 6. Галогены сравнительно мало растворимы в воде. Один объём воды растворяет при комнатной температуре около 2,5 объёмов
- 7. Свободные галогены проявляют чрезвычайную химическую активность. Они вступают во взаимодействие почти со всеми простыми веществами. Особенно
- 9. Скачать презентацию
Слайд 2Во внешнем электронном слое атомы галогенов содержат семь электронов – два на
Во внешнем электронном слое атомы галогенов содержат семь электронов – два на

Входящие в главную подгруппу VII группы, элементы фтор (F), хлор (Cl), бром (Br), иод (I) и астат (At) называются галогенами. Это название, которое буквально означает “солерождающие”, элементы получили за способность взаимодействовать с металлами с образованием типичных солей, например хлорида натрия NaCl.
Слайд 3Галогены, вследствии их большой химической активности, находятся в природе исключительно в связанном
Галогены, вследствии их большой химической активности, находятся в природе исключительно в связанном

Галогены в природе.
Важнейшим природным соединением хлора является хлорид натрия (поваренная соль) NaCl, который служит основным сырьём для получения других соединений хлора. Главная масса хлорида натрия находится в водах морей, океанов и некоторых озёр. Также он встречается в виде каменной соли.
Слайд 4Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия
Подобно хлору бром находится в природе преимущественно в виде солей калия, натрия
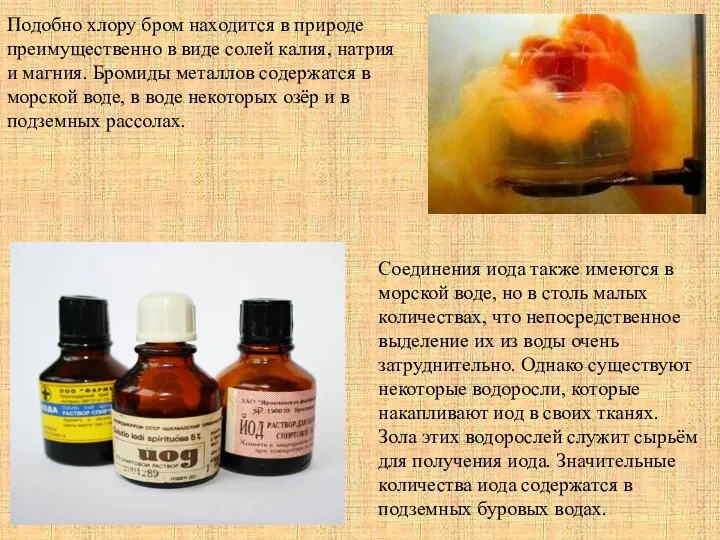
Соединения иода также имеются в морской воде, но в столь малых количествах, что непосредственное выделение их из воды очень затруднительно. Однако существуют некоторые водоросли, которые накапливают иод в своих тканях. Зола этих водорослей служит сырьём для получения иода. Значительные количества иода содержатся в подземных буровых водах.
Слайд 5Иод встречается также в виде солей калия – иодата KIO3 и периодата
Иод встречается также в виде солей калия – иодата KIO3 и периодата
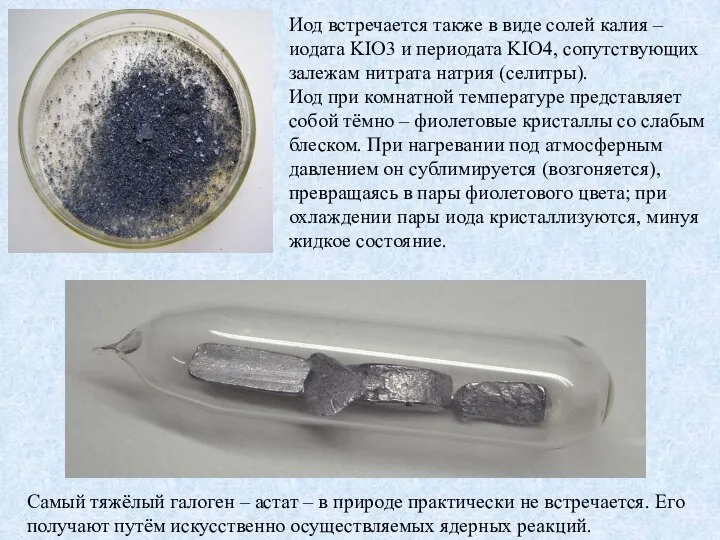
Самый тяжёлый галоген – астат – в природе практически не встречается. Его получают путём искусственно осуществляемых ядерных реакций.
Слайд 6Галогены сравнительно мало растворимы в воде. Один объём воды растворяет при комнатной
Галогены сравнительно мало растворимы в воде. Один объём воды растворяет при комнатной

Химические свойства
Значительно лучше, чем в воде , бром и иод растворяются в органических растворителях : сероуглероде, этиловом спирте, диэтиловом эфире, хлороформе и бензоле. Этим пользуются для извлечения брома и иода из водных растворов.
Слайд 7Свободные галогены проявляют чрезвычайную химическую активность. Они вступают во взаимодействие почти со
Свободные галогены проявляют чрезвычайную химическую активность. Они вступают во взаимодействие почти со

Медь, железо, олово и многие другие металлы сгорают в хлоре, образуя соответствующие соли. Подобным же образом взаимодействуют с металлами бром и иод. Во всех этих случаях атомы металлов отдают электроны (окисляются) а атомы галогенов присоединяют эти электроны (восстанавливаются).
 Классификация загрязняющих веществ по фазово-дисперсному составу
Классификация загрязняющих веществ по фазово-дисперсному составу Презентация на тему Оксиды углерода
Презентация на тему Оксиды углерода  Азот
Азот Отжиг сталей (отжиг 2-го рода) Лекция 2
Отжиг сталей (отжиг 2-го рода) Лекция 2 Кислород O2
Кислород O2 Атом. Ядро и электронная оболочка
Атом. Ядро и электронная оболочка Технология получения красного фосфора
Технология получения красного фосфора Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Современная аналитическая химия.Учебная литература
Современная аналитическая химия.Учебная литература Оксиды, получение и свойства
Оксиды, получение и свойства Комментарии к выполненным заданиям по темам Алканы и Алкены. 9 класс
Комментарии к выполненным заданиям по темам Алканы и Алкены. 9 класс Карбоновые кислоты
Карбоновые кислоты Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Учение о химических процессах. Лекция 3
Учение о химических процессах. Лекция 3 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение
Германий, его характеристика, способы получения органопроизводных, химические свойства. Практическое применение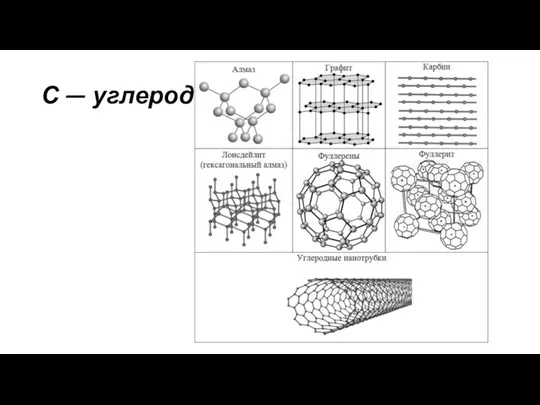 С - углерод. Применение
С - углерод. Применение Применение одноатомных и многоатомных спиртов
Применение одноатомных и многоатомных спиртов Номенклатура и изомерия карбоновых кислот
Номенклатура и изомерия карбоновых кислот Качественные реакции в химии
Качественные реакции в химии Без золота прожить можно, без соли нельзя
Без золота прожить можно, без соли нельзя Циклоалканы. Строение, изомерия, получение и свойства
Циклоалканы. Строение, изомерия, получение и свойства Коррозионные диаграммы
Коррозионные диаграммы Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Поликонденсация. Гомополиконденсациия
Поликонденсация. Гомополиконденсациия Карбоновые кислоты
Карбоновые кислоты