Содержание
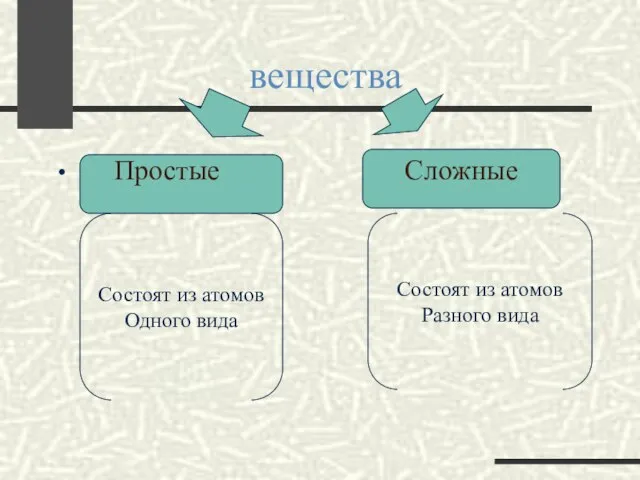
- 2. вещества Простые Сложные Состоят из атомов Одного вида Состоят из атомов Разного вида
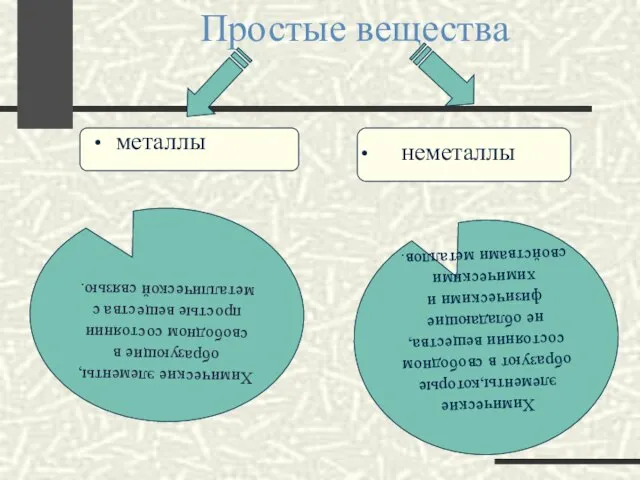
- 3. Простые вещества металлы неметаллы Химические элементы, образующие в свободном состоянии простые вещества с металлической связью. Химические
- 4. Древние века и средние века – 7 металлов (Au, Ag, Cu,Pb, Fe, Hg) М.В. Ломоносов -
- 5. Нахождение металлов в природе В виде соединений В самородном состоянии (Au, Pt, Ag) В виде солей
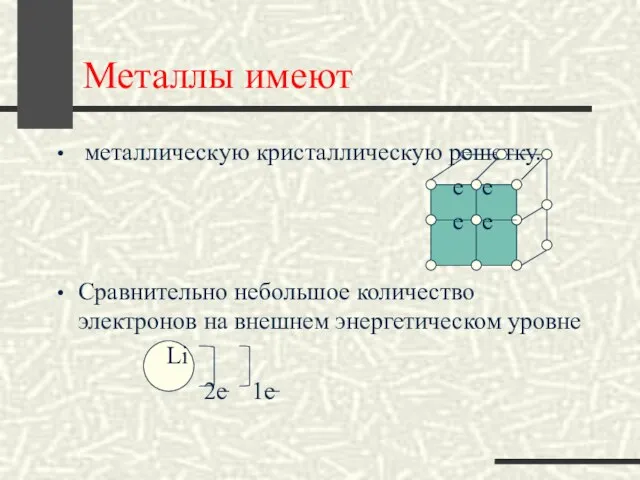
- 6. Металлы имеют металлическую кристаллическую решетку. е е е е Сравнительно небольшое количество электронов на внешнем энергетическом
- 7. Имеют свободные валентные электроны Металлическая связь не обладает направленностью и насыщенностью. Подвижные электроны компенсируют электрическое отталкивание
- 8. Физические свойства металлов Твердые вещества, кроме ртути. (самый мягкий – калий, самый твердый – хром)
- 9. Пластичные Au, Ag, Cu, Sn, Pb,Zn, Fe уменьшается
- 10. Теплопроводность Hg, Cu, Ag, Al, Fe уменьшается Электропроводность Ag Mn уменьшается
- 11. Температура плавления Легкоплавкие тугоплавкие Hg, Ga, Cs, In, Bi W, Mo, V, Cr
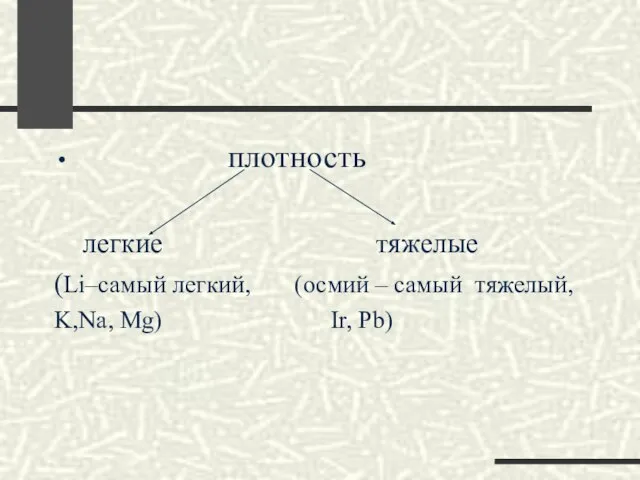
- 12. плотность легкие тяжелые (Li–самый легкий, (осмий – самый тяжелый, K,Na, Mg) Ir, Pb)
- 13. Обладают металлическим блеском
- 14. Причины, приводящие к различию в физических свойств металлов Атомы металлов образуют разные типы кристаллических решеток
- 15. Причины, приводящие к различию физических свойств Атомы металлов имеют разное число валентных электронов, участвующих в образовании
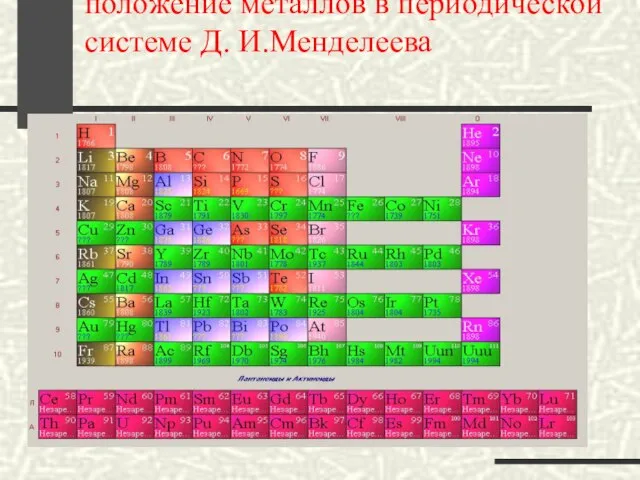
- 16. положение металлов в периодической системе Д. И.Менделеева
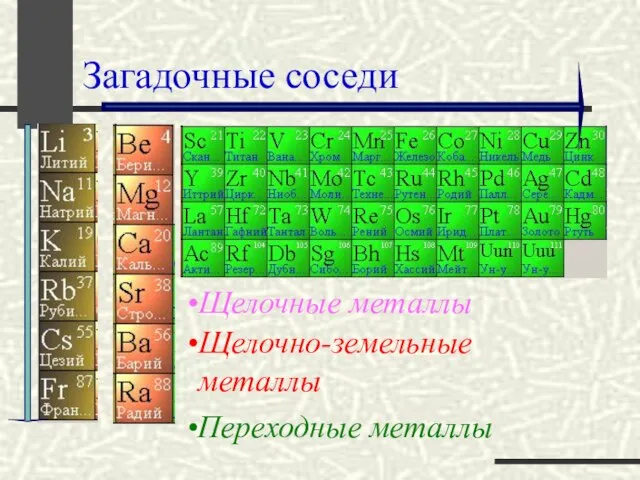
- 17. Загадочные соседи Щелочно-земельные металлы Переходные металлы Щелочные металлы
- 18. Химические свойства металлов Металлы в химических реакциях являются восстановителями, при этом они окисляются Mo – ne
- 19. Металлы вытесняются из их соединений другими металлами Н.Н. Бекетов – создал «вытеснительный ряд» (прототип электрохимического ряда
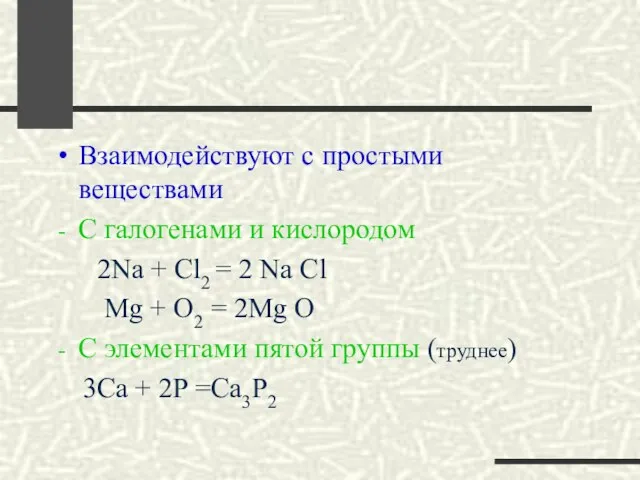
- 20. Взаимодействуют с простыми веществами С галогенами и кислородом 2Na + Cl2 = 2 Na Cl Mg
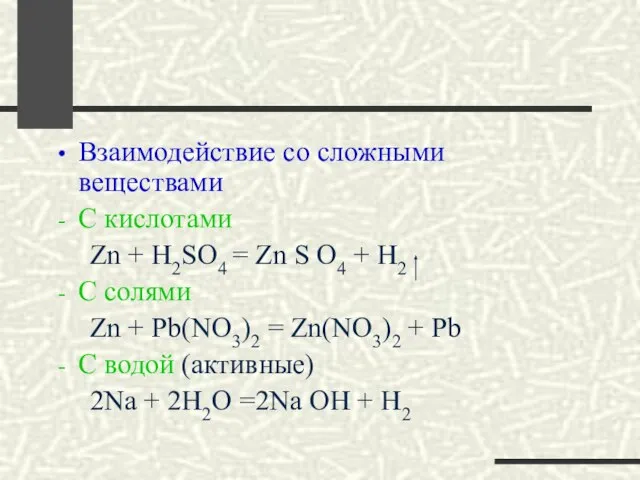
- 21. Взаимодействие со сложными веществами С кислотами Zn + H2SO4 = Zn S O4 + H2 C
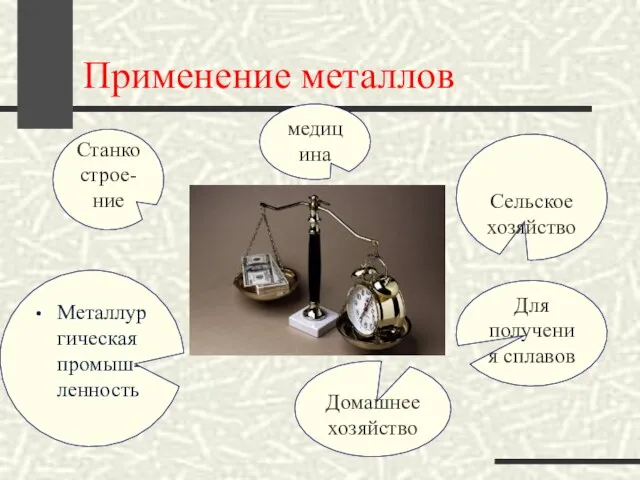
- 22. Применение металлов Металлургическая промыш-ленность Станкострое-ние медицина Сельское хозяйство Для получения сплавов Домашнее хозяйство
- 24. Скачать презентацию












 Диены. Понятие о диенах
Диены. Понятие о диенах Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы
Реакцияға қабілетті олигомерлердің мономерлерге қарағанда артықшылығы Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки
Химия. Соотечественники, внёсшие большой вклад в становление и развитие этой науки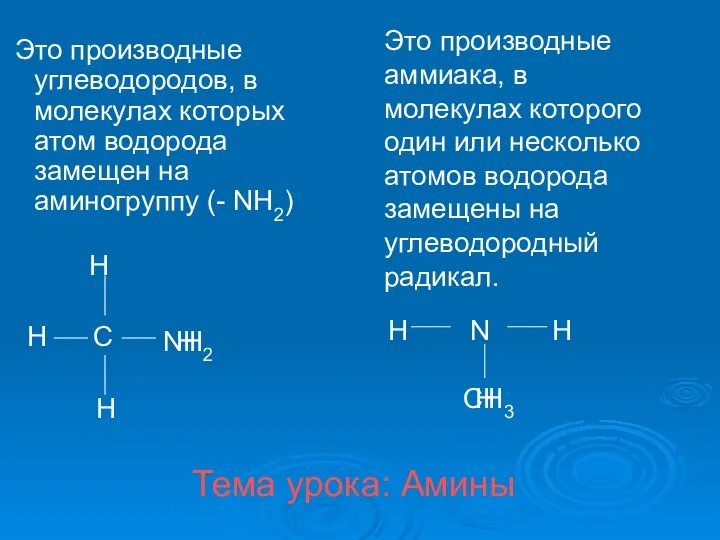 Амины. Классификация аминов
Амины. Классификация аминов In aqua veritas. Правда в воде. Задача 12
In aqua veritas. Правда в воде. Задача 12 Кремний
Кремний Фармацевтическая химия субстанций. Лекция 5
Фармацевтическая химия субстанций. Лекция 5 Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов
Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Классификация химических реакций
Классификация химических реакций Презентация на тему Углекислый газ
Презентация на тему Углекислый газ  Презентация на тему Массовая доля вещества в растворе
Презентация на тему Массовая доля вещества в растворе  Основания. Структурная формула
Основания. Структурная формула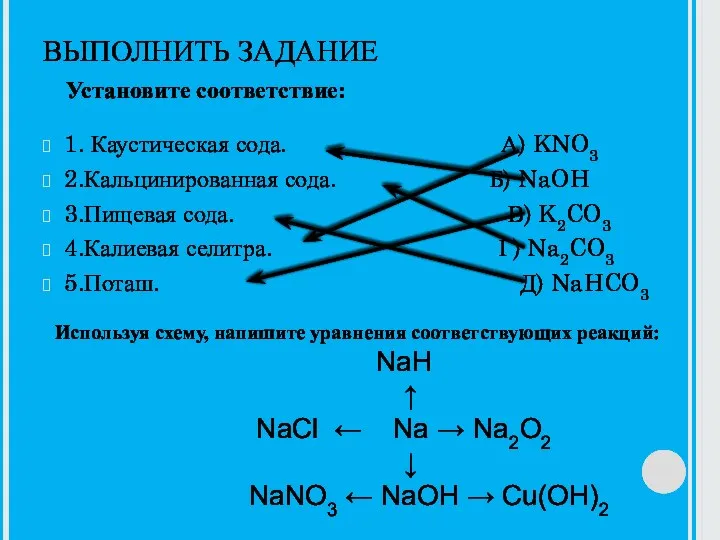 Каустическая сода
Каустическая сода Предельные одноатомные спирты
Предельные одноатомные спирты Внеклассное мероприятие по химии. Своя игра
Внеклассное мероприятие по химии. Своя игра Строение атома
Строение атома Цинк (Zn). Свойства
Цинк (Zn). Свойства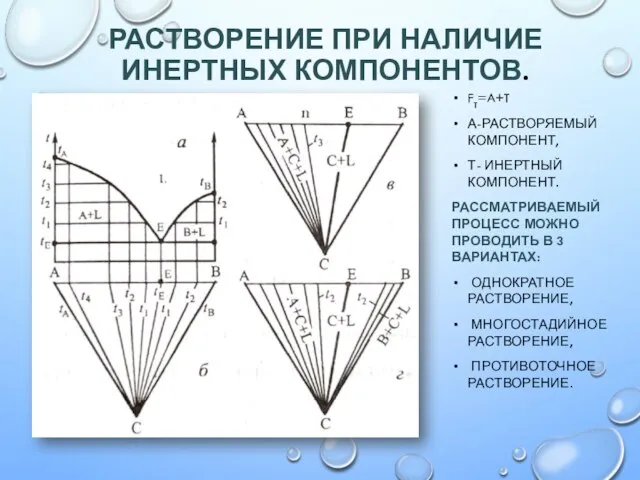 Растворение при наличии инертных компонентов
Растворение при наличии инертных компонентов Сплавы металлов
Сплавы металлов Периодическая система элементов, строение атома
Периодическая система элементов, строение атома Металлы и неметаллы
Металлы и неметаллы Пластмассы. Классификация
Пластмассы. Классификация Строение веществ
Строение веществ Алкены
Алкены Предмет органической химии. Урок №1
Предмет органической химии. Урок №1 Химический диктант как метод формирующего оценивания
Химический диктант как метод формирующего оценивания