Слайд 2ОПРЕДЕЛИТЬ ВАЛЕНТНОСТЬ АТОМОВ
SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl,
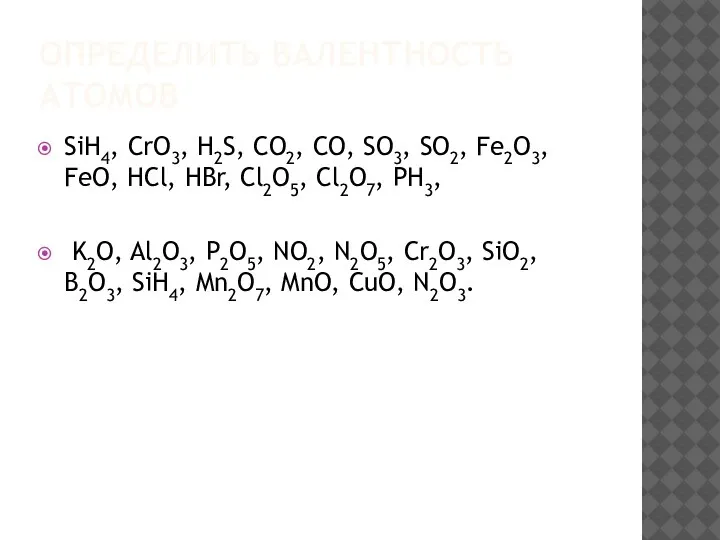
HBr, Cl2O5, Cl2O7, РН3,
K2O, Al2O3, P2O5, NO2, N2O5, Cr2O3, SiO2, B2O3, SiH4, Mn2O7, MnO, CuO, N2O3.
Слайд 3Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; азот – 16,47

%; кислород – 57,47%. Ответ: NaNO3
Слайд 4ВСПОМНИМ:
Что такое химические и физические явления? Чем они отличаются?
Пересчитайте внешние эффекты химических

реакций.
Какие признаки химических реакций наблюдаются: а) во время горения костра; б) во время ржавления железа; в) во время скисания пищи?
Приведите примеры физических явлений, при которых изменяется агрегатное состояние веществ.
Приведите примеры химических явлений, которые сопровождаются изменением агрегатного состояния веществ.
Приведите примеры химических реакций, которые вы наблюдали в природе или быту.
Слайд 6ПОДУМАЙТЕ!
Остается ли неизменной масса веществ во время химических реакций?
А останется ли неизменным

количество атомов?
Как можно проверить ваши гипотезы? Что необходимо сделать, что этого?
Слайд 7ОТКРЫТИЕ ЗАКОНА СОХРАНЕНИЯ МАССЫ
1789г.
Роберт Бойль
1673г.
1756г.
М. В. Ломоносов
Антуан Лавуазье

Слайд 8ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВА
1 Закон сохранения
2Прокаливание меди
3Великий сын –
великого народа

Слайд 9СОВРЕМЕННАЯ ФОРМУЛИРОВКА ЗАКОНА СОХРАНЕНИЯ МАССЫ ТАКАЯ:
масса веществ, которые вступили в химическую реакцию,

равняется массе веществ, которые
образовались в результате реакции.
Слайд 10Демонстрационный эксперимент
Компетентность: разрешение проблем
Аспект: определение проблем, планирование деятельности, действия по решению проблемы.
В

течение тысячелетий люди верили в то, что вещество может бесследно исчезать, а также возникать из ничего. Это чисто житейское утверждение вам предстоит доказать или опровергнуть.
Чтобы ответить на вопрос, выполните задание, следуя инструкции.
Инструкция:
Возьмите стаканчик с раствором хлорида меди (II) и стаканчик с раствором гидроксида натрия, составьте их на весы и запишите вес на доске, после этого слейте растворы и снова всё взвесьте. Что наблюдаете?
Слайд 12ЗАДАНИЯ:
Объясните, почему во время горения свечки ее масса постепенно уменьшается. Не противоречит

ли это закону сохранения массы?
C17H36 + 26O2 = 17CO2 + 18H2O
Определите массу натрий хлорида, который образовывается при взаимодействии натрия массой 10 г с хлором массой 14 г.
2Na + Cl2 = 2NaCl
Вследствие взаимодействия 8 г метана с 32 г кислорода образовалось 22 г углекислого газа и вода. Вычислите, какая масса воды выделилась в результате этой реакции.
CH4 + 2O2 = CO2 + 2H2O
В результате взаимодействия 16 г серы S с железом Fe образовалось 44 г ферум(II) сульфида. Вычислите масcу использованного железа.
Fe + S = FeS











 Степени окисления и формулы веществ
Степени окисления и формулы веществ Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Природные источники углеводородов
Природные источники углеводородов Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Пероксид водорода
Пероксид водорода Элементарный, химический и фракционный состав нефти, газа и конденсата
Элементарный, химический и фракционный состав нефти, газа и конденсата Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия
Анализ спорных ситуаций при оценивании заданий с развернутым ответом. Химия Электроотрицательность (ЭО)
Электроотрицательность (ЭО) Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Презентация на тему Задачи на смеси и сплавы (9 класс)
Презентация на тему Задачи на смеси и сплавы (9 класс)  Презентация на тему Чистые вещества и смеси. Химический диктант
Презентация на тему Чистые вещества и смеси. Химический диктант  Гидролиз солей
Гидролиз солей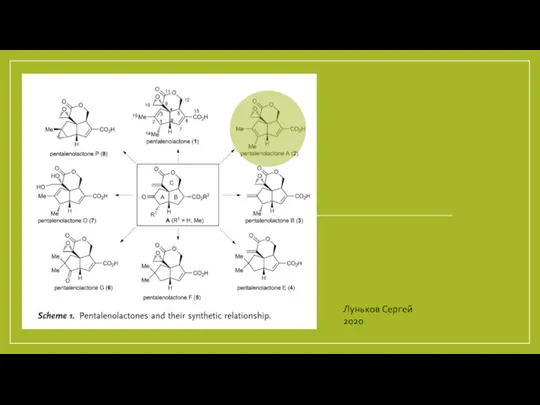 Полный синтез метилового эфира - пенталенолактона
Полный синтез метилового эфира - пенталенолактона Основы химической кинетики
Основы химической кинетики Признаки химических реакций
Признаки химических реакций Перициклические реакции
Перициклические реакции Витамины и коферменты
Витамины и коферменты Химическое вещество золото
Химическое вещество золото Интенсив. 35 номер
Интенсив. 35 номер Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Решение задач и упражнений по теме Алканы
Решение задач и упражнений по теме Алканы Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов
Роль радикальных процессов. Свободные формы кислорода. Пероксидное окисление липидов Амины. Номенклатура аминов
Амины. Номенклатура аминов Металлическая химическая связь
Металлическая химическая связь Презентация на тему Состав, строение и свойства стекла и хрусталя
Презентация на тему Состав, строение и свойства стекла и хрусталя  Определение времени прохождения диффузии
Определение времени прохождения диффузии Презентация на тему Галерея русских химиков
Презентация на тему Галерея русских химиков  prezentatsia_lektsia_1_LF_Rastvory_Kolligativnye_svoi_774_stva_rastvorov_Osmos
prezentatsia_lektsia_1_LF_Rastvory_Kolligativnye_svoi_774_stva_rastvorov_Osmos