Содержание
- 2. Йод (лат. Iodum) – химический элемент 7 группы ПС Д.И. Менделеева, галоген, порядковый номер 53, Относительная
- 3. Открытие и нахождение в природе В 1811 г. французский химик Б.Куртуа в золе морских водорослей открыл
- 4. Получение Йод получают при обработке йодата гидросульфитом натрия, из йодосодержащей золы морских растений. В лабаратории- нагреванием
- 5. Физические свойства В обычных условиях йод – кристаллы фиолетово-черного цвета с металлическим блеском. При нормальном давлении
- 6. Химические свойства 1. Со щелочами йод образует соли йодноватистой (HIO) и йодноватой (HIO3) кислот. 2. Йод
- 7. 5. Для получения HI из йодидов металлов можно использовать концентрированную фосфорную кислоту. Йодоводород (HI) ещё более
- 8. Применение Йод используется в производстве лекарств, в химическом анализе. Соединения йода широко применяются в производстве фотоматериалов,
- 9. Найти массу йода, который потребуется для полного взаимодействия с 22,67 г сероводорода, содержащего 10% примесей. mтехн.(H2S)
- 11. Скачать презентацию








 Приходченко ФЕР-2031
Приходченко ФЕР-2031 Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК Вода. Интеллектуальная игра
Вода. Интеллектуальная игра Сложные эфиры. Жиры
Сложные эфиры. Жиры Кислоты. Химический диктант. 8 класс
Кислоты. Химический диктант. 8 класс Vielu īpašības
Vielu īpašības Структуры железоуглеродистых сплавов в равновесном состоянии
Структуры железоуглеродистых сплавов в равновесном состоянии Классификация органических соединений
Классификация органических соединений Химико-металлургические методы
Химико-металлургические методы «СберСтарЭнерго» «ЖИДКАЯ РЕЗИНА»
«СберСтарЭнерго» «ЖИДКАЯ РЕЗИНА» Химическая кинетика и равновесие
Химическая кинетика и равновесие Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Валентность. Порядок действий при составлении химической формулы
Валентность. Порядок действий при составлении химической формулы Органические галогениды. (Лекция 7)
Органические галогениды. (Лекция 7) Водородный показатель Ph растворов
Водородный показатель Ph растворов Периодический закон. Периодическая таблица химических элементов. 8 класс
Периодический закон. Периодическая таблица химических элементов. 8 класс Основные классы неорганических соединений
Основные классы неорганических соединений Ионные уравнения
Ионные уравнения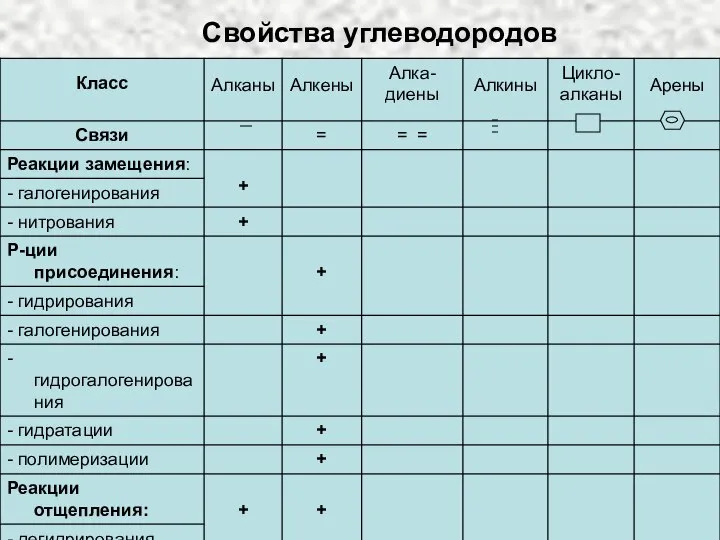 Свойства углеводородов
Свойства углеводородов Висмут
Висмут Применение эфиров в производстве автомобильных бензинов
Применение эфиров в производстве автомобильных бензинов Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Алкины
Алкины Алканы. Строение,номенклатура, изомерия
Алканы. Строение,номенклатура, изомерия Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21 Амины. Аминокислоты
Амины. Аминокислоты Витамины. Классификация витаминов
Витамины. Классификация витаминов Жиры. Определение и общая формула
Жиры. Определение и общая формула