Содержание
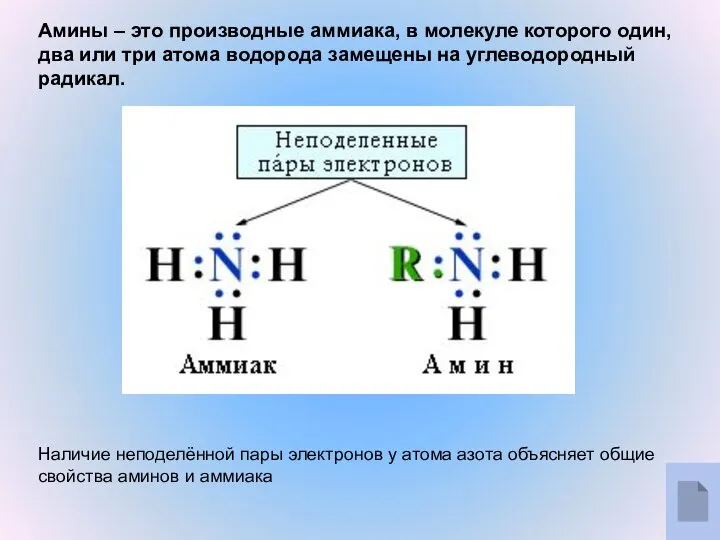
- 2. Амины – это производные аммиака, в молекуле которого один, два или три атома водорода замещены на
- 3. Химические свойства аминов: Основные свойства: CH3-NH2 + HCl (CH3-NH3)Cl метиламин хлорид метиламмония CH3-NH2 + H2O (CH3-NH3)OH
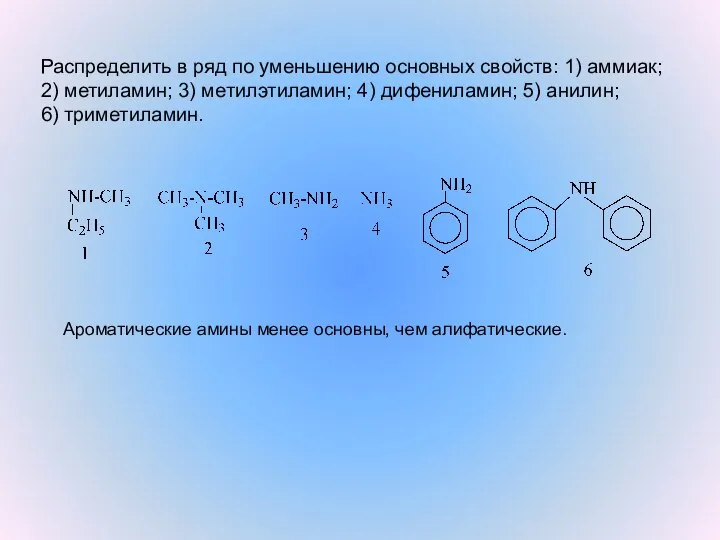
- 4. Распределить в ряд по уменьшению основных свойств: 1) аммиак; 2) метиламин; 3) метилэтиламин; 4) дифениламин; 5)
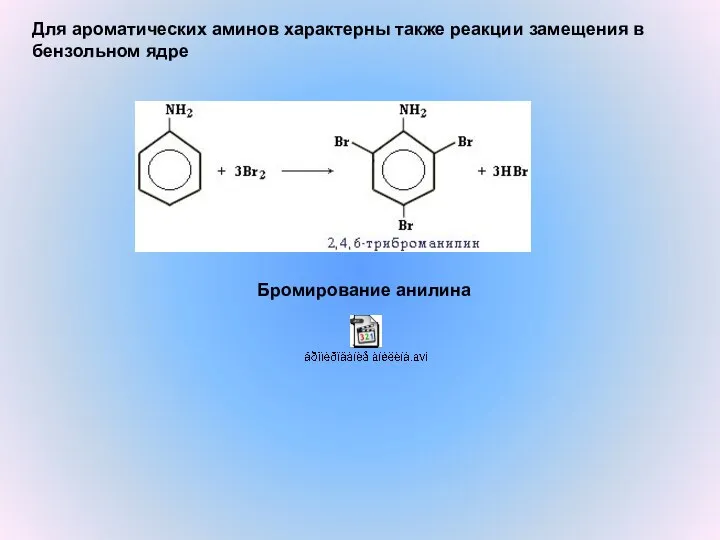
- 5. Бромирование анилина Для ароматических аминов характерны также реакции замещения в бензольном ядре
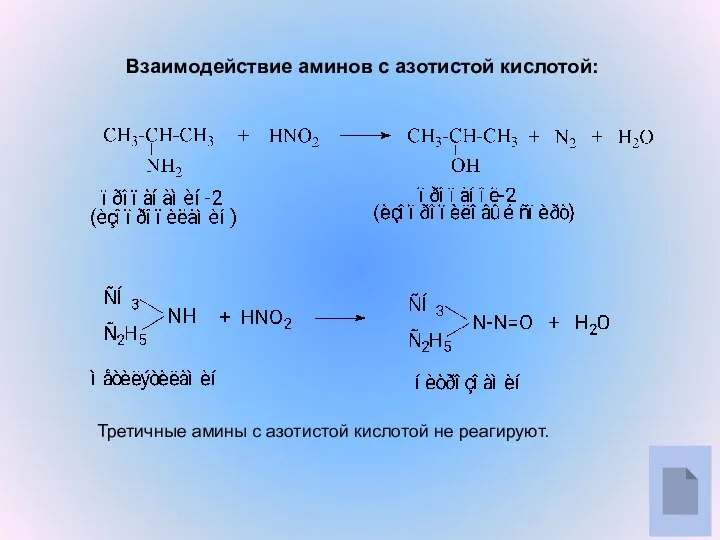
- 6. Взаимодействие аминов с азотистой кислотой: Третичные амины с азотистой кислотой не реагируют.
- 7. Этим способом получают из первичных аминов вторичные и третичные, а из вторичных – третичные. NaOH CH3NH2
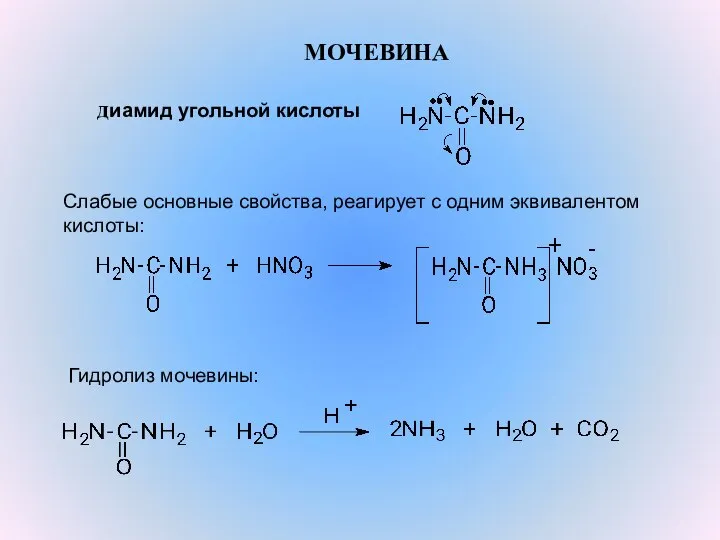
- 8. МОЧЕВИНА диамид угольной кислоты Слабые основные свойства, реагирует с одним эквивалентом кислоты: Гидролиз мочевины:
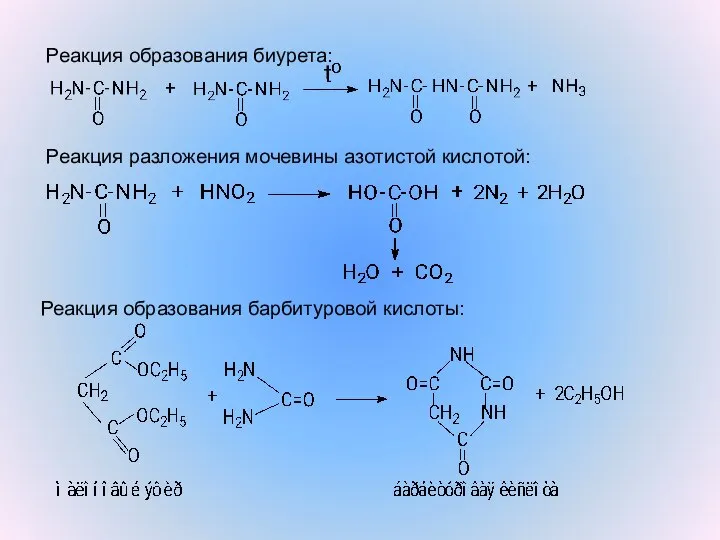
- 9. Реакция образования биурета: Реакция разложения мочевины азотистой кислотой: Реакция образования барбитуровой кислоты:
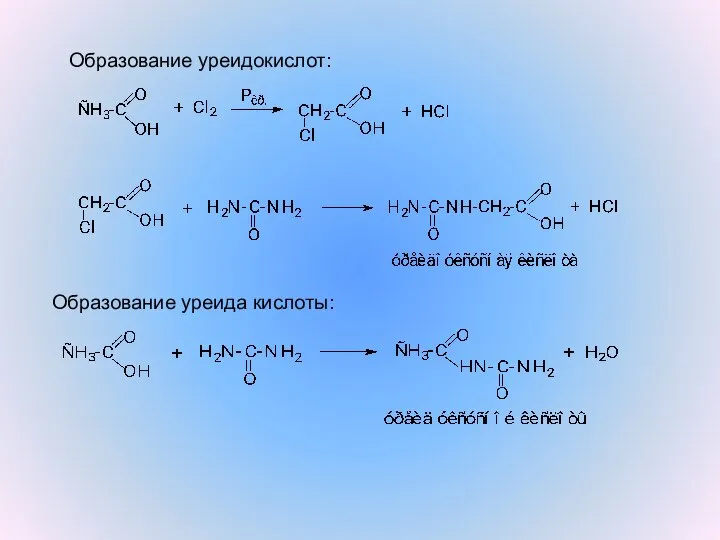
- 10. Образование уреидокислот: Образование уреида кислоты:
- 11. Аминокислоты
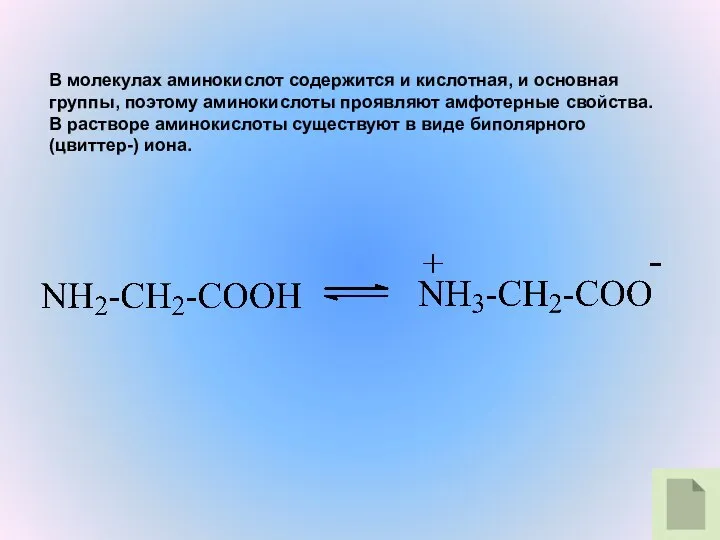
- 12. В молекулах аминокислот содержится и кислотная, и основная группы, поэтому аминокислоты проявляют амфотерные свойства. В растворе
- 13. Как карбоновые кислоты они образуют функциональные производные: а) соли H2N–CH2–COOH + NaOH → H2N–CH2–COO− Na +
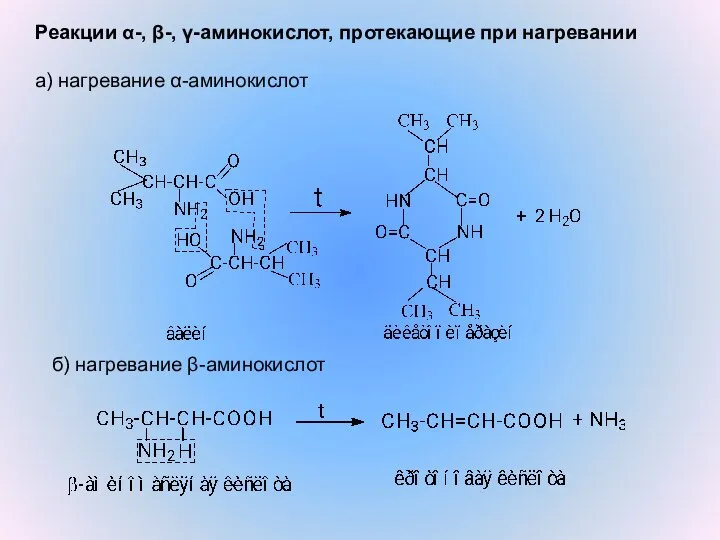
- 14. Реакции α-, β-, γ-аминокислот, протекающие при нагревании а) нагревание α-аминокислот б) нагревание β-аминокислот
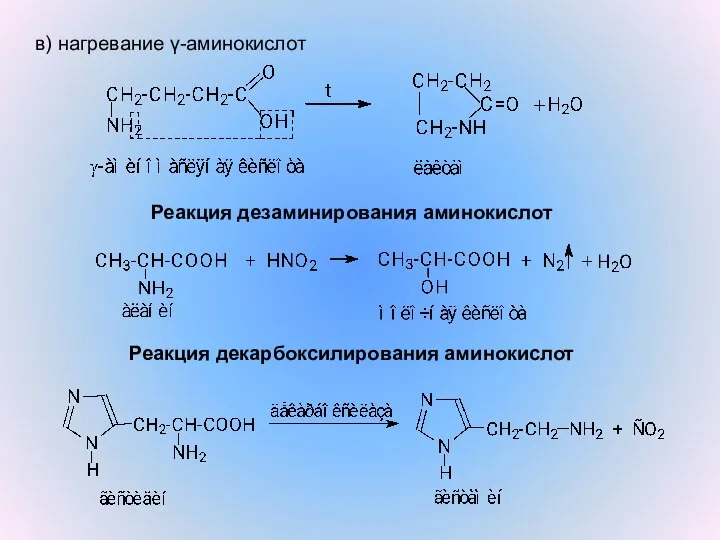
- 15. в) нагревание γ-аминокислот Реакция дезаминирования аминокислот Реакция декарбоксилирования аминокислот
- 17. Скачать презентацию




 Основные свойства и опасности нефти. Безопасность для танкеров
Основные свойства и опасности нефти. Безопасность для танкеров Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Химия и ее значение
Химия и ее значение Центробежное осаждение
Центробежное осаждение Презентация на тему Применение солей
Презентация на тему Применение солей  Формирование универсальных учебных действий
Формирование универсальных учебных действий Введение в органическую химию. Классификация органических соединений
Введение в органическую химию. Классификация органических соединений Кремний и его соединения
Кремний и его соединения Круговорот азота
Круговорот азота Введение в органическую химию. Состав и структура органических веществ
Введение в органическую химию. Состав и структура органических веществ Химическая кинетика
Химическая кинетика Презентация по Химии "Схема получения моноизотопного кремния"
Презентация по Химии "Схема получения моноизотопного кремния" 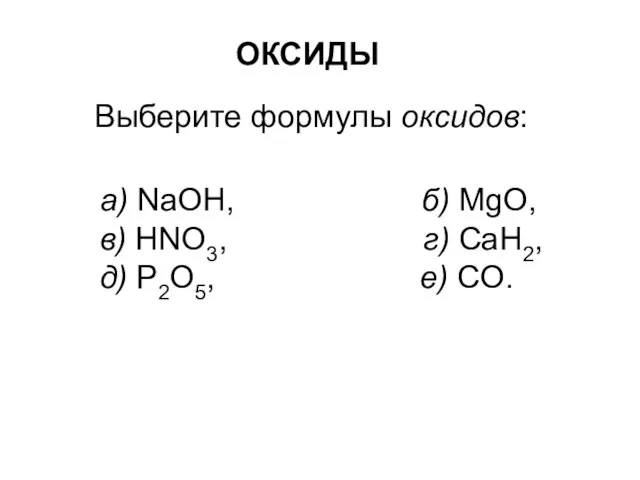 Оксиды
Оксиды Органическая химия
Органическая химия 10 класс урок № 2 ТХС
10 класс урок № 2 ТХС Процессы подготовки горючих ископаемых к переработке. Лекция № 2
Процессы подготовки горючих ископаемых к переработке. Лекция № 2 Основы МКТ
Основы МКТ Алкадиены, каучуки
Алкадиены, каучуки Типичные окислители. 9 класс
Типичные окислители. 9 класс Генетическая связь между основными классами неорганических соединений
Генетическая связь между основными классами неорганических соединений Лекция 2 Классы неорганических соединений (1)
Лекция 2 Классы неорганических соединений (1) Химическае препараты
Химическае препараты Термодинамика
Термодинамика Полимеры
Полимеры Цианоакрилатовая камера для выявления жировых следов
Цианоакрилатовая камера для выявления жировых следов Химическая связь. Типы кристаллических решёток
Химическая связь. Типы кристаллических решёток Полімер поліетилен
Полімер поліетилен Изучение ТЭД и ОВР в школьном курсе химии
Изучение ТЭД и ОВР в школьном курсе химии