Содержание
- 2. Ход урока: 13.10.2016 2
- 3. Из истории фосфора Название фосфора происходит от греческого phosporus – несущий свет. Открыт алхимиком Х. Брандом
- 4. Общая характеристика фосфора Фосфор- элемент V группы, главной подгруппы. Заряд ядра атома фосфора равен +15. В
- 5. 13.10.2016 Р 31 +15 0 ))) p+= 15 e¯ = 15 n°= 15 Электронное строение 2
- 6. НАХОЖДЕНИЕ В ПРИРОДЕ 13.10.2016 ФОСФОР В ПРИРОДЕ вавелит деклуазит пироморфит лазулит ванадит эритрин Содержание фосфора в
- 7. Фосфор – простое вещество 13.10.2016 АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА Металлический фосфор Красный фосфор Белый фосфор Черный фосфор
- 8. 13.10.2016 Аллотропия – существование одного и того же химического элемента в виде двух и более простых
- 9. Белый фосфор http://files.school-collection.edu.ru/dlrstore/db4e88f1-236a-47d0-d510-9c6b6bccb982/index.htm Белый с желтым оттенком T плав. = 44,1оС Химически очень активен Не растворим
- 10. http://files.school-collection.edu.ru/dlrstore/0a22315c-8aad-c506-5565-cb501f201476/index.htm Темно - малиновый порошок Т воспламенения = 2600С, Химически менее активен, чем белый фосфор. На
- 11. Черный фосфор 13.10.2016 Черный, жирный на ощупь, плотность 2700 кг/м3 полупроводник, воспламеняется при 4900С, инертен, не
- 12. 13.10.2016 Кристаллическая решетка кубическая; Плотность 3,83г/см3; Теплопроводность есть Металлический блеск есть Растворимость в воде нет Химическая
- 13. 13.10.2016 В промышленности фосфор получают электротермическим способом. Фосфорит нагревают в смеси с кварцевым песком и коксом
- 14. 13.10.2016 Химические свойства фосфора Взаимодействие с металлами Взаимодействие с кислотами Взаимодействие с неметаллами Взаимодействие с окислителями
- 15. Химические свойства фосфора 13.10.2016 http://files.school-collection.edu.ru/dlrstore/0ae2106a-e2cd-acdc-f40b-628a07e3819d/index.htm Взаимодействие с металлами Са + Р = Mg + P =
- 16. Химические свойства фосфора 13.10.2016 http://files.school-collection.edu.ru/dlrstore/e0699f11-1c29-e9b9-8350-013b6eae472b/index.htm Взаимодействие с неметаллами P + O2(изб)= P + Cl2 = P
- 17. Химические свойства фосфора 13.10.2016 Взаимодействие с кислотами Другие окислители Составьте уравнение химической реакции: Р + KClO3
- 18. Расставить коэффициенты методом электронного баланса 13.10.2016 Малютина Г.И. Р + KClO3 → KCl + P2O5 0
- 19. Химические свойства фосфора 13.10.2016 Взаимодействует с водяным паром при температуре выше 500 °С, протекает реакция диспропорционирования
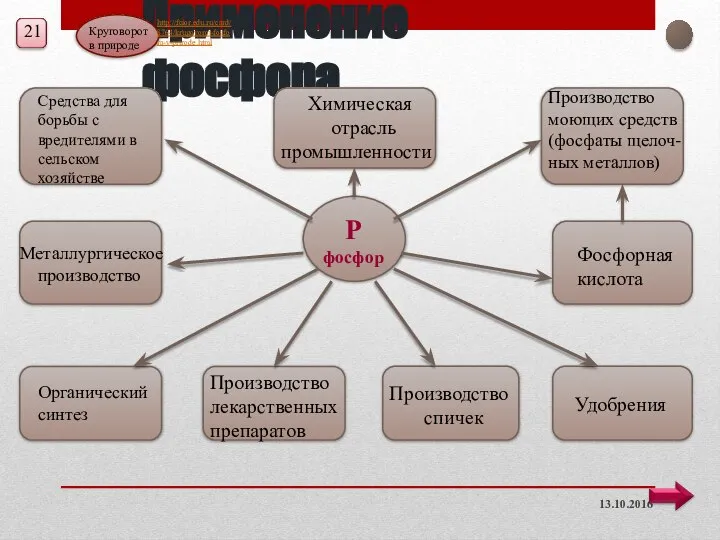
- 20. Применение фосфора 13.10.2016 Р фосфор Средства для борьбы с вредителями в сельском хозяйстве Металлургическое производство Производство
- 22. Скачать презентацию


















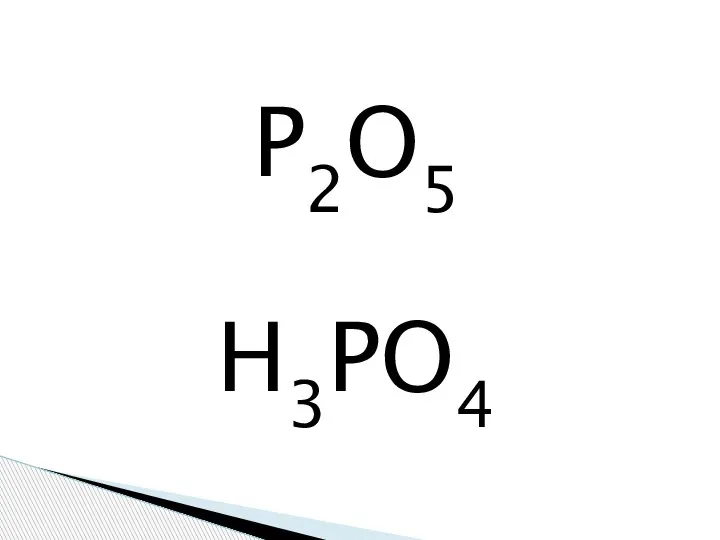 Фосфорная кислота
Фосфорная кислота Степень окисления (СО) – § 18
Степень окисления (СО) – § 18 Презентация на тему Интеллект – мой выбор
Презентация на тему Интеллект – мой выбор  Диссоциация кислот, щелочей, солей
Диссоциация кислот, щелочей, солей Основные классы неорганических соединений
Основные классы неорганических соединений Первые химические символы
Первые химические символы Хром. Месторождения
Хром. Месторождения Коррозия. способы защиты от коррозии
Коррозия. способы защиты от коррозии Пересчет данных анализа, выраженных в ионной форме
Пересчет данных анализа, выраженных в ионной форме Гомологи и изомеры
Гомологи и изомеры Презентация на тему "Водород"
Презентация на тему "Водород" Предельные углеводороды. Алканы (1)
Предельные углеводороды. Алканы (1)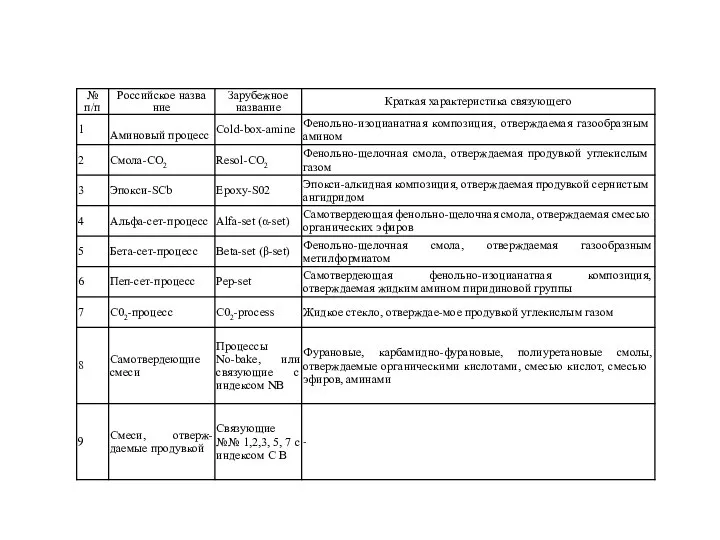 Фенольно-изоцианатная композиция
Фенольно-изоцианатная композиция Молекулярная струйная печать
Молекулярная струйная печать Соединения железа
Соединения железа Металлы. Урок – обобщения
Металлы. Урок – обобщения Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз
Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз Спирты
Спирты Игра Самый умный химик
Игра Самый умный химик Валентность химических элементов. Определение валентности элементов по формулам их соединений
Валентность химических элементов. Определение валентности элементов по формулам их соединений Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Органическая химия. Химические свойства и типы реакций. (9 класс)
Органическая химия. Химические свойства и типы реакций. (9 класс) Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах
Презентация на тему Обобщение знание и умений и предельных и непредельных углеводородах  Химическая связь. Строение вещества
Химическая связь. Строение вещества Комбинаторика в химии
Комбинаторика в химии Сущность химических реакций и признаки их протекания
Сущность химических реакций и признаки их протекания Титриметрический анализ. Основные понятия
Титриметрический анализ. Основные понятия Интересное о кристаллизации
Интересное о кристаллизации