Слайд 2Дәріс жоспары:
1. Биохимияға кіріспе.
2. Протеиногендік амин қышқылдарының құрылысы мен жіктелуі.
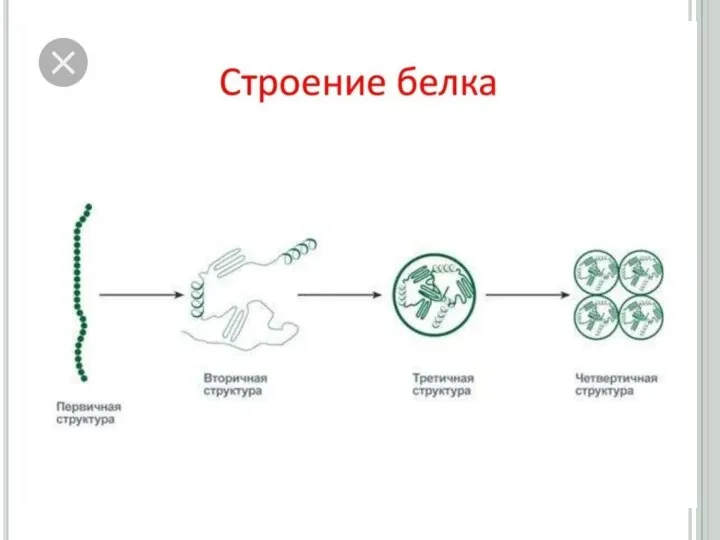
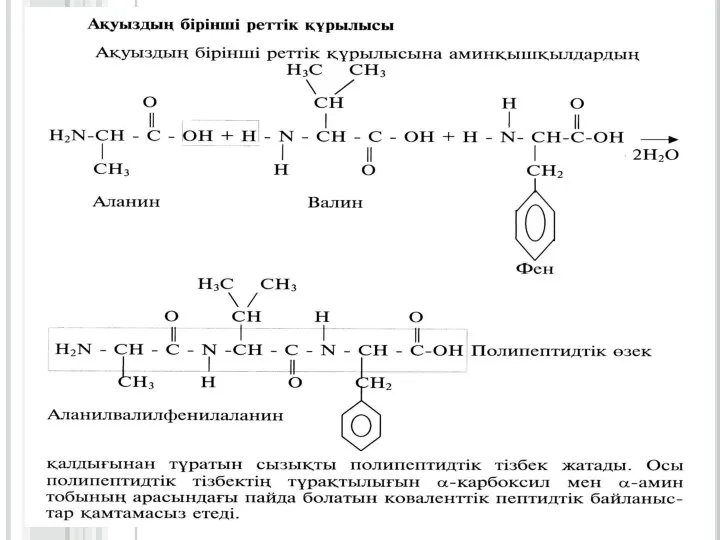
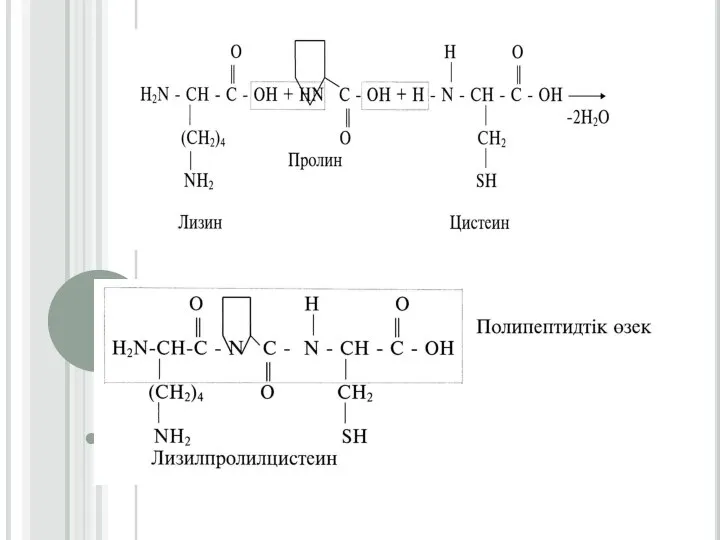
3. Нәруыздардың бірінші,

екінші, үшінші және төртінші реттік құрылыстары.
4. Нәруыздардың суперекіншілік құрылымы.
5. Нәруыздардың домендік құрылымы.
Слайд 3
КІРІСПЕ
Биологиялық химия, тіршілік туралы ғылым, яғни организмнің құрамына кіретін заттардың құрылысын, биологиялық

қызметін, олардың алмасуын және тіршіліктің негізіне жататын химиялық, физика-химиялық процесстердің бірімен-бірінің тығыз байланыста екендігін молекулалық деңгейде зерттейтін ғылым.
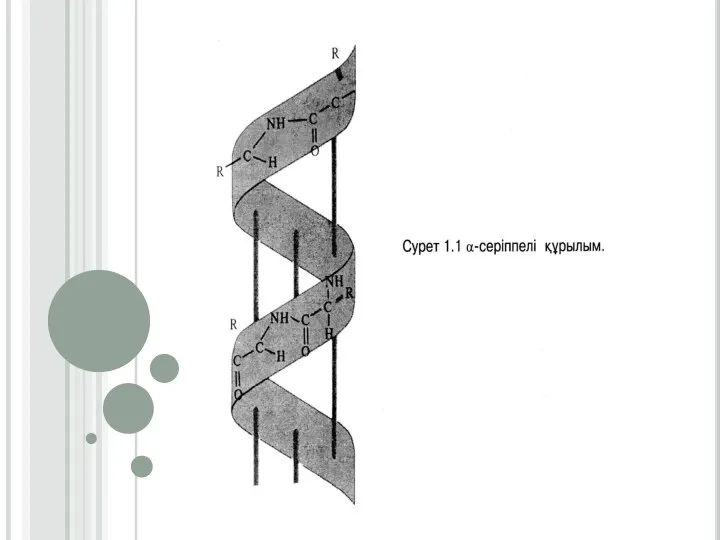
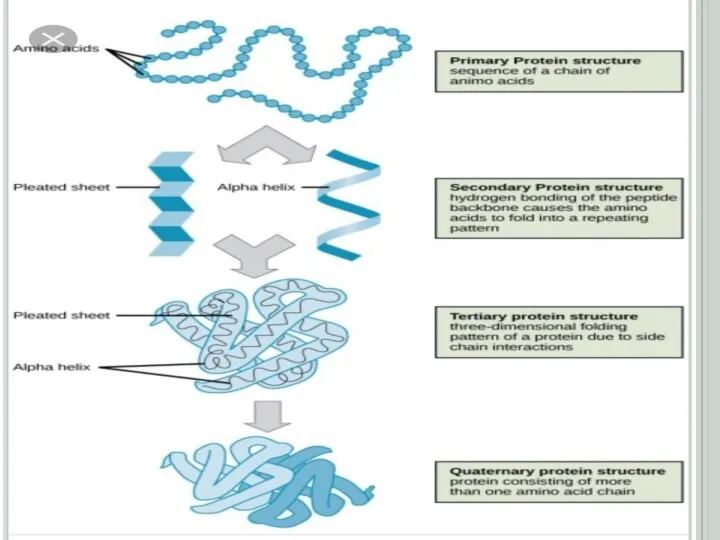
Слайд 10Ақуыздардың екінші реттік құрылысы
Екінші реттік құрылыстың үш түрі болады: α-серіппелі, β-құрылымды (қатпарлы

қабатты) және ретсіз құрылым. Ал β-құрылымының өзі екіге бөлінеді: толық- β-құрылымға (екі және оданда көп полипептидтік тізбектен түзілетін) және қысқа-β-құрылымға (бір полипептидтік тізбектің бойында түзілетін).
α-серіппелі қүрылым әрбір аминқышқылының (NН) имин тобы мен ол аминқышқылынан төртінші ретте орналасқан (-С = О) карбонилдік тобының арасында түзілетін сутектік байланыстардың нәтижесінде түзіледі. α-серіппелі құрылымның әрбір оралымы 3,6 аминқышқылдарының қалдығынан тұрады. Сутектік байланыстар α - серіппелі құрылымның өсінің бойына бағытталып, оның оралымдарын байланыстырады. Бір оралымның биіктігі 0,54 нм (нонометрге) тең. α -серіппелі құрылымның әрбір ретті кезеңі 5 оралымнан немесе 18 аминқышқылдарының қалдығынан тұрады (сурет1.1)
Слайд 12Толық-β-құрылым (қатпарлы қабат) бірнеше полипептидтік тізбектерінің карбонил және имин топтарының арасында пайда

болған сутектік байланыстардың нәтижесінде түзіледі. Бұл құрылым антипараллельді (егерде полипептидтік тізбектің N-соңы қарама қарсы жаққа бағытталған болса) және параллельді (полипептидтік тізбектердің N-соңы бір жаққа қарай бағытталған болса). (Сурет 1.2 және 1.3.)
Слайд 13Толық-β - құрылымындағы полипептидтік тізбектер бір біріне паралелльді орналасып, парақ қағазды қатарлап
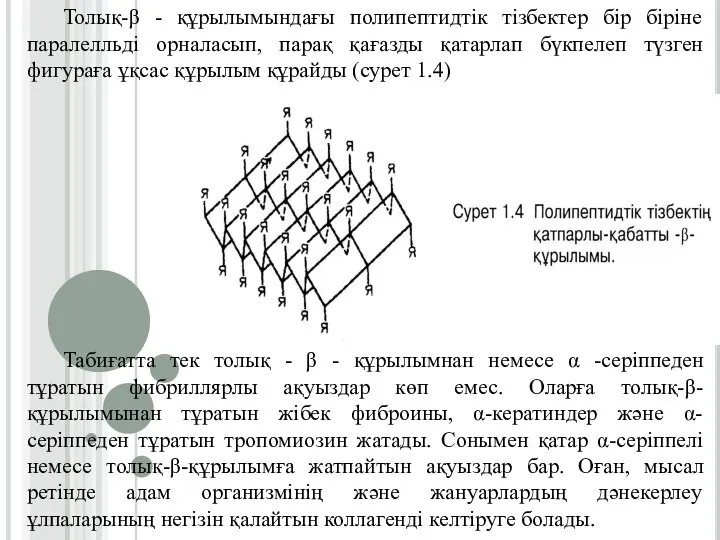
бүкпелеп түзген фигураға ұқсас құрылым құрайды (сурет 1.4)
Табиғатта тек толық - β - құрылымнан немесе α -серіппеден тұратын фибриллярлы ақуыздар көп емес. Оларға толық-β-құрылымынан тұратын жібек фиброины, α-кератиндер және α-серіппеден тұратын тропомиозин жатады. Сонымен қатар α-серіппелі немесе толық-β-құрылымға жатпайтын ақуыздар бар. Оған, мысал ретінде адам организмінің және жануарлардың дәнекерлеу ұлпаларының негізін қалайтын коллагенді келтіруге болады.
Слайд 14Қысқа-β-құрылым, бір полипептидтік тізбектің бойында α-серіппелі және ретсіз құрылымдармен кезектесіп орналасады. Бір

полипептидтік тізбек өзі өзіне қарай иілгенде, оның екі бөлігі кеңістікте бір біріне жақындайды да, имин және карбонил топтарының арасында сутектік байланыстар түзіліп, антипараллельді қатпарлы қабатты құрылым (қысқа-β- құрылым) түзіледі. Көптеген ақуыздардың полипептидтік тізбектерінің бір бөліктері α-серіппелі құрылым, екінші бөліктері қысқа-β-құрылым, үшінші бөліктері ретсіз құрылым түзеді (сурет 1.5, кесте 1.1)
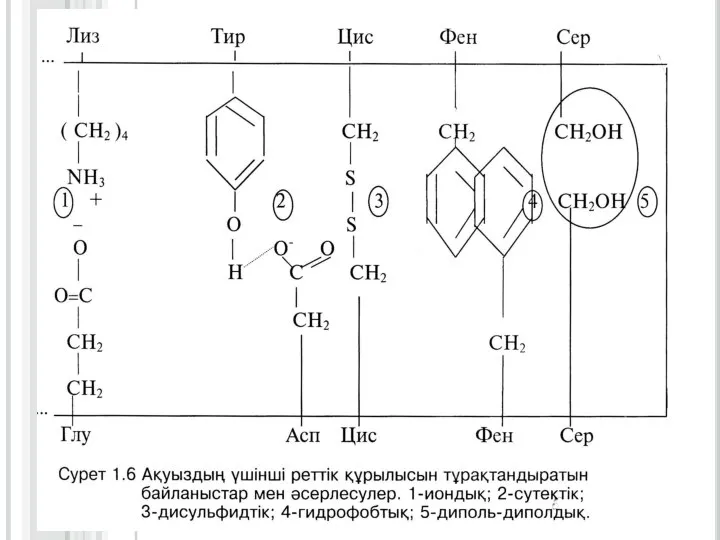
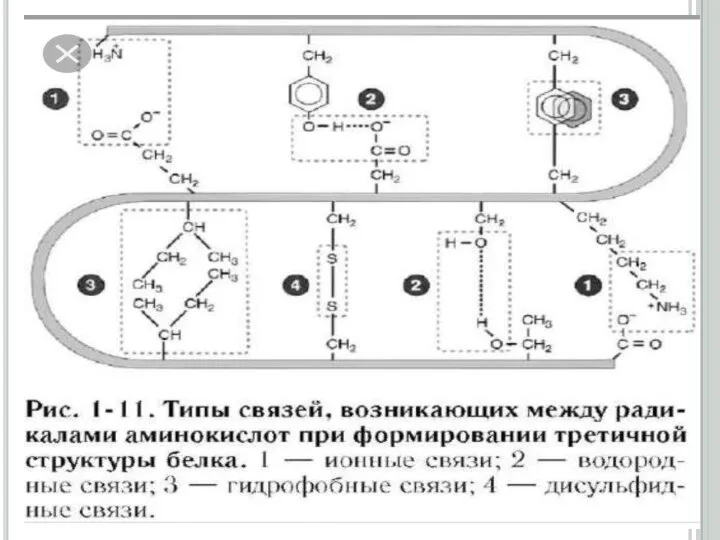
Слайд 15Ақуыздардың үшінші реттік құрылысы
Екінші реттік құрылымды полипептидтік тізбектің кеңістікте белгілі көлемде орналасуы

нәтижесінде түзілген құрылымды үшінші реттік құрылыс деп атайды. Үшінші реттік құрылымның формасына (сыртқы пішініне) қарай, ақуыздарды глобулярлық (элипсоид тәрізді) және фибриллярлық (тартылған жіп тәрізді) түрлеріне бөледі.
Глобулярлық ақуыздардың үшінші реттік құрылысы бір полипептидтік тізбектің аминқышқылдарының бүйірлі радикалдарының арасында түзілген сутектік, иондық, дисульфидтік байланыстардың және гидрофобтық, диполь -дипольдық әсерлесулердің қатысуымен пайда болады
Слайд 19Ақуыздардың төртінші реттік құрылысы
Екі және одан да көп полипептидтік тізбектен тұратын ақуыздар

үшін төртінші реттік құрылым деген ұғым енгізіледі. Төртінші реттік құрылымды ақуыздарды олигомер (немесе мультимер) деп атайды. Олигомердің құрамына кіретін үшінші реттік құрылысты полипептидтік тізбектер, протомерлер немесе суббөліктер деп аталады. Ақуыздың төртінші реттік құрылымы, үшінші реттік құрылысты протомерлердің арасында сутектік, гидрофобтық, иондық және аз мөлшерде дисульфидтік байланыстардың түзілуі нәтижесінде пайда болады.
Олигомерлік ақуыздардың өзін өзі жинау процессінің жүруі (төртінші реттік құрылымының түзілуі) жоғарғы талғамдылықпен ерекшеленеді. Протомерлердің бірінің бірін танып байланыс түзуі, олардың жанасушы беттерінің құрылысының сәйкес келуіне немесе протомерлердің комплементарлығына байланысты. Олигомерлік ақуыздың қүрамына кіретін протомерлердің кілт пен құлып сияқты сәйкес келіп сутектік, иондық, дисульфидтік байланыс және гидрофобтық әсерлесу түзе алатын нүктелерін комплементарлы деп атайды. Әрбір протомер өзінше биологиялық қасиет көрсете алмайды.
Слайд 20Олигомерлік ақуыздарга темекі мозайкалық вирусы (РНҚ-ның бір молекуласынан және бір текті ақуыздың
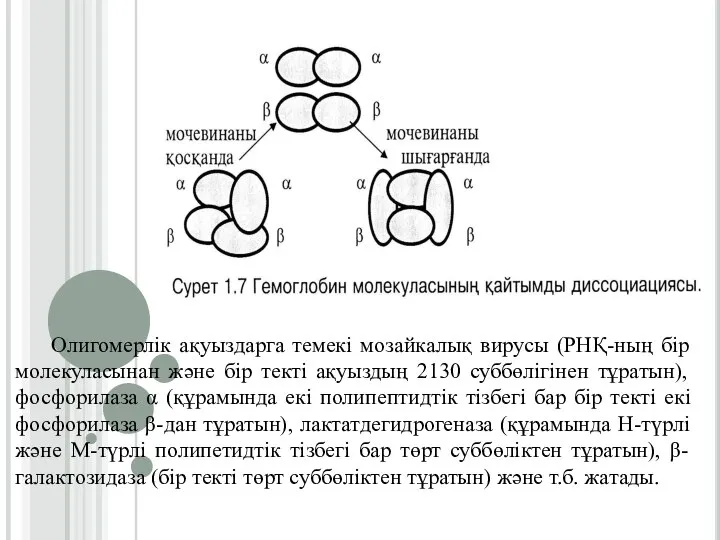
2130 суббөлігінен тұратын), фосфорилаза α (құрамында екі полипептидтік тізбегі бар бір текті екі фосфорилаза β-дан тұратын), лактатдегидрогеназа (құрамында Н-түрлі және М-түрлі полипетидтік тізбегі бар төрт суббөліктен тұратын), β-галактозидаза (бір текті төрт суббөліктен тұратын) және т.б. жатады.
Слайд 21Нәруыздардың суперекіншілік құрылымы
Әрбір нәруыздар кеңістік кұрылысы ерекше және ол біріншілік құрылыммен анықталады.

Дегенмен құрылымы және қызметі әр түрлі нәруыздардың конформациясын салыстыру екіншілік құрылымдарында ұқсас топтасулардың бар екендігін көрсетеді. Мұндай екіншілік құрылымның қалыптасуының ерекше реті нәруыздардың суперекіншілік кұрылымы деп аталады. Суперекіншілік кұрылым радикалдар арасындағы әрекеттесулерден калыптасады.
α-Спиральдар мен β-кұрлымның белгілі бір ерекше топтасуы «кұрылымдық мотивтері» деп аталады.
Олар «α-спираль-бұрылыс- α -спираль», «α/β - бөшкелік құрылым, лейцинді тістесіп-бірігіп», «мырышты саусақ» және т.б. ерекше аттармен аталады. α-Спиральдар мен β-құрылымнын кеңістіктегі ерекше орналасуы радикалдар арасындағы әрекеттесулер арқылы іске асады.
Слайд 22α/β -Бөшкелік суперекіншілік құрылым
Мұндай құрылым, шынында да бөшке тәрізді болып келуі, яғни
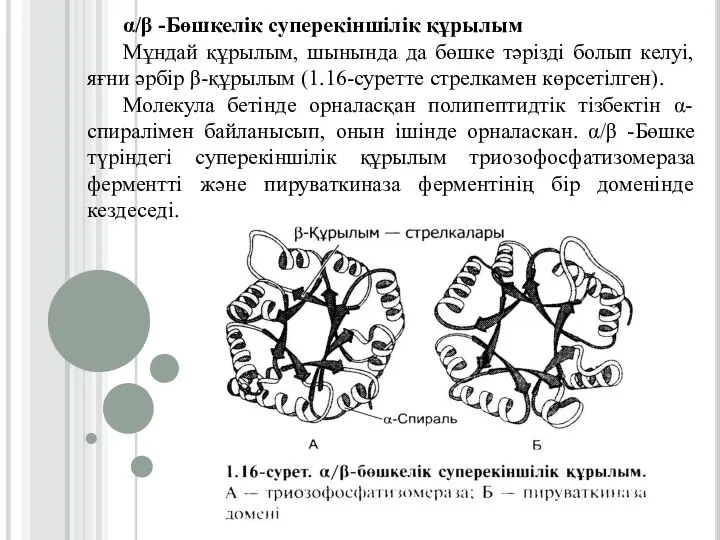
әрбір β-құрылым (1.16-суретте стрелкамен көрсетілген).
Молекула бетінде орналасқан полипептидтік тізбектін α-спиралімен байланысып, онын ішінде орналаскан. α/β -Бөшке түріндегі суперекіншілік құрылым триозофосфатизомераза ферментті және пируваткиназа ферментінің бір доменінде кездеседі.
Слайд 23«α-Спираль – бұрылыс – α -спираль» құрылымдық мотив
Мұндай «құрылымдык мотив» көптеген ДНҚ-

байланыстырушы нәруыздарда кездеседі. Қос спиральданған ДНҚ-құрылымында екі соқпақ бар — үлкен және кіші. Үлкені аздап спиральданған бөлімдері бар нәруыздарды байланыстыруға жақсы бейімделген.
Мұндай құрылымдық мотивте екі α-спираль бар: бірі қысқарақ, екіншісі ұзынырақ, олар полипептидтік тізбектің бұрылысымен байланысқан.
Қысқарақ α-спираль соқпаққа көлденең орналасқан, ал α-спиральдың ұзынырағы үлкен соқпақта орналасқан. Мұндағы байланыстар- амин қышқылдарымен ДНҚ нуклеотидтері арасындағы ковалентті емес, ерекше байланыстар
Слайд 24«Мырышты саусақ түріндегі суперекіншілік құрылым»
Суперекіншілік құрылымның бұл түрі де ДНҚ-ны байланыстырушы нәруыздарда
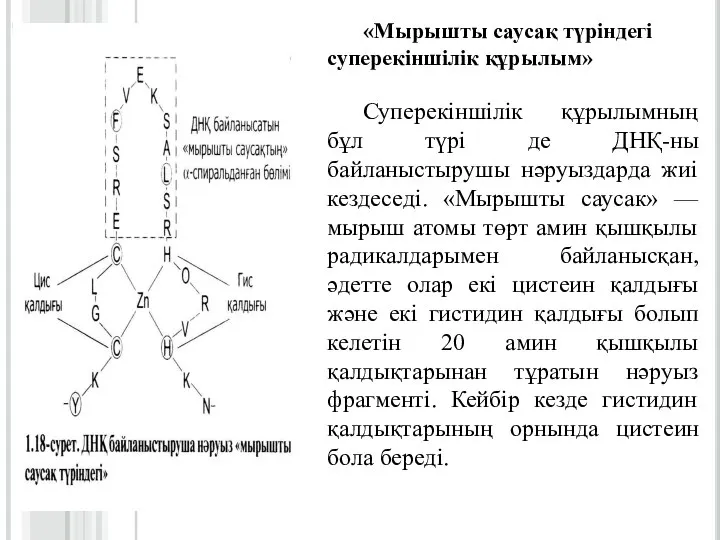
жиі кездеседі. «Мырышты саусак» — мырыш атомы төрт амин қышқылы радикалдарымен байланысқан, әдетте олар екі цистеин қалдығы және екі гистидин қалдығы болып келетін 20 амин қышқылы қалдықтарынан тұратын нәруыз фрагменті. Кейбір кезде гистидин қалдықтарының орнында цистеин бола береді.
Слайд 25
12 амин қышқылдарының қалдықтарына амин қышқылдарының орналасу ретінде біріне-бірі жақын орналасқан екі

цистеин қалдығы, екі гистидин қалдығы (немесе цистеин) белгілі бір қашықтықта орналасқан.
Нәруыздардың бұл бөлімі α-спираль құрап ДНҚ үлкен соқпақтарындағы реттеуші бөлімдермен талғамды байланыса алады.
ДНҚ-байланыстырушы нәруыздар ДНҚ-нын белгілі бір аймақтарымен талғамды әрекеттесуі, «мырышты саусақ» аймақтарында болатын амин кышқыл қалдықтарының орналасу ретіне тәуелді.
«Лейцинді тістесін-біріккен» түрдегі суперекіншілік құрылым
Кейбір ДНҚ-байланыстырушы нәруыздар олигомерлі яғни оның құрамында бірнеше полипептидтік тізбектер болады. Сонымен қатар басқа нәруыздармен кешенді түрде кызмет атқаратын нәруыздар болады. Протомерлердін бір-бірімен немесе кейбір нәруыздардың басқа нәруыздармен кешенді түрде бірігуі «лейцинді тістесіп-біріккен» құрылымдық мотив түрінде іске асады. Әрбір әрекеттесуші екі полипептидтік тізбектің немесе нәруыздардың ең кемінде 4 лейцин қалдығынан тұратын α-спиральды бөлімдері болады.
Слайд 26Лейцин қалдықтары әрбір 6 амин қышқылдарынан кейін қайталанып орналасады. Әрбір α-спиральдың бір
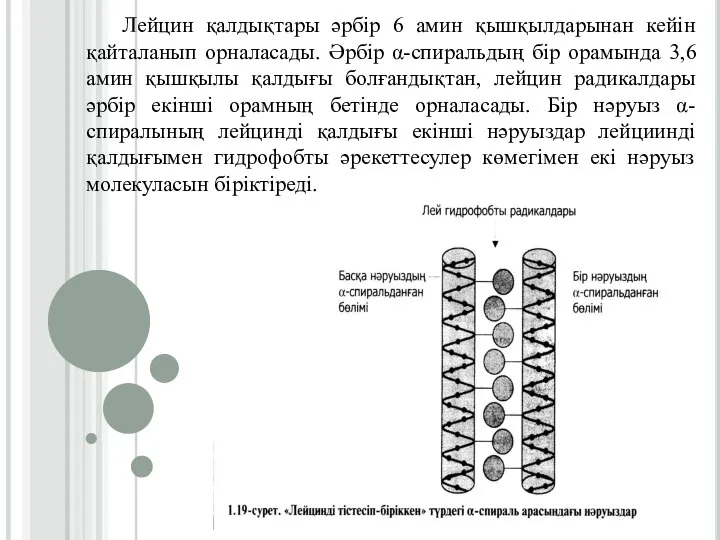
орамында 3,6 амин қышқылы қалдығы болғандықтан, лейцин радикалдары әрбір екінші орамның бетінде орналасады. Бір нәруыз α-спиралының лейцинді қалдығы екінші нәруыздар лейциинді қалдығымен гидрофобты әрекеттесулер көмегімен екі нәруыз молекуласын біріктіреді.
Слайд 27«Лейцинді тістесіп-бірігу» арқылы нәруыздардың қосылуын гистондарды мысалға алып қарастыруға болады. Гистондарядролық нәруыздар,

олардың құрамында оң зарядталған амин қышқылдары - аргинин және лизиннің мөлшері көптеп кездеседі. Гистон молекулалары 8-мономерлі нәруыздардын «лейцинді тістесіп-бірігуі» арқылы барлық мономерлердің күшті оң зарядты болғанына қарамастан кешенді қосылыс түзеді.
Слайд 28НӘРУЫЗДАРДЫҢ ДОМЕНДІ ҚҰРЫЛЫМЫ
Егер нәруызда полипептидтік тізбек 200-ден астам амин қышқылдары қалдықтарынан тұратын

болса, оның кеңістіктегі құрылымы екі немесе одан да көп домендерден тұрады. Домен — полипептидтік тізбектің кеңістіктегі құрылымдардың ұйымдасуы, оның осы тізбектегі басқа бөлімдеріне тәуелсіз нәруыздар глобулярлы конформациясын түзетін бөлімі. Атап айтканда, G иммуноглобулиннің жеңіл тізбегі екі доменнен тұрады. Кейбір кездерде, полипептидтік тізбектің жеке құрылымдық бөлімдерін домендер деп атайды.
Домендерді полипептидтік тізбектің домендері арасындағы пептидтік байланыстарын оңай үзетін протеолиттік ферменттер мен әсер ету арқылы бөліп алуға болады. Бөліп алынған домендер, біраз уақытқа дейін биологиялык қасиетін жоғалтпайды
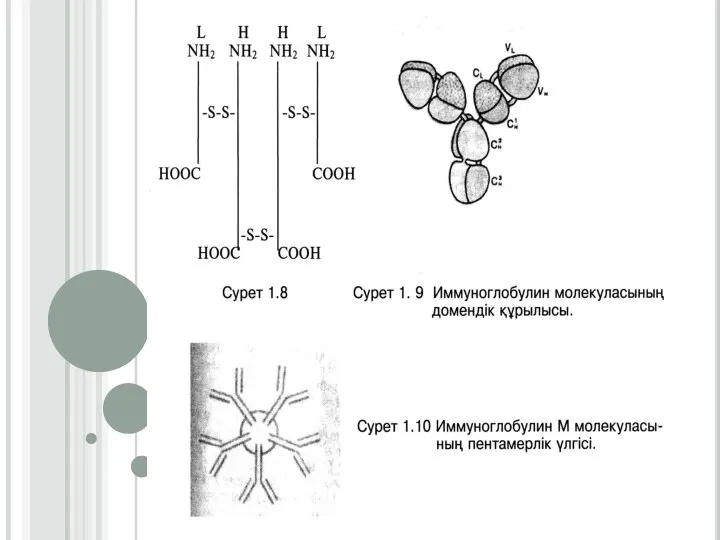
Слайд 29ДОМЕНДІК ҚҰРЫЛЫМДЫ АҚУЫЗДАР
Домендік ақуыздардың құрылысы олигомерлік ақуыздардың құрылысына ұқсас. Бірақта олигомерлік ақуыздардың

әрбір полипептидтік тізбегінен үшінші ретті бір ғана глобул түзіледі, ал домендік ақуыздардың бір полипептидтік тізбегінің бойында екі немесе оданда көп ерекшеленген және бір бірімен пептидтік көпірмен байланысқан глобулдер, яғни домендер түзіледі. Мына салыстырма бойынша домендік құрылысты жеңіл түсінуге болады: егер бір орам жіпті тарқата отырып, жіпті үзбей екінші орамды орағанда оралынбаған жіппен байланысқан екі орамы (домені) пайда болады. Пептидтік көпірмен байланысқан домендер бір бірімен әлсіз байланыспен байланысып, төртінші реттік құрылым түзеді. Домендік құрылымды ақуыздарға иммуноглобулиндер (антиденелер) жатады. Олардың құрылымдық негізін дисульфидтік байланыстармен байланысқан екі жеңіл (L) және екі ауыр (Н) полипептидтік тізбектері құрайды.
Слайд 30Жеңіл полипептидтік тізбектері (200 а.қ. тұратын) екі домендік, ал ауыр полипептидтік тізбектері

(450-700 а.қ. тұратын) төрт доменді түзеді. Осындай құрылымды, иммуноглобулиндердің мономері деп атайды. Полипептидтік тізбектерде өзгергіш (вариабельді-V) және тұрақты (константты-С) бөліктері болады. Константтық бөлігінің бірінші реттік құрылысының айырмашылығына қарай жеңіл полипептидтік тізбектер екі түрге бөлінеді, ал ауыр тізбектері бес түрге бөлінеді. Мономерлердің құрамына кіретін ауыр тізбектердің түріне байланысты, барлық иммуноглобулиндер бес классқа бөлінеді. Әрбір классқа вариабельді бөлігінің бірінші реттік құрылысының өзгешелігіне сәйкес көптеген жеке иммуноглобулиндер кіреді. Барлық класстарға кіретін жеке иммуноглобулиндердің жалпы саны шамамен 107-ге тең. IgG, IgD, және IgE, класстарының антиденелері мономерден тұрады, олардың пішіні Ү-тәрізді. IgА бір бірімен коваленттік байланыстармен байланысқан 2-4 мономерден, ал IgМ бес мономерден құралады. Организмнің көптеген инфекциялық аурулардан қорғануы (иммунитеті) иммуноглобулиндердің қызметіне байланысты. В-лимфоциттерінде антиденелер синтезделінеді де, қанға бөлініп шығып, плазманың иммуноглобулиндік фракциясын құрайды.
Слайд 32Дәріс мазмұны бойынша кері байланыс сұрақтары:
1. Нәруыздардың бірінші, екінші, үшінші реттік құрылыстарына

түсініктеме беріңіз.
2. Нәруыздардың үшінші реттік құрылысын қандай байланыстар тұрақтандырады?
3. Олигомерлік нәруыздардың жиналуына қандай байланыстар қатынасады?
4. Суперекіешілік құрылым қалай түзіледі?
5. Домендік нәруыздардың құрылысы немен ерекшеленген?




















 Балалардағы қант диабетін емдеу кезінде қолданатын жаңа технологиялар
Балалардағы қант диабетін емдеу кезінде қолданатын жаңа технологиялар Внутрибольничная инфекция, понятие и природа современной ВБИ
Внутрибольничная инфекция, понятие и природа современной ВБИ Государственное регулирование в социальной сфере (здравоохранение)
Государственное регулирование в социальной сфере (здравоохранение) Патологии HEEL м-н. Мастит
Патологии HEEL м-н. Мастит Здоровье России. Состояние вопроса
Здоровье России. Состояние вопроса Основные инфекционные заболевания. Тест. 7 класс
Основные инфекционные заболевания. Тест. 7 класс АФО недоношенных детей
АФО недоношенных детей Рациональное питание
Рациональное питание Профилактика коронавирусной инфекции
Профилактика коронавирусной инфекции Базальный режим дозирования инсулина. Принципы коррекции
Базальный режим дозирования инсулина. Принципы коррекции Низкочастотная электротерапия. Производство одноразовых электродов в электротерапии
Низкочастотная электротерапия. Производство одноразовых электродов в электротерапии Жұқпалы аурулар
Жұқпалы аурулар Шовный материал и узлы в хирургии
Шовный материал и узлы в хирургии Методы контроля за состоянием больных и этапы процесса реабилитации
Методы контроля за состоянием больных и этапы процесса реабилитации АИТВ. Ауру қоздырғышы - Т-лимфотропты ретровирус
АИТВ. Ауру қоздырғышы - Т-лимфотропты ретровирус The immediate (early phase) allergic reaction in the nose
The immediate (early phase) allergic reaction in the nose Строение верхней и нижней челюстей
Строение верхней и нижней челюстей Период грудного возраста
Период грудного возраста СРС: Организация работы специализированных БИТ
СРС: Организация работы специализированных БИТ Витамин Р
Витамин Р Сравнительная перкуссия легких
Сравнительная перкуссия легких Острый аппендицит
Острый аппендицит Применение лекарственных средств при патологиях дыхательной системы на ФАП. Тема 5
Применение лекарственных средств при патологиях дыхательной системы на ФАП. Тема 5 Рак кожи. Меланома. Кафедра онкологии, лучевой терапии и лучевой диагностики
Рак кожи. Меланома. Кафедра онкологии, лучевой терапии и лучевой диагностики Кровь. Функции крови
Кровь. Функции крови Сахарный диабет у детей
Сахарный диабет у детей Санитарная микробиология. Вода
Санитарная микробиология. Вода Антибиотики
Антибиотики