Содержание
- 2. У клінічній практиці вже давно відомо, що препарати, що мають одні і ті ж активні речовини,
- 3. Біологічна доступність Біодоступність - це швидкість і ступінь, з яким активна субстанція накопичується в місці її
- 4. Процес вивільнення лікарської речовини часто є чинником, лімітуючим швидкість всмоктування в тих випадках, коли препарат призначають
- 5. Препарат-генерик В даний час дослідження біодоступності/біоеквівалентності лікарських засобів вважається основним видом медико-біологічного контролю якості препаратів, особливо
- 6. Біоеквівалентність – порівняльна біодоступність двох препаратів Вимога ефективності і безпеки генеричних лікарських препаратів, вироблюваних різними фірмами,
- 7. Біологічна нееквівалентність Терміном біологічна нееквівалентність лікарських препаратів позначається невідповідність одних і тих же препаратів, що випускаються
- 8. Значення досліджень по біоеквівалентності Якщо неможливо встановити причину зміни реакції організму на лікарський препарат, це може
- 9. Регламент проведення досліджень по біоеквівалентності У зв'язку з цим, в 1991 р. в Канаді і в
- 10. Особливості препаратів-генериків Генерічеськоє лікарський засіб містить активна лікарська речовина (активну субстанцію) ідентичне активній речовині оригінального (патентованого)
- 11. Генеричний лікарський препарат може розглядатися як взаємозамінний оригінального препарату тільки в тому випадку, якщо він відповідає
- 12. Вимоги до виробництва препаратів-генериків Для генеричних препаратів необхідно: при виробництві - дотримання вимог належної виробничої практики
- 13. Визначення біоеквівалентності Біоеквівалентність - два лікарські препарати вважаються біоеквівалентними, якщо вони фармацевтично еквівалентні і їх біодоступність
- 14. Особливості при проведенні дослідження по біоеквівалентності Необхідно підкреслити, що вивчення біоеквівалентності - це клінічні випробування, де
- 15. Вимоги до випробовуваних Контингент досліджуваних для вивчення біоеквівалентності повинен бути якомога одноріднішим, тому дослідження повинне проводитися
- 16. Можливість пацієнтів (здорових добровольців) брати участь в дослідженні повинна підтверджуватися даними, отриманими при використанні стандартних лабораторних
- 17. Кількість випробовуваних для проведення дослідження Мінімальне число випробовуваних, таких, що залучаються до досліджень біоеквівалентності, складає 12
- 18. Особливості режиму для випробовуваних при проведенні дослідження З метою мінімізації відмінностей, що виникають під впливом чинників,
- 19. Особливості дизайну випробування Особливістю дизайну таких досліджень є те, що кожний з випробовуваних отримує як стандартний
- 20. Фармкокінетичні параметри, які визначаються для оцінки біодоступності і біоеквівалентності При вивченні біодоступності лікарських препаратів найбільш важливими
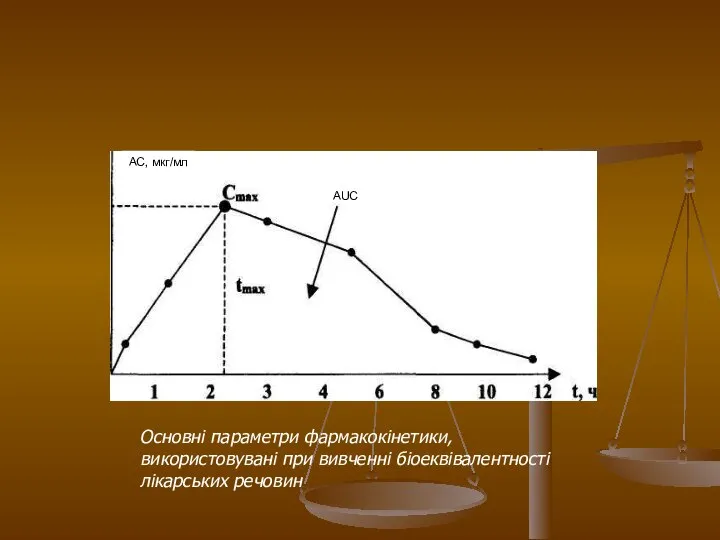
- 21. АС, мкг/мл Основні параметри фармакокінетики, використовувані при вивченні біоеквівалентності лікарських речовин
- 22. При вивченні біодоступності методом введення одноразової дози площа під кривою «концентрація-час» визначається після одноразового введення лікарського
- 23. Час відбору проб для дослідження Час узяття проб крові у випробовуваних необхідно планувати так, щоб забезпечити
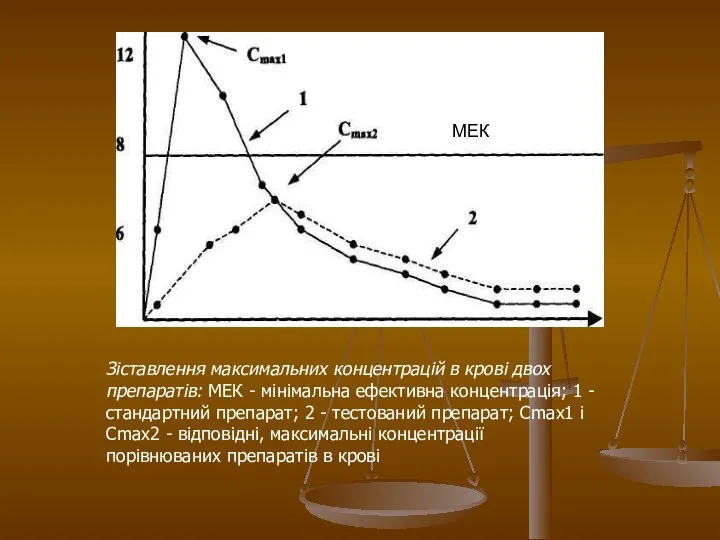
- 24. Значення показника максимальної концентрації речовини можна пояснити за допомогою наступного прикладу. На малюнку 2 представлені фармакокінетичні
- 25. Зіставлення максимальних концентрацій в крові двох препаратів: МЕК - мінімальна ефективна концентрація; 1 - стандартний препарат;
- 26. Крива 1 характеризує концентрацію в крові стандартного препарату, а крива 2 - тестованого. Горизонтальною лінією відмічена
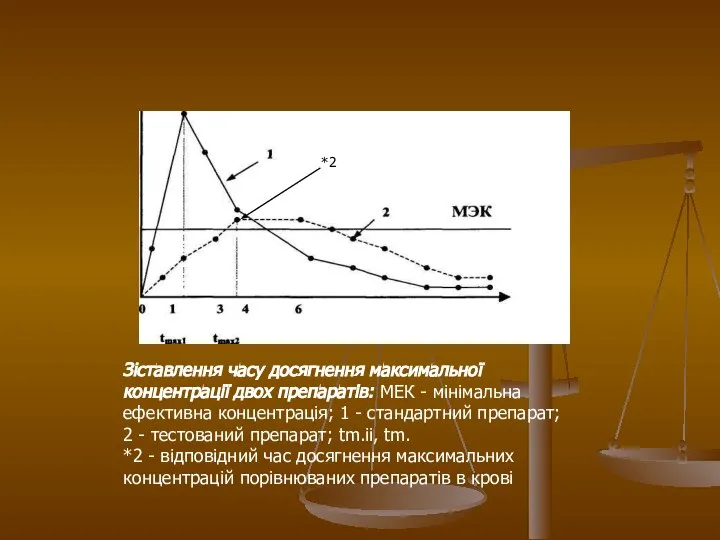
- 27. На малюнку 3 показано, що максимальна концентрація стандартного препарату (крива 1) досягається через 1 годину, а
- 28. Зіставлення часу досягнення максимальної концентрації двох препаратів: МЕК - мінімальна ефективна концентрація; 1 - стандартний препарат;
- 29. На малюнку 4 представлений інший приклад співвідношення кривих, що відображають кінетику двох порівнюваних препаратів. Площа під
- 30. Зіставлення площ під фармакокинетичними кривими двох препаратів: 1 - стандартний препарат; 2 - тестований препарат; AUC1,
- 31. Таким чином, два препарати вважаються біоеквівалентними, якщо вони мають схожі фармакокінетичні показники. За регламентом ВОЗ (1994,
- 32. Звіт про проведене випробування Всі етапи проведення дослідження повинні ретельно фіксуватися, аналізуватися, описуватися, відповідно до заздалегідь
- 34. Скачать презентацию




























 Мочекаменная болезнь
Мочекаменная болезнь СПА-уход для Вас www.nuskinbg.com. - презентация_
СПА-уход для Вас www.nuskinbg.com. - презентация_ День психического здоровья
День психического здоровья День здоровья. Победим диабет!
День здоровья. Победим диабет! Балалардағы бронх-өкпелік дисплазиялар
Балалардағы бронх-өкпелік дисплазиялар Снятие зубных отложений методом air-flow
Снятие зубных отложений методом air-flow Хромосомное заболевание синдром Патау
Хромосомное заболевание синдром Патау Вирус простого герпеса (ВПГ)
Вирус простого герпеса (ВПГ) Повреждение барабанной перепонки
Повреждение барабанной перепонки Боли в спине, их причины и профилактика. Эргономика. Л3
Боли в спине, их причины и профилактика. Эргономика. Л3 Физиотерапия: гирудотерапия, оксигенотрапия
Физиотерапия: гирудотерапия, оксигенотрапия Инфекционное заболевание туберкулез
Инфекционное заболевание туберкулез Язвенная болезнь
Язвенная болезнь Стоматологические инструменты, пломбировочные материалы. Лекция 4
Стоматологические инструменты, пломбировочные материалы. Лекция 4 Онкологические заболевания. Профилактика
Онкологические заболевания. Профилактика Послеродовый период
Послеродовый период Первая помощь при кровотечениях
Первая помощь при кровотечениях Состояние здоровья современных подростков и пути их оздоровления
Состояние здоровья современных подростков и пути их оздоровления Методика приготовления препаратов СМЖ для микроскопиче ского исследования
Методика приготовления препаратов СМЖ для микроскопиче ского исследования Экстренная хирургическая патология у детей
Экстренная хирургическая патология у детей Дифференциальная диагностика болей в грудной клетке в свете хирургической патологии сердечно-сосудистой системы
Дифференциальная диагностика болей в грудной клетке в свете хирургической патологии сердечно-сосудистой системы Современные принципы диагностики и терапии легочной артериальной гипертензии
Современные принципы диагностики и терапии легочной артериальной гипертензии Анорексия. Стадии развития и признаки анорексии
Анорексия. Стадии развития и признаки анорексии Мочевыделительная система
Мочевыделительная система Порядок проведения диспансеризации определенных групп взрослого населения
Порядок проведения диспансеризации определенных групп взрослого населения Массаж для новорожденных
Массаж для новорожденных Проба на индивидуальную совместимость по системе АВО
Проба на индивидуальную совместимость по системе АВО Бронхиальная астма
Бронхиальная астма