Содержание
- 2. Часть 1. Группы крови Система АВО Система резус-фактора Переливание крови
- 3. 1628 г. — Английский врач Уильям Гарвей делает открытие о кровообращении в человеческом организме. Почти сразу
- 4. 1882 г. - Джеймс Бланделл (англ. James Blundell), британский акушер, проводит первое удачное переливание человеческой крови
- 5. 1840 г. - В колледже Святого Георгия в Лондоне под руководством Бланделла проводится первое удачное переливание
- 6. 1900 г. - Карл Ландштейнер (нем. Karl Landsteiner), австрийский врач, открывает первые три группы крови —
- 7. 1908 г. — Французский хирург Аллексис Каррель (фр. Alexis Carrel) разработал способ предотвращения свёртываемости, пришивая вену
- 8. 1914 г. — Изобретены и введены в действие антикоагулянты долговременного действия, позволившие консервировать донорскую кровь, и
- 9. Система АВО
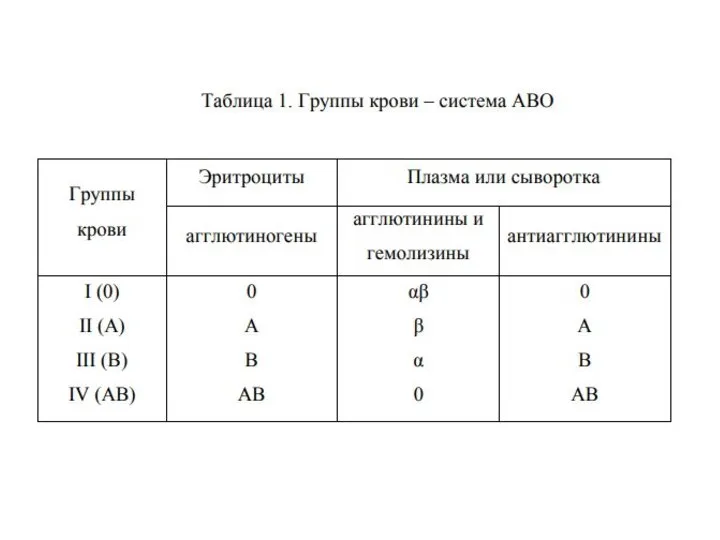
- 10. Определение групповой принадлежности по системе АВ0 основано на наличии естественных агглютиногенов на поверхности эритроцитов А и
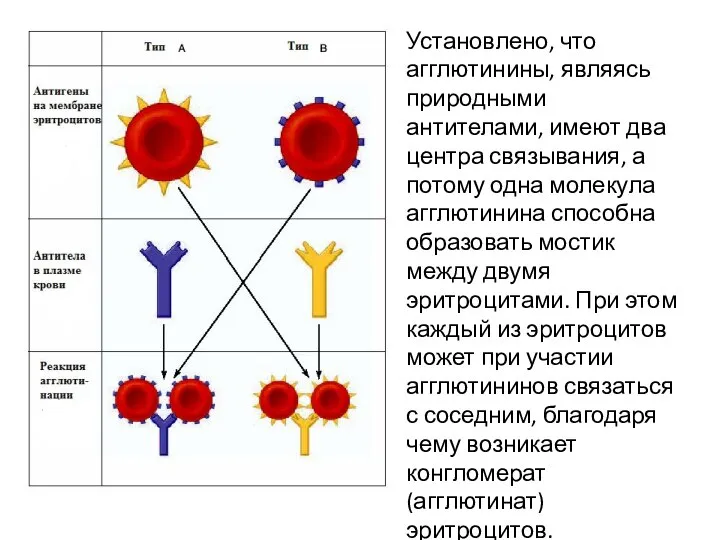
- 11. Установлено, что агглютинины, являясь природными антителами, имеют два центра связывания, а потому одна молекула агглютинина способна
- 12. В крови одного и того же человека не может быть одноименных агглютиногенов и агглютининов, так как
- 13. Кроме агглютининов, в плазме, или сыворотке, крови содержатся гемолизины, их также два вида и они обозначаются,
- 15. Вопрос 1. Групповую принадлежность по системе АВ0 определяет: набор эритроцитарных антигенов набор лейкоцитарных антигенов набор приобретенных
- 16. Система резус-фактора
- 17. К. Ландштейнер и А.Винер (1940) обнаружили в эритроцитах обезьяны макаки резус антиген, названный ими резус-фактором. Оказалось,
- 18. Внимательно читаем вопрос!! Вопрос 2. Резус-антитела накапливаются в: плазме крови лейкоцитах тромбоцитах эритроцитах
- 19. Резус – конфликт При повторном переливании резус-несовместимой крови При резус-несовместимой беременности
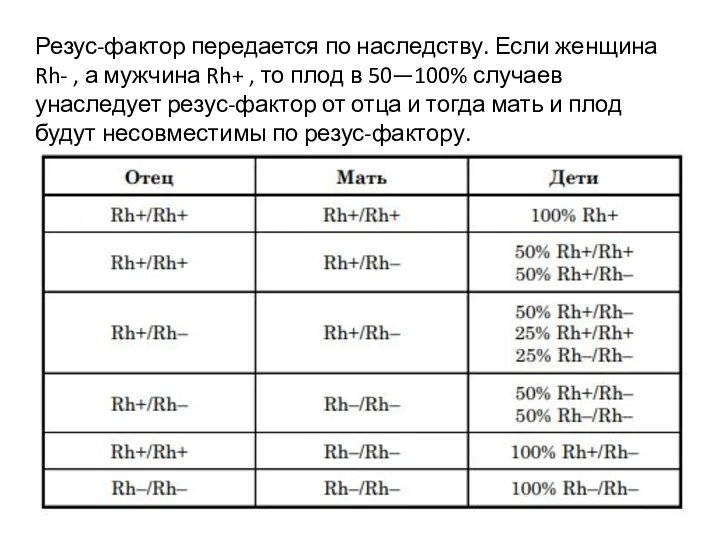
- 20. Резус-фактор передается по наследству. Если женщина Rh- , а мужчина Rh+ , то плод в 50—100%
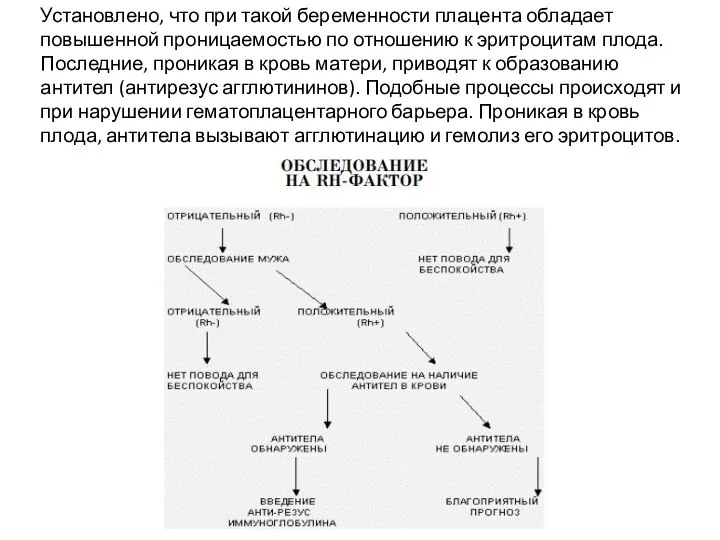
- 21. Установлено, что при такой беременности плацента обладает повышенной проницаемостью по отношению к эритроцитам плода. Последние, проникая
- 22. + антибонус!!! Тяжелейшие осложнения, возникающие при переливании несовместимой крови и резус-конфликте, обусловлены не только образованием конгломератов
- 23. Вопрос 3 Если кровь, содержащею резус-фактор впервые перелить человеку, кровь которого его не содержит, то: образуются
- 24. Переливание крови
- 27. Вопрос 4 Механизм действия дезинтоксикационных кровезаменителей основан на: адсорбировании восполнение питательной функций крови улучшение свойств крови
- 28. http://zdravalt.ru/upload/iblock/d06/797.pdf ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ ПОСТАНОВЛЕНИЕ от 22 июня 2019 г. N 797 ОБ УТВЕРЖДЕНИИ ПРАВИЛ ЗАГОТОВКИ,
- 29. Правила переливания крови: https://rg.ru/2013/08/28/donory-dok.html Приказ Министерства здравоохранения Российской Федерации (Минздрав России) от 2 апреля 2013 г.
- 30. Пробы на совместимость: https://www.mrckb.ru/files/363.pdf Приказ Минздрава РФ от 25 ноября 2002 г. № 363 "Об утверждении
- 31. 4.2. Проба на совместимость на плоскости при комнатной температуре. На пластинку наносят 2-3 капли сыворотки реципиента
- 32. 6. Биологическая проба Техника проведения биологической пробы заключается в следующем: однократно переливается 10 мл гемотрансфузионной среды
- 33. При переливании компонентов крови под наркозом о реакции или начинающихся осложнениях судят по немотивированному усилению кровоточивости
- 34. Вопрос 6. При переливании крови больным, находящимся в состоянии наркоза: пробы на совместимость проводятся в полном
- 35. Часть 2. Защитные функции крови. Неспецифический иммунитет Специфический иммунитет
- 36. Иммунитет – способ защиты организма от всех чужеродных веществ как экзогенного, так и эндогенного происхождения, несущих
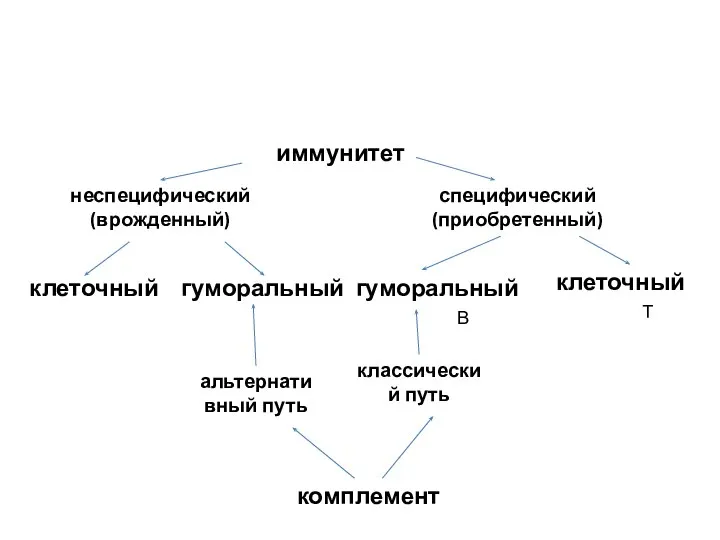
- 37. иммунитет неспецифический (врожденный) специфический (приобретенный) клеточный гуморальный гуморальный клеточный комплемент альтернативный путь классический путь В Т
- 38. Вопрос 8. Для функции иммунитета характерна защита организма от: агентов, несущих чужеродную генетическую информацию вирусных инфекций
- 39. Неспецифический иммунитет
- 40. I Неспецифический иммунитет Клеточный: обеспечивается всеми клетками способными к фагоцитозу полинуклеарные фагоциты (нейтрофилы, эозинофилы, базофилы); моноциты
- 41. 9. Клетками предшественниками макрофагов являются А) моноциты Б) нейтрофилы В) тучные клетки Г) эозинофилы 10. К
- 42. NK –клетки Относятся к лимфоидным , но при этом лишены маркеров Т- и В- клеток. Представлены
- 43. Свойства NK- клеток: не имеют антигенраспознающих рецепторов; не увеличиваются количественно после встречи с чужеродным антигеном; не
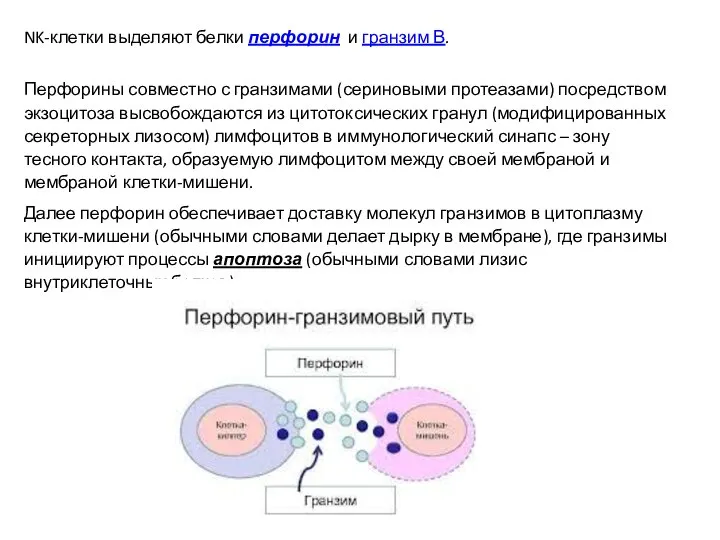
- 44. NK-клетки выделяют белки перфорин и гранзим В. Перфорины совместно с гранзимами (сериновыми протеазами) посредством экзоцитоза высвобождаются
- 45. 11. К клеточным факторам врожденной резистентности относятся А) натуральные киллеры Б) система комплемента В) иммуноглобулины Г)
- 46. Лизоцим – гидролитический фермент, разрушающий пептидогликановый слой клеточной стенки бактерий. 13 Действие лизоцима заключается в разрушении
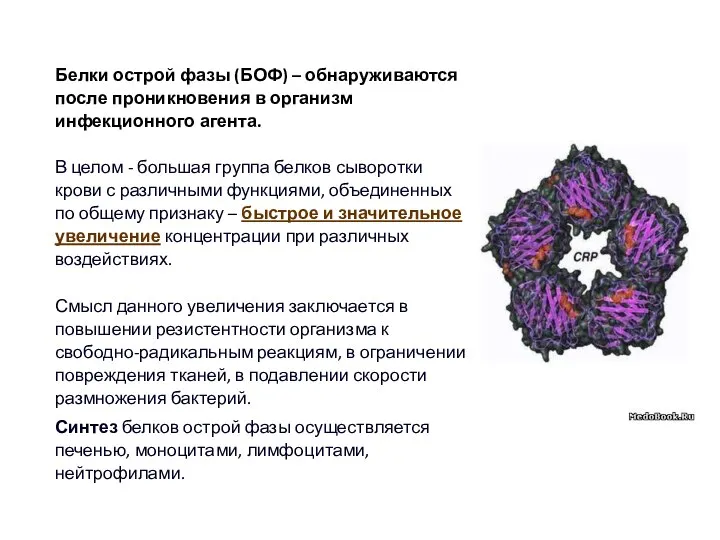
- 47. Белки острой фазы (БОФ) – обнаруживаются после проникновения в организм инфекционного агента. В целом - большая
- 49. Интерфероны (IFN) – цитокины, вырабатываемые клетками человека в ответ на вирусную инфекцию и обладающих противовирусным действием.
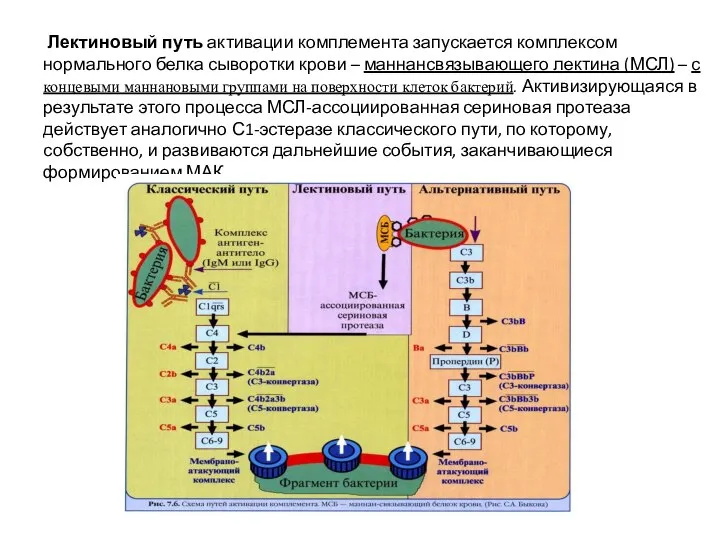
- 50. Система комплемента Комплементом называют большую группу взаимодействующих между собой белков и гликопротеинов крови, имеющихся у всех
- 51. 14. Альтернативный и лектиновый пути активации системы комплемента являются А) врожденными, относятся к неспецифическим гуморальным способам
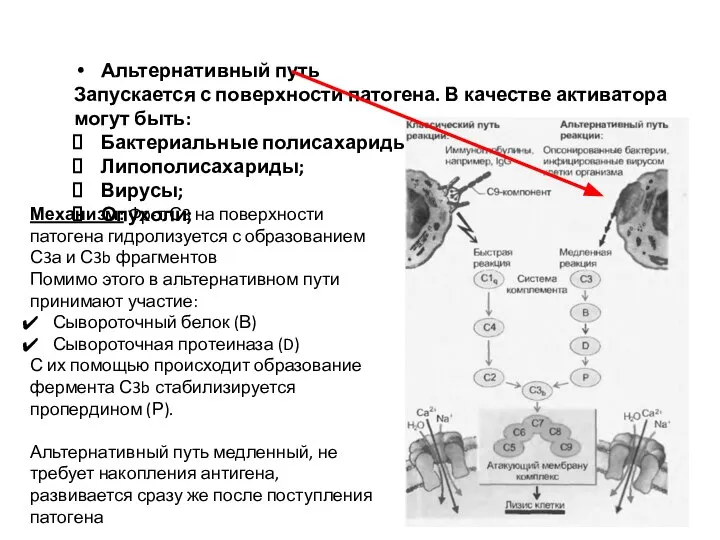
- 52. Альтернативный путь Запускается с поверхности патогена. В качестве активатора могут быть: Бактериальные полисахариды; Липополисахариды; Вирусы; Опухоли;
- 53. Лектиновый путь активации комплемента запускается комплексом нормального белка сыворотки крови – маннансвязывающего лектина (МСЛ) – с
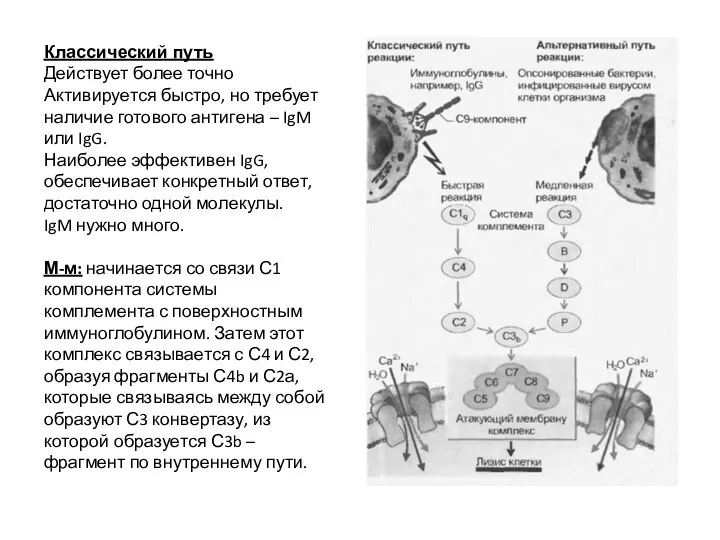
- 54. Классический путь Действует более точно Активируется быстро, но требует наличие готового антигена – IgM или IgG.
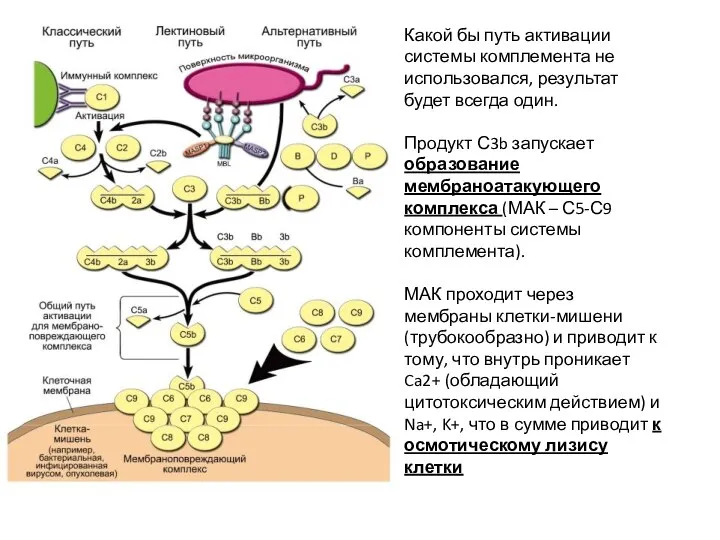
- 55. Какой бы путь активации системы комплемента не использовался, результат будет всегда один. Продукт С3b запускает образование
- 56. Вопрос 16. Конечным эффектом активации системы комплемента является А) образование мембраноатакующего комплекса Б) синтез антител В)
- 57. Специфический иммунитет
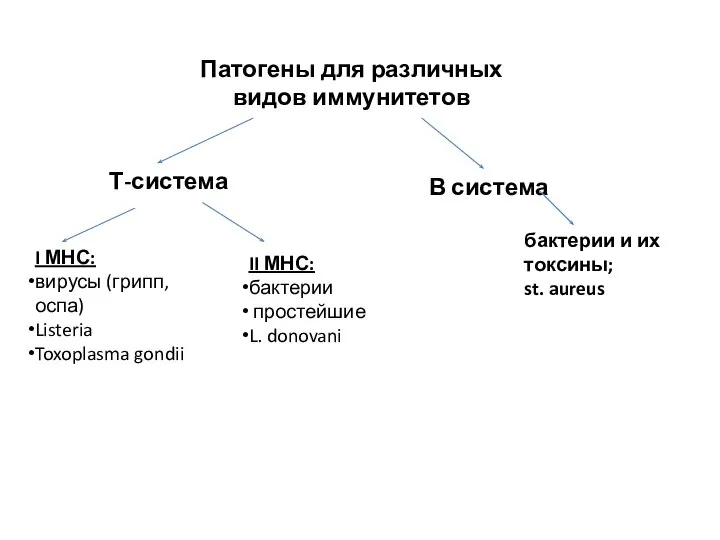
- 58. Патогены для различных видов иммунитетов Т-система В система бактерии и их токсины; st. aureus I МНС:
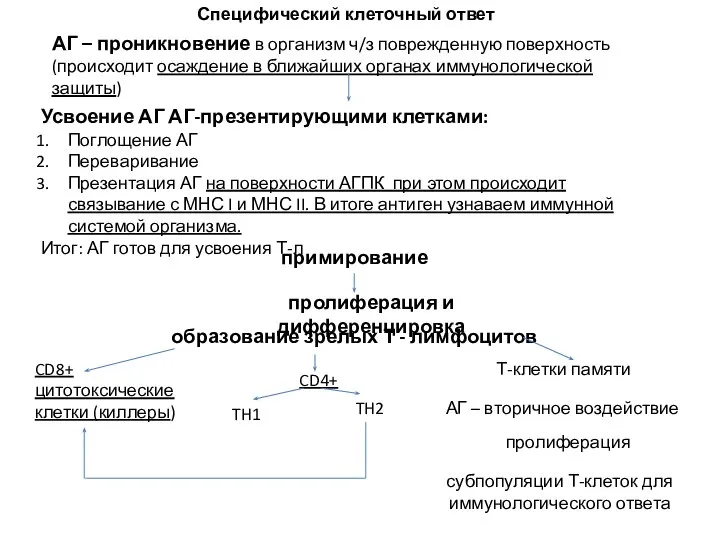
- 59. АГ – проникновение в организм ч/з поврежденную поверхность (происходит осаждение в ближайших органах иммунологической защиты) Усвоение
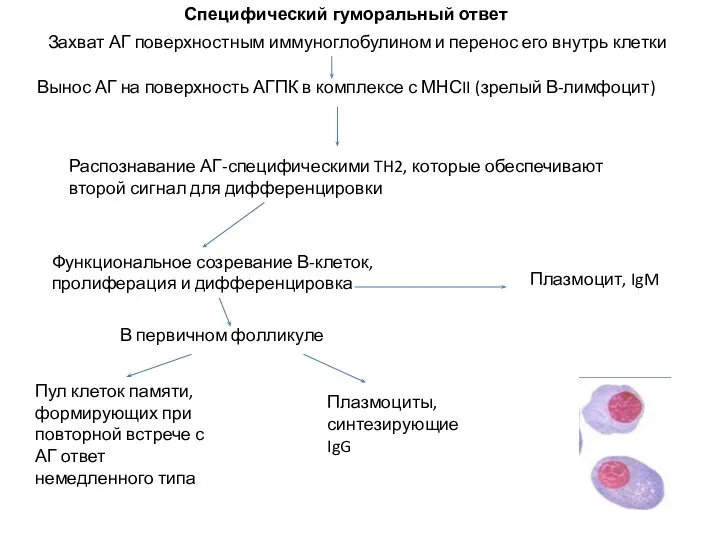
- 60. Захват АГ поверхностным иммуноглобулином и перенос его внутрь клетки Вынос АГ на поверхность АГПК в комплексе
- 61. Вопрос 19. Антитела относятся к классу: глобулинов альбуминов Липопротеинов Вопрос 20 Результатом В-клеточного ответа является: синтез
- 63. Скачать презентацию














































 Сестринский уход при бронхолегочных заболеваниях
Сестринский уход при бронхолегочных заболеваниях Шкуралиев Шовкат
Шкуралиев Шовкат Принципы организации работы ПЦР-лаборатории
Принципы организации работы ПЦР-лаборатории Синхронизация колебаний в связанных осцилляторах ФитцХью-Нагумо в ходе эпилептического приступа
Синхронизация колебаний в связанных осцилляторах ФитцХью-Нагумо в ходе эпилептического приступа Субъекты инклюзивного образования
Субъекты инклюзивного образования Повреждения, ассоциированные с переломами ДМЭ лучевой кости
Повреждения, ассоциированные с переломами ДМЭ лучевой кости Реабилитация пациентов при заболеваниях обмена веществ, в хирургии
Реабилитация пациентов при заболеваниях обмена веществ, в хирургии Fundamentals of vascular surgery
Fundamentals of vascular surgery Патология МВС
Патология МВС Внутриутробные инфекции
Внутриутробные инфекции Особенности развития детей с нарушениями слуха
Особенности развития детей с нарушениями слуха Пренатальная диагностика
Пренатальная диагностика Центральные и периферические органы иммунной защиты
Центральные и периферические органы иммунной защиты Неспецифический язвенный колит
Неспецифический язвенный колит Junctional Emergency Treatment Tool
Junctional Emergency Treatment Tool Надпеченочная желтуха
Надпеченочная желтуха Ветсансараптау әдістері
Ветсансараптау әдістері Базовые вопросы диабетологии
Базовые вопросы диабетологии Патография Фридриха Ницше (1844-1900)
Патография Фридриха Ницше (1844-1900) Prezentatsia_Po_Dif_Aognostike_23_10_2012
Prezentatsia_Po_Dif_Aognostike_23_10_2012 Гипотиреоз. Патогенезі
Гипотиреоз. Патогенезі Разбор клинических случаев
Разбор клинических случаев ақ-2 лек
ақ-2 лек Разбор клинического случая. Тактика ведения и лечения пациента с разрывом аневризмы трифуркации правой ВСА
Разбор клинического случая. Тактика ведения и лечения пациента с разрывом аневризмы трифуркации правой ВСА Рана. Раневая инфекция
Рана. Раневая инфекция Ревматизм. Этиология, патогенез
Ревматизм. Этиология, патогенез Интерпретация гравидограмм
Интерпретация гравидограмм Фармацевтикалык ондiрiс тхнологиясы
Фармацевтикалык ондiрiс тхнологиясы