Содержание
- 2. ПАЦИЕНТКА, 57 ЛЕТ( 1964 ГР.) Клинический случай Основной/Клинический диагноз: С 56. Рак яичников рТ3сN0М0, IIIС стадия
- 3. ПАЦИЕНТКА, 57 ЛЕТ В феврале 2020г. по поводу увеличения живота в объеме обследовалась по месту жительства.
- 4. ПАЦИЕНТКА, 57 ЛЕТ с 07.04.2020г. по 30.07.2020г. 6 курсов неоадъювантной химиотерапии по схеме: паклитаксел 175 мг
- 5. ПАЦИЕНТКА, 57 ЛЕТ 10-11.2020г: 2 курса адъювантной химиотерапии по схеме: паклитаксел 175 мг / м2 в
- 6. ПАЦИЕНТКА, 57 ЛЕТ Решением консилиума от 23.12.2020г: пациентке рекомендовано лечение препаратом Линпарза® (олапариб) по 400 мг
- 7. Вопрос №1 Какие нежелательные явления чаше ожидаются при приеме олапариба? 1. тошнота/рвота, усталость, анемия. 2. полинейропатии,
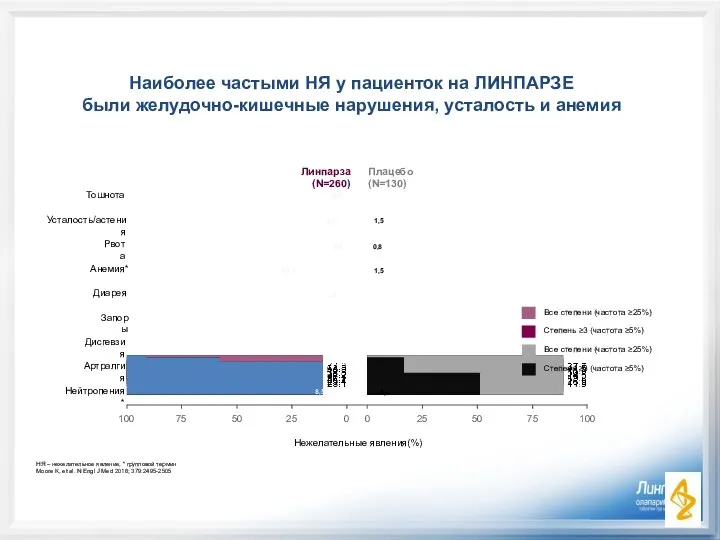
- 8. Наиболее частыми НЯ у пациенток на ЛИНПАРЗЕ были желудочно-кишечные нарушения, усталость и анемия Линпарза (N=260) Плацебо
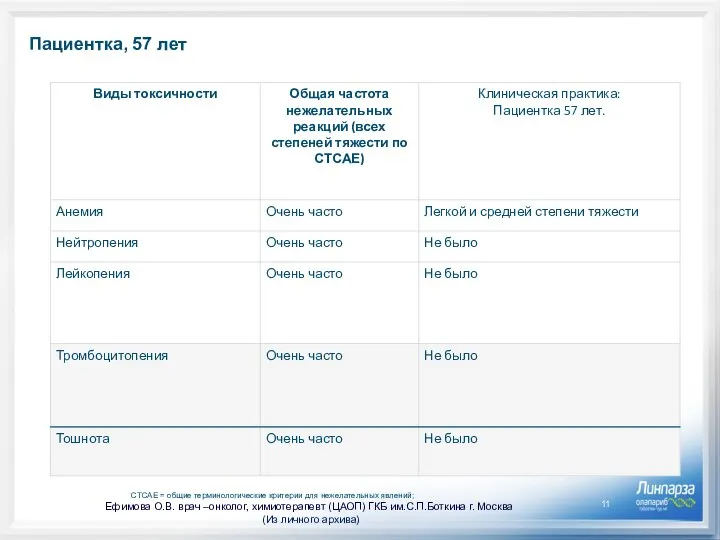
- 9. ПАЦИЕНТКА, 57 ЛЕТ Нежелательные явления: Первые 3 месяца лечение переносила с гематологической токсичностью в виде анемии
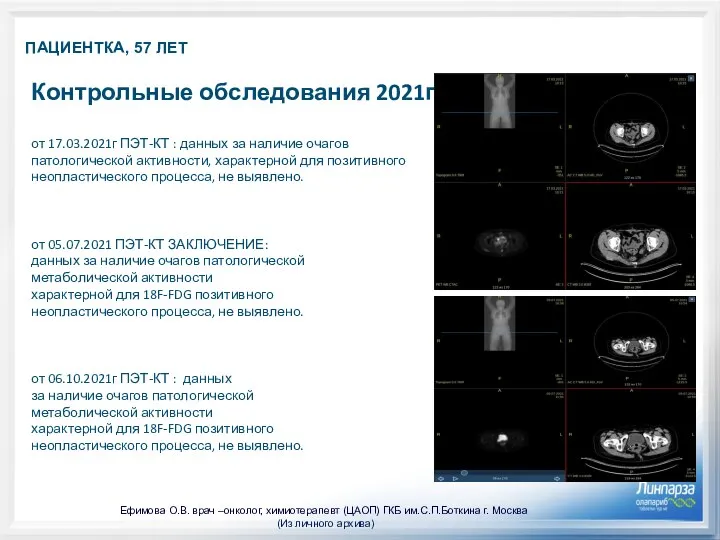
- 10. ПАЦИЕНТКА, 57 ЛЕТ Контрольные обследования 2021год: от 17.03.2021г ПЭТ-КТ : данных за наличие очагов патологической активности,
- 11. Пациентка, 57 лет Ефимова О.В. врач –онколог, химиотерапевт (ЦАОП) ГКБ им.С.П.Боткина г. Москва (Из личного архива)
- 12. Выводы по клиническому случаю Пациентка, 41 год Ефимова О.В. врач –онколог, химиотерапевт (ЦАОП1) ГКБ им.С.П.Боткина г.
- 13. Вопрос №2 Насколько в % снижается риск прогрессирования или смерти при приеме Линпарзы в 1-ой линии
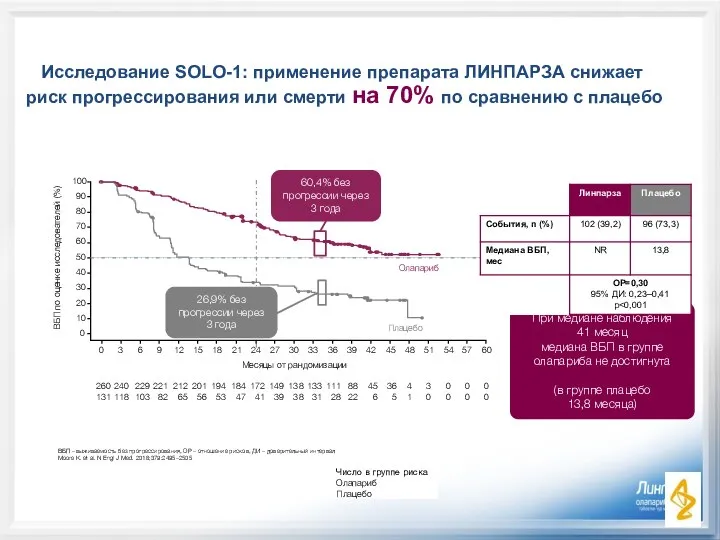
- 14. Исследование SOLO-1: применение препарата ЛИНПАРЗА снижает риск прогрессирования или смерти на 70% по сравнению с плацебо
- 16. Скачать презентацию









 Особенности общения у старших дошкольников с ДЦП
Особенности общения у старших дошкольников с ДЦП Клинико-эпидемиологическая характеристика бруцеллеза на современном этапе. Вопросы терапии
Клинико-эпидемиологическая характеристика бруцеллеза на современном этапе. Вопросы терапии Скелет верхних и нижних конечностей 2021
Скелет верхних и нижних конечностей 2021 Addiction to drugs is becoming more and more common every day. Drugs among the young people is a problem which affects the whole society and future generations. - презентация_
Addiction to drugs is becoming more and more common every day. Drugs among the young people is a problem which affects the whole society and future generations. - презентация_ Анализ работы по выдаче эВСД системы Меркурий
Анализ работы по выдаче эВСД системы Меркурий Лечение депрессивных расстройств
Лечение депрессивных расстройств Взятие мокроты на исследования
Взятие мокроты на исследования Профилактические осмотры женского населения
Профилактические осмотры женского населения Пищевые отравления
Пищевые отравления Профилактика туберкулеза в современном обществе
Профилактика туберкулеза в современном обществе Діагностика та вибір адекватної корекції стану організму
Діагностика та вибір адекватної корекції стану організму Вред и польза соли Учебный проект
Вред и польза соли Учебный проект История развития психопатологии в зарубежный странах
История развития психопатологии в зарубежный странах Сестринская помощь при острых инфекциях лор-органов
Сестринская помощь при острых инфекциях лор-органов Организация прививочной работы в организованных коллективах
Организация прививочной работы в организованных коллективах Онкологиядағы шұғыл жағдайлар
Онкологиядағы шұғыл жағдайлар Электролечение и магнитотерапия
Электролечение и магнитотерапия Заболевание глаз
Заболевание глаз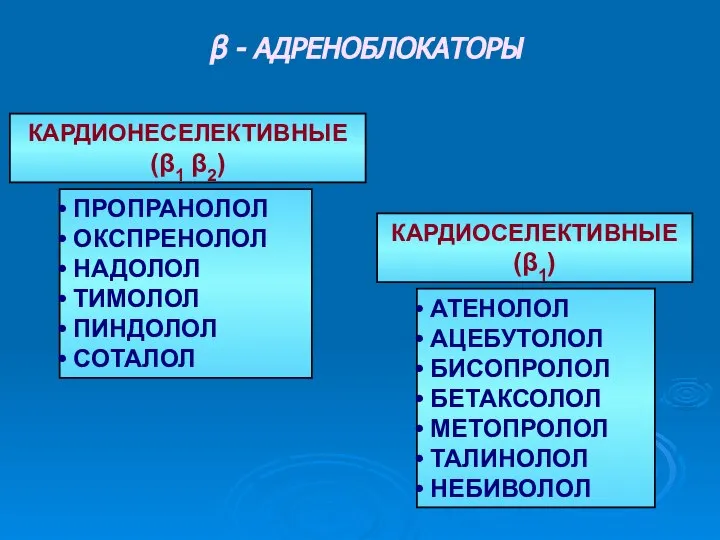 β - адреноблокаторы
β - адреноблокаторы Курс лекций по сенсорной интеграции. Лекция 6. Вестибулярная система
Курс лекций по сенсорной интеграции. Лекция 6. Вестибулярная система Адреногенитальный синдром
Адреногенитальный синдром rean
rean Организация санитарно-гигиенического режима на стоматологическом приеме. Занятие 2
Организация санитарно-гигиенического режима на стоматологическом приеме. Занятие 2 Корреляциялык анализ
Корреляциялык анализ Современные принципы организации акушерско-гинекологической помощи
Современные принципы организации акушерско-гинекологической помощи Основы трансторакальной эхокардиографии
Основы трансторакальной эхокардиографии Экономическое обоснование выплат стимулирующего характера и критерии оценки эффективности труда медицинского персонала
Экономическое обоснование выплат стимулирующего характера и критерии оценки эффективности труда медицинского персонала Газоотведение. Введение свечей в прямую кишку
Газоотведение. Введение свечей в прямую кишку