Содержание
- 2. COДЕРЖАНИЕ 1.Значение регуляции для иммунных процессов 2.Внутрисистемная регуляция иммунных процессов 3.Печёночная и нейро-эндокринная регуляция 4.Генетическая регуляция
- 3. Иммунные ответы - хорошо регулируемый процесс. Регуляция имеет большое значение для: 1) обеспечения нужного уровня специфичности
- 4. ВНУТРИСИСТЕМНЫЕ МЕХАНИЗМЫ Механизм отрицательной обратной связи Идиотип-антиидиотипические и эрготип-антиэрготипические взаимодействия Цитокины и костимулирующие молекулы Естественные регуляторные
- 5. ПРИНЦИП ОТРИЦАТЕЛЬНОЙ ОБРАТНОЙ СВЯЗИ ПАССИВНЫЙ МЕХАНИЗМ СУПРЕССИИ ИММУННЫХ ОТВЕТОВ Выработка высокоспецифических эффекторных Т-лимфоцитов и иммуноглобулинов приводит
- 7. ПРИНЦИП ОТРИЦАТЕЛЬНОЙ ОБРАТНОЙ СВЯЗИ АКТИВНЫЙ МЕХАНИЗМ СУПРЕССИИ ИММУННЫХ ОТВЕТОВ В эксперименте при одновременном введении животному антигена
- 8. ИДИОТИП-АНТИИДИОТИПИЧЕСКИЕ МОЛЕКУЛЫ Любая антигенспецифическая молекула имеет уникальную конформацию своего антиген-связывающего сайта, который комплементарен структуре антигена. Этот
- 9. Идиотип-антиидиотипические молекулы как рецепторы могут в свою очередь сами распознавать либо связывающие сайты и их части,
- 10. НОБЕЛЕВСКАЯ ПРЕМИЯ (1984) N.K. JERNE Теории иммунитета (клоны лимфоцитов, идиотипические сети)
- 11. ЭРГОТИП- АНТИЭРГОТИПИЧЕСКИЕ ОТВЕТЫ По аналогии с идиотип-антиидиотипическими взаимодействиями на другие рецепторные молекулы (эрготипы, например СD3, CD4,
- 12. РОЛЬ КОСТИМУЛИРУЮЩИХ МОЛЕКУЛ Сигнал с TCR является важнейшим, но не единственным для активации Т-лимфоцитов. Концепция о
- 13. Особенности костимулирующих молекул Одна из пары молекул представлена на Т-лимфоците, другая – на АПК. Чаще сигнал
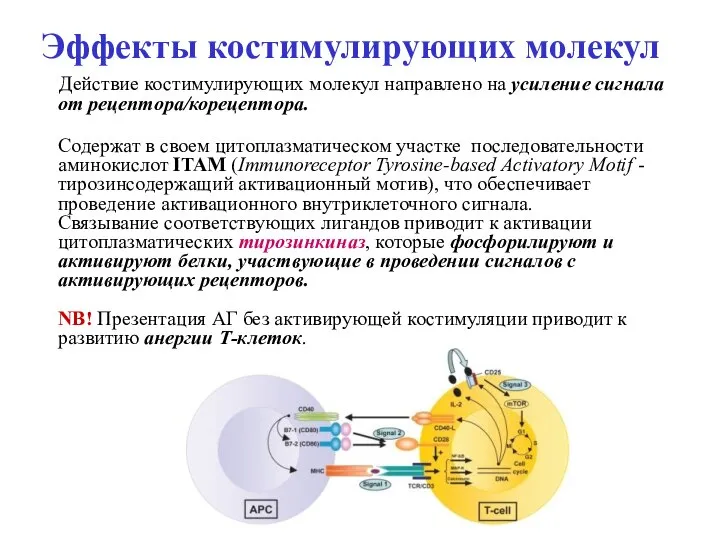
- 14. Эффекты костимулирующих молекул Действие костимулирующих молекул направлено на усиление сигнала от рецептора/корецептора. Содержат в своем цитоплазматическом
- 15. CD28-CD80/CD86 CD28 спонтанно экспрессируется на большинстве Т-лимфоцитов (80%). CD80 (B7-1) не экспрессируется, СD86 (B7-2) - слабо
- 16. СD40-CD40L (CD154) CD40 конститутивно экспрессируется на АПК (В-лф, ДК, МФ). CD40L экпрессируют активированные Т-клетки, а также
- 17. ICOSL-ICOS ICOS (Inducible costimulator- индуцибельный костимулятор) –экспрессируется на Т-клетках, активированных через TCR и CD28. ICOSL- экпрессируется
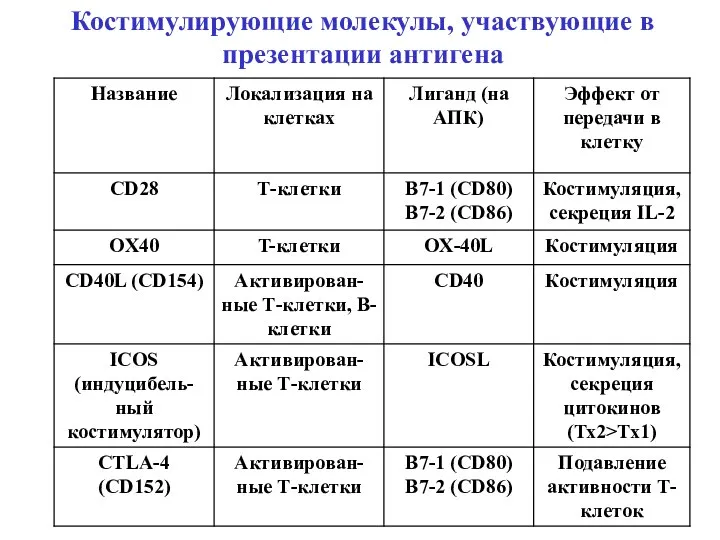
- 18. Костимулирующие молекулы, участвующие в презентации антигена
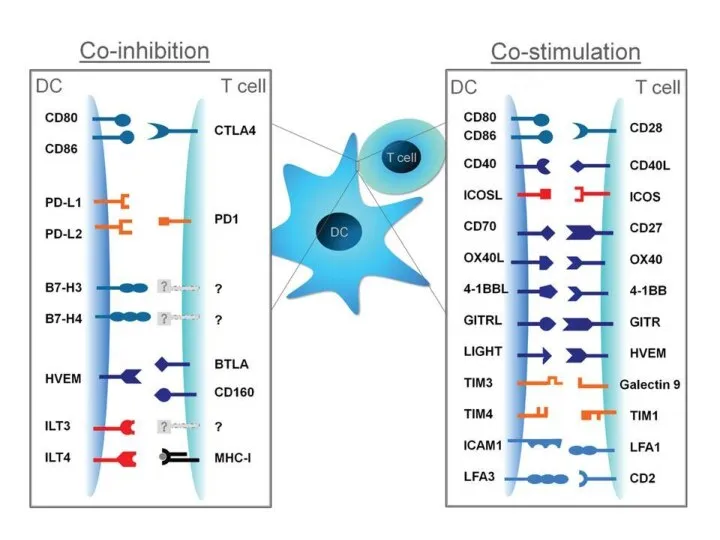
- 20. Коингибиторные рецепторы Известно более 20 мембранных молекул, способных подавлять активацию клеток, вызванную через другие рецепторы. В
- 21. CTLA-4 -CD80/CD86 CTLA-4 (CD152)- гомолог молекулы CD28, связывается с лигандами (CD80/CD86) с большей аффинностью. Экспрессируется на
- 22. PD1- PD-L1, PD-L2 PD1(Programed cell death-1- запрограммированная смерть клетки) – гомолог молекулы CD28. PD1 экспрессируется на
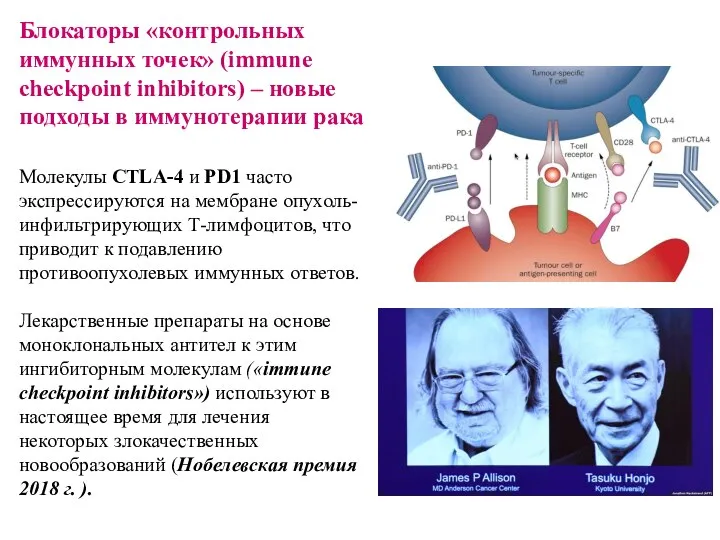
- 23. Блокаторы «контрольных иммунных точек» (immune checkpoint inhibitors) – новые подходы в иммунотерапии рака Молекулы CTLA-4 и
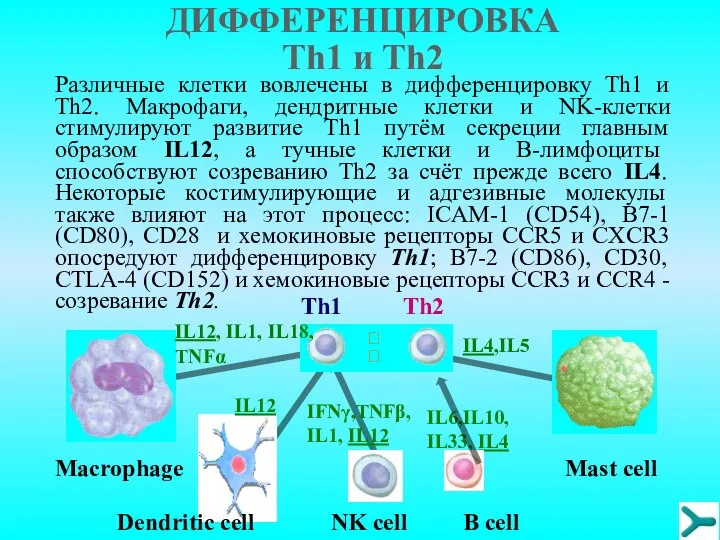
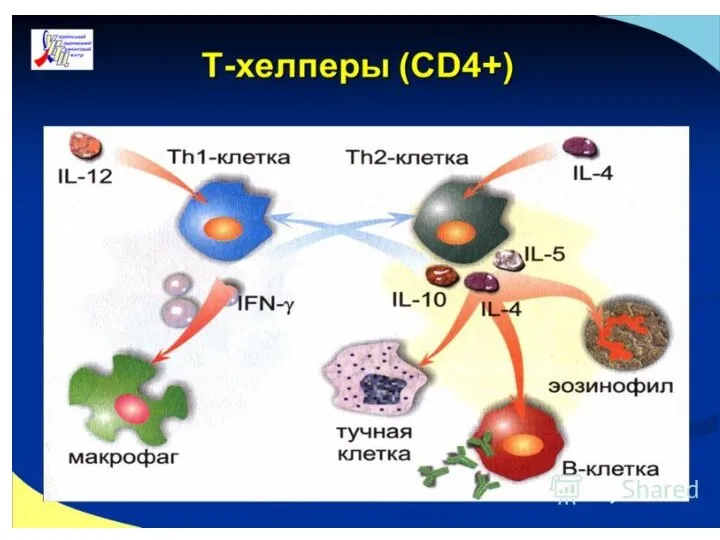
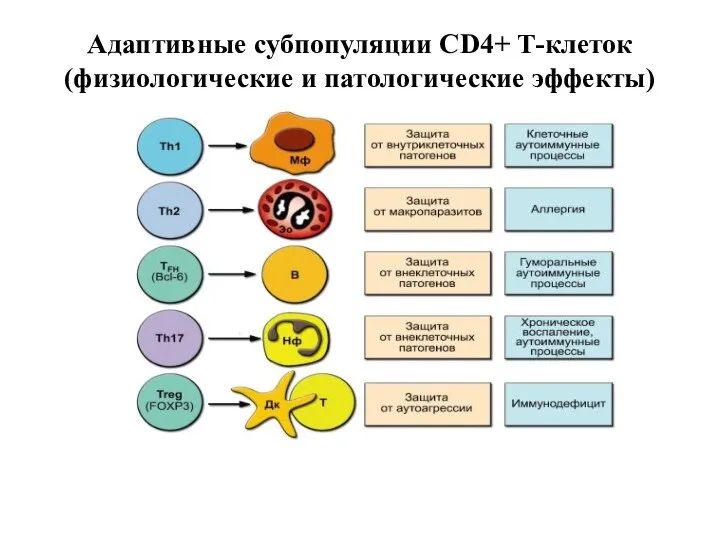
- 24. Адаптивные регуляторные клетки, T-хелпер 1 и T-хелпер 2, идентифицируются, главным образом, по панели цитокинов, которые они
- 25. Различные клетки вовлечены в дифференцировку Тh1 и Тh2. Макрофаги, дендритные клетки и NK-клетки стимулируют развитие Тh1
- 26. На физиологическом уровне, Тh1 включают T-клеточный иммунный ответ и участвуют в переключении синтеза антител; наоборот, Th2
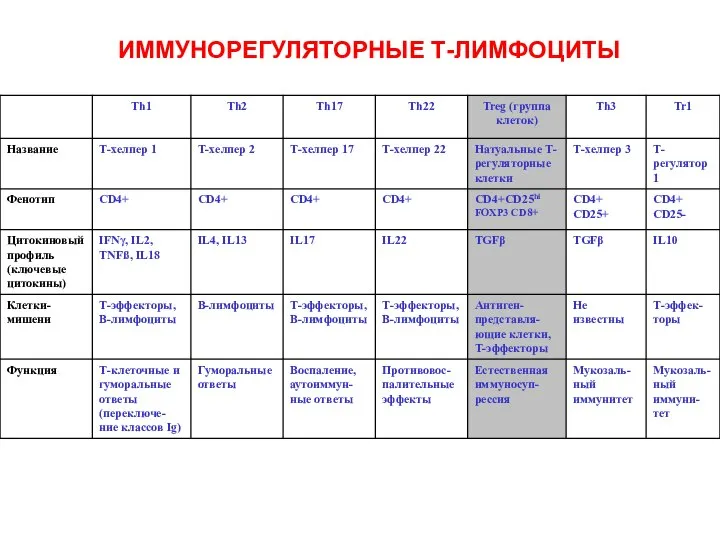
- 28. ИММУНОРЕГУЛЯТОРНЫЕ Т-ЛИМФОЦИТЫ
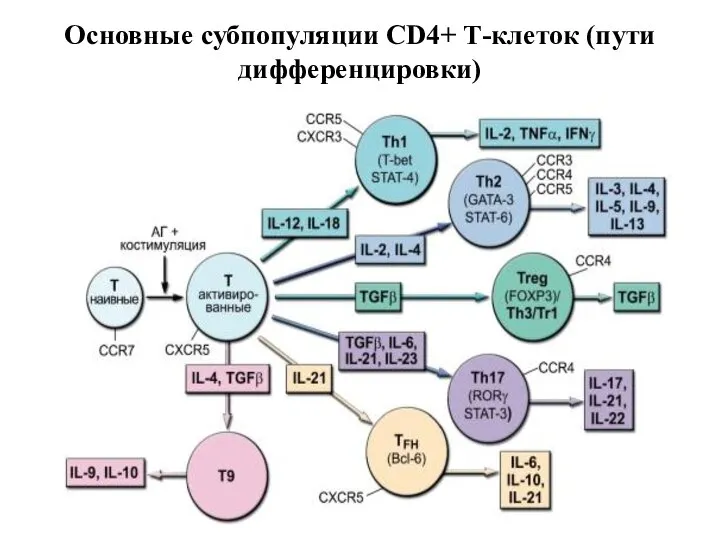
- 29. Основные субпопуляции CD4+ Т-клеток (пути дифференцировки)
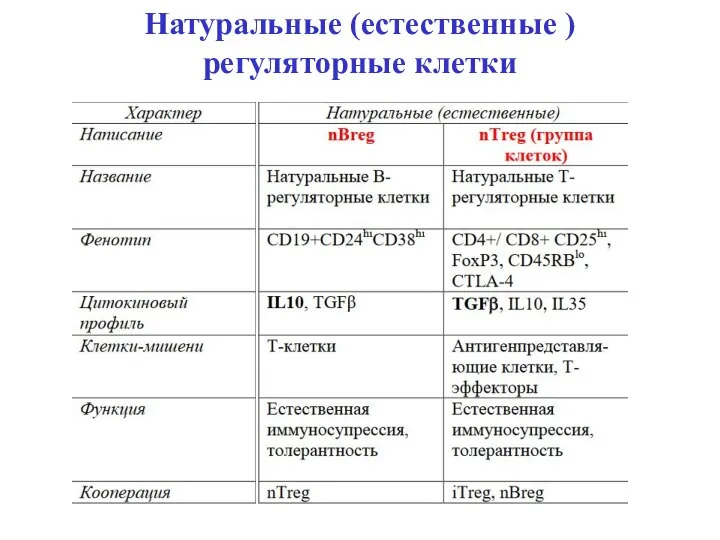
- 30. Натуральные и адаптивные регуляторные Т-клетки (Тreg) Натуральные регуляторные Т-клетки (Тreg) – это группа клеток с фенотипами
- 31. Натуральные (естественные ) регуляторные клетки Климов В.В. Климов В.В.
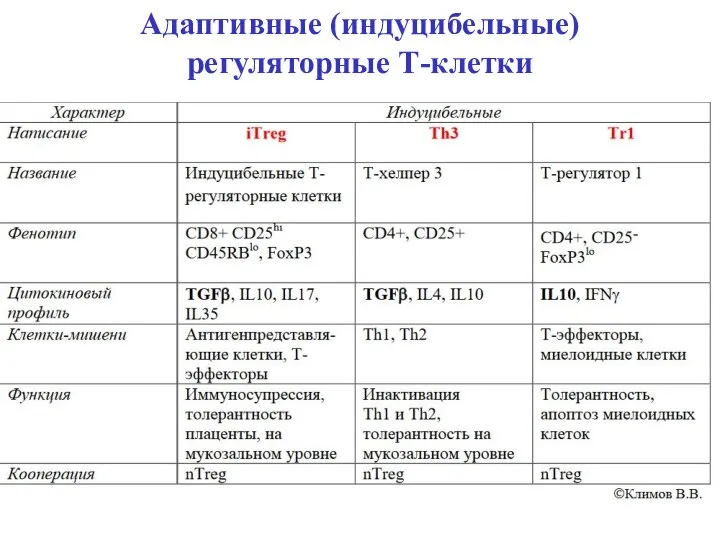
- 32. Адаптивные (индуцибельные) регуляторные Т-клетки
- 33. ЦИТОКИНОВАЯ РЕГУЛЯЦИЯ Цитокины, небольшие секретируемые белки с молекулярной массой 15-40 кДа, оказывают в гормональных концентрациях через
- 34. Системные (провоспалительные) цитокины: IL1, IL6, TNFα/β Проиммуногенный (провоспалительный) профиль: IL5, IL8, IL12, IL17A-F, IL18, IL19, IL20,
- 35. ЦИТОКИНОВЫЕ ПРОФИЛИ регуляторных лимфоцитов Th1 (CD4+) ? IFNγ, IL2, TNFβ, IL18 Th2 (CD4+) ? IL4, IL5,
- 36. Адаптивные субпопуляции CD4+ Т-клеток (физиологические и патологические эффекты)
- 37. ПЕЧЁНОЧНАЯ РЕГУЛЯЦИЯ Печень является главной “биохимической лабораторией”, которая обеспечивает общую метаболическую регуляцию гомеостаза. Почти все клеточные
- 38. Здоровая печень – иммунологически толерогенный орган Толерогенный режим поддерживают: клетки Купфера, печеночные макрофаги, дендритные клетки, миелоидные
- 39. ЭНДОКРИННАЯ РЕГУЛЯЦИЯ Гормональная регуляция, в упрощённой интерпретации, включает стимулирующее влияние на иммунные процессы соматотропина, ТТГ, трийодтиронина,
- 40. Эффекты глюкокортикоидов В физиологических концентрациях: - регулируют позитивную и негативную селекцию лимфоцитов в ходе лимфопоэза; -
- 41. РЕГУЛЯЦИЯ СО СТОРОНЫ ЦНС Центральная нервная система обеспечивает общую координацию иммунных процессов. Имеется по крайней мере
- 42. РОЛЬ НЕЙРОТРОПИНОВ В ИММУНОРЕГУЛЯЦИИ Нейротропины — семейство структурно связанных факторов роста, регулирующих выживание и функционирование различных
- 43. Нужный уровень специфичности по отношению к исходному антигену. Нужный уровень силы иммунных ответов. Необходимая специфичность достигается:
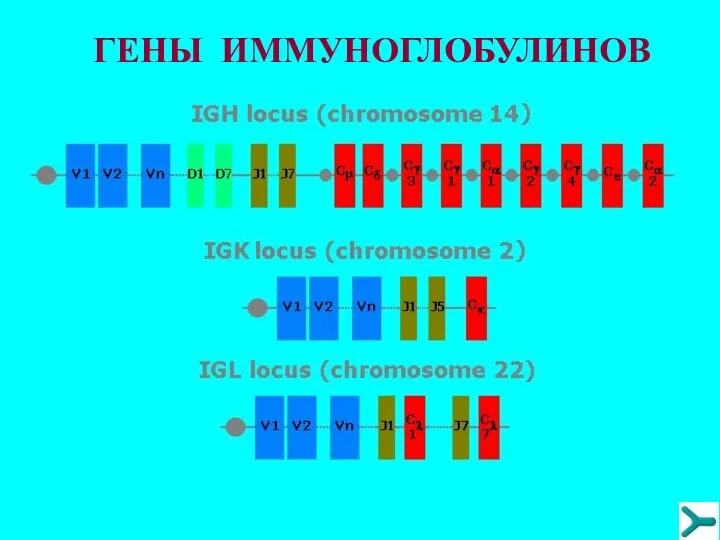
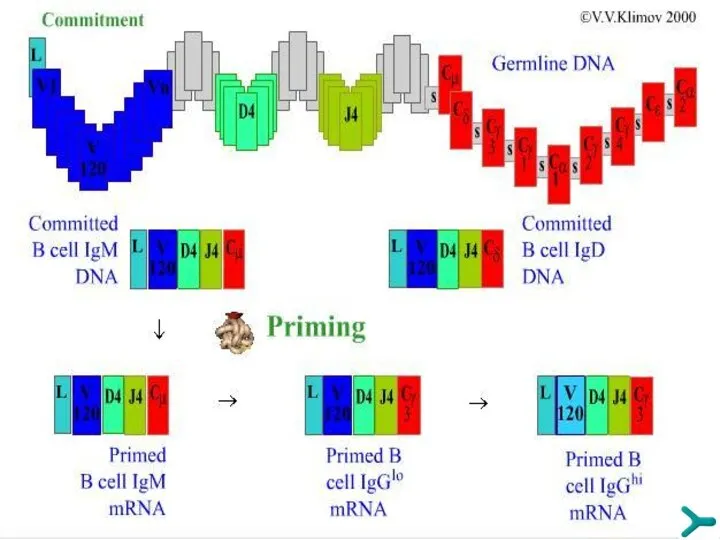
- 44. Гены иммуноглобулинов Количество наследуемого от родителей генетического материала (ДНК), определяющего биосинтез антител - около 120 структурных
- 45. Синтез Н-цепей иммуноглобулинов Рекомбинацию ДНК генов иммуноглобулинов (и генов TCR в T-лимфоцитах) катализируют специальные ферменты -
- 46. ГЕНЫ ИММУНОГЛОБУЛИНОВ
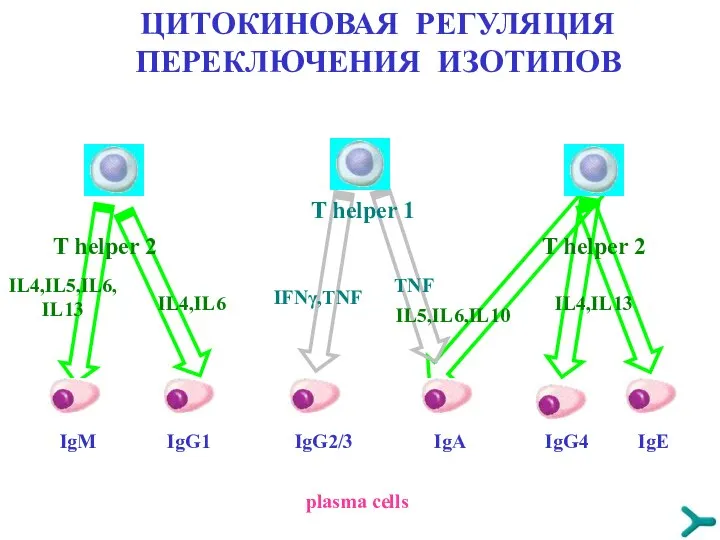
- 48. ЦИТОКИНОВАЯ РЕГУЛЯЦИЯ ПЕРЕКЛЮЧЕНИЯ ИЗОТИПОВ IgM IgG1 IgG2/3 IgA IgG4 IgE T helper 1 plasma cells IL4,IL5,IL6,IL13
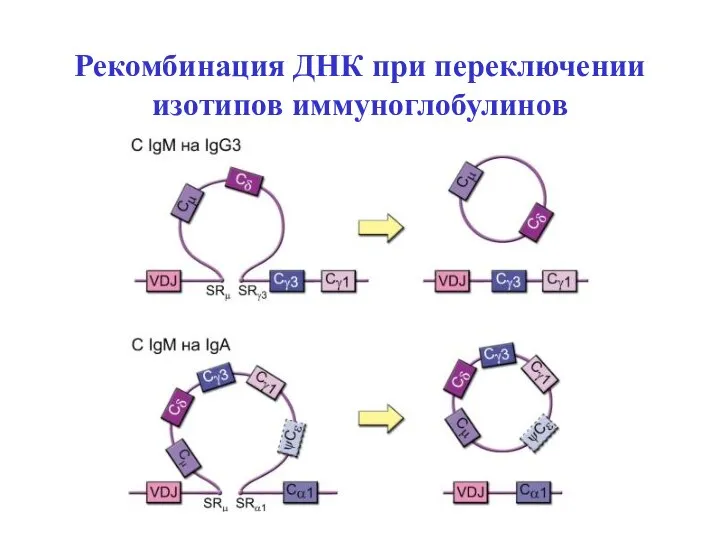
- 49. Рекомбинация ДНК при переключении изотипов иммуноглобулинов
- 50. Механизмы формирования разнообразия генов V-участков иммуноглобулинов и TCR Формирование разнообразия генов для миллионов вариантов V-участков молекул
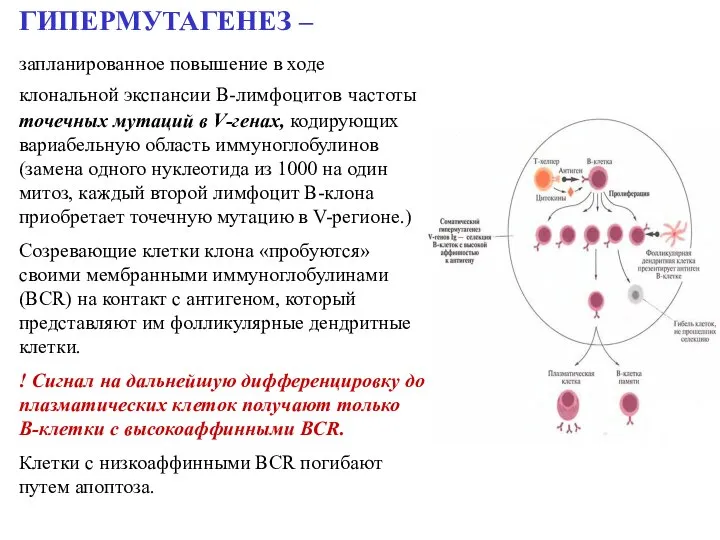
- 51. ГИПЕРМУТАГЕНЕЗ – запланированное повышение в ходе клональной экспансии В-лимфоцитов частоты точечных мутаций в V-генах, кодирующих вариабельную
- 52. НОБЕЛЕВСКАЯ ПРЕМИЯ (1987) S. TONEGAWA Открытие генетического принципа генерации разнообразия антител
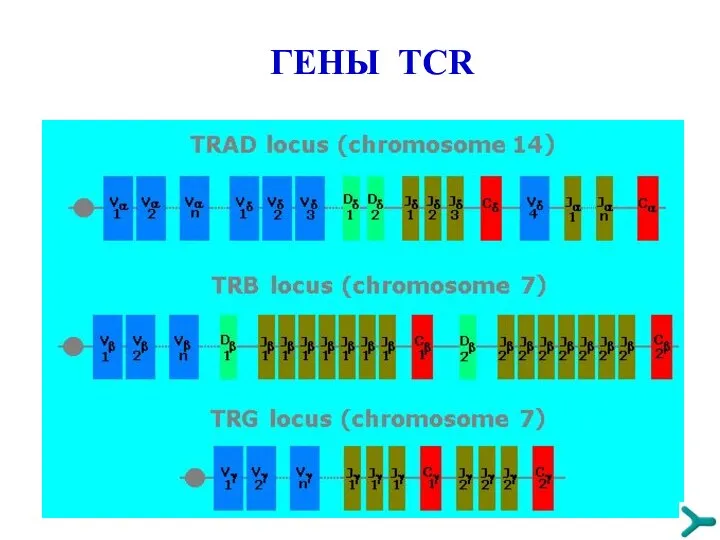
- 53. ГЕНЫ TCR
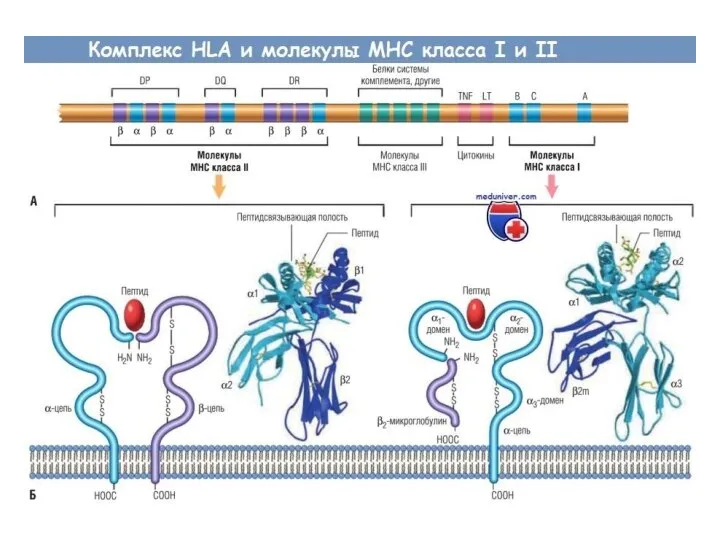
- 54. Желобок отдельной молекулы HLA у конкретного индивидума может загружать различные антигены с разной эффективностью. Поэтому в
- 56. Генетический полиморфизм МНС Каждый человек наследует определенный набор генов МНС (один на всю жизнь!) Гены МНС
- 58. Скачать презентацию





































 Эстетико-технологический процесс комплексного салонного ухода за различными типами кожи с использованием химических пилингов
Эстетико-технологический процесс комплексного салонного ухода за различными типами кожи с использованием химических пилингов Биогенные стимуляторы
Биогенные стимуляторы Интерактивная Акция Стопвичспид
Интерактивная Акция Стопвичспид Неречевая симптоматика
Неречевая симптоматика Организация мероприятий медицинской помощи в очагах чумы
Организация мероприятий медицинской помощи в очагах чумы Основные неврологиеские нарушения
Основные неврологиеские нарушения Иммунопатология. Компенсаторные и приспособительные процессы. Кафедра патологической анатомии
Иммунопатология. Компенсаторные и приспособительные процессы. Кафедра патологической анатомии Зарядка для глаз
Зарядка для глаз Механизмы развития гипотермии
Механизмы развития гипотермии Кандидамикоз (кандидоз)
Кандидамикоз (кандидоз) Здоровье лиц пожилого и старческого возраста. Лекция 2
Здоровье лиц пожилого и старческого возраста. Лекция 2 Principles of external fixators
Principles of external fixators Тератобластомы. Опухоль
Тератобластомы. Опухоль Черепно-мозговая травма, позвоночно-спинномозговая травма
Черепно-мозговая травма, позвоночно-спинномозговая травма Профилактика наследственных болезней
Профилактика наследственных болезней Багульник болотный
Багульник болотный Эпилепсия
Эпилепсия МРЦ общее, отчет о работе. ГБУЗ Научно-практический клинический центр диагностики и телемедицинских технологий ДЗМ
МРЦ общее, отчет о работе. ГБУЗ Научно-практический клинический центр диагностики и телемедицинских технологий ДЗМ Функциональная недостаточность кишечника
Функциональная недостаточность кишечника Дорога к здоровью
Дорога к здоровью Рациональное питание (витамины и микроэлементы)
Рациональное питание (витамины и микроэлементы) Ядерная медицина. Сферы применения ядерной медицины
Ядерная медицина. Сферы применения ядерной медицины Научные и практические основы сознания Кришны
Научные и практические основы сознания Кришны Естественное вскармливание
Естественное вскармливание Дислипидемия у детей с синдромом системной воспалительной реакции
Дислипидемия у детей с синдромом системной воспалительной реакции История развития микрососудистой хирургии
История развития микрососудистой хирургии Старославянские методы оздоровления
Старославянские методы оздоровления Неотложная лучевая диагностика при острых состояниях в брюшной полости
Неотложная лучевая диагностика при острых состояниях в брюшной полости