Содержание
- 2. НОРМАТИВНЫЕ ССЫЛКИ Федеральный закон №157-ФЗ от 17.17.1998 «Об иммунопрофилактике инфекционных болезней»; Федеральный закон №323-ФЗ от 21.11.2011
- 3. НОРМАТИВНЫЕ ССЫЛКИ постановление Главного государственного санитарного врача Российской Федерации от 03.12.2020 № 41 «Об утверждении санитарно-
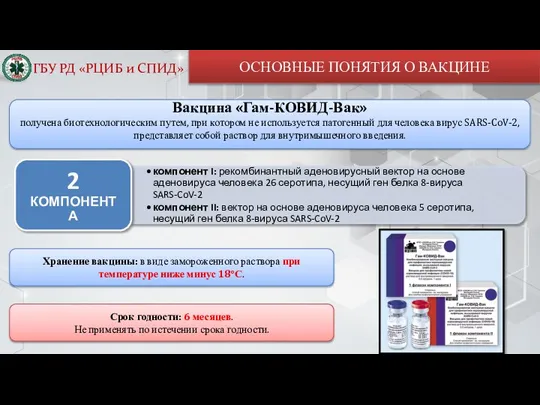
- 4. ОСНОВНЫЕ ПОНЯТИЯ О ВАКЦИНЕ Вакцина «Гам-КОВИД-Вак» получена биотехнологическим путем, при котором не используется патогенный для человека
- 5. СОП №1 ХРАНЕНИЕ И ПЕРЕВОЗКА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ COVID-19 ГБУ РД «РЦИБ и СПИД» СТАНДАРТНАЯ ОПЕРАЦИОННАЯ
- 6. Порядок приема, разгрузки и хранения вакцины «Гам-КОВИД- Вак» в медицинской организации 1) Разгрузка и подготовка персонала
- 7. Порядок приема, разгрузки и хранения вакцины «Гам-КОВИД- Вак» в медицинской организации 2) Приемка ИЛП ГБУ РД
- 8. Порядок приема, разгрузки и хранения вакцины «Гам-КОВИД- Вак» в медицинской организации 3) Хранение ИЛП ГБУ РД
- 9. Порядок приема, разгрузки и хранения вакцины «Гам-КОВИД- Вак» в медицинской организации 4) Транспортировка ИЛП ГБУ РД
- 10. Распоряжение/приказ о назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП ГБУ РД «РЦИБ и
- 11. Распоряжение/приказ о назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП ГБУ РД «РЦИБ и
- 12. Список допущенных сотрудников Лист распределения документа СМК ГБУ РД «РЦИБ и СПИД» Список сотрудников, допущенных к
- 13. Журнал учета движения ИЛП ГБУ РД «РЦИБ и СПИД» Образцы подписей сотрудников Журнал Журнал учета движения
- 14. СОП №2 ПОРЯДОК ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ПРОТИВ COVID-19 ВЗР. НАСЕЛЕНИЮ ГБУ РД «РЦИБ и СПИД» СТАНДАРТНАЯ ОПЕРАЦИОННАЯ
- 15. МЕСТО ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ГБУ РД «РЦИБ и СПИД» Вакцинация проводится в прививочном кабинете, который должен быть
- 16. МЕСТО ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ГБУ РД «РЦИБ и СПИД» Оснащение прививочного кабинета
- 17. СПОСОБ ПРИМЕНЕНИЯ ВАКЦИНЫ И ДОЗЫ ГБУ РД «РЦИБ и СПИД» Варианты выпуска препарата: однодозовый (0,5 мл/доза
- 18. СПОСОБ ПРИМЕНЕНИЯ ВАКЦИНЫ И ДОЗЫ ГБУ РД «РЦИБ и СПИД» Вакцинацию проводят в два этапа: Компонентом
- 19. Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых (вакцина «Гам-Ковид-Вак») ГБУ
- 20. Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых (вакцина «Гам-Ковид-Вак») ГБУ
- 21. Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых (вакцина «Гам-Ковид-Вак») ГБУ
- 22. Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых (вакцина «Гам-Ковид-Вак») ГБУ
- 23. Приложение №2 АНКЕТА ПАЦИЕНТА ГБУ РД «РЦИБ и СПИД»
- 24. Приложение №3 Памятка пациента о проведении вакцинации против COVID-19 ГБУ РД «РЦИБ и СПИД» Уважаемый пациент!
- 25. Приложение №4 Осмотр врача перед вакцинацией от COVID-19 ГБУ РД «РЦИБ и СПИД»
- 26. ФАРМАКОНАДЗОР ГБУ РД «РЦИБ и СПИД» Вакцина «Гам-Ковид-Вак» зарегистрирована по особой процедуре регистрации, в связи, с
- 27. Дополнительно ГБУ РД «РЦИБ и СПИД»
- 29. Скачать презентацию
Слайд 2НОРМАТИВНЫЕ ССЫЛКИ
Федеральный закон №157-ФЗ от 17.17.1998 «Об иммунопрофилактике инфекционных болезней»;
Федеральный закон №323-ФЗ
НОРМАТИВНЫЕ ССЫЛКИ
Федеральный закон №157-ФЗ от 17.17.1998 «Об иммунопрофилактике инфекционных болезней»;
Федеральный закон №323-ФЗ

Федеральный закон №61-ФЗ от 12.04.2010 «Об обращении лекарственных средств»;
Постановление Правительства РФ №291 от 16.04.2012 «О лицензировании медицинской деятельности (за исключением указанной деятельности, осуществляемой медицинскими организациями и другими организациями, входящими в частную систему здравоохранения, на территории инновационного центра «Сколково»)»;
приказ Минздравсоцразвития России от 15.05.2012 № 543 «Об утверждении Положения об организации оказания первичной медико-санитарной помощи взрослому населению»;
постановление Правительства РФ от 31 марта 2020 г. № 373 «Об утверждении Временных правил учета информации в целях предотвращения распространения новой коронавирусной инфекции (COVID-19)»;
ГБУ РД «РЦИБ и СПИД»
Слайд 3НОРМАТИВНЫЕ ССЫЛКИ
постановление Главного государственного санитарного врача Российской Федерации от 03.12.2020 № 41
НОРМАТИВНЫЕ ССЫЛКИ
постановление Главного государственного санитарного врача Российской Федерации от 03.12.2020 № 41

постановление Главного государственного санитарного врача Российской Федерации от 03.03.2008 № 15 «Об утверждении санитарно- эпидемиологических правил СП 3.3.2342-08» (вместе с «СП 3.3.2342-08. Обеспечение безопасности иммунизации. Санитарно-эпидемиологические правила»);
Приказ Росздравнадзора от 15.02.2017 № 1071 «Об утверждении Порядка осуществления фармаконадзора»;
«Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации", утвержденные Минздравом России 12.04.2019.
ГБУ РД «РЦИБ и СПИД»
Слайд 4ОСНОВНЫЕ ПОНЯТИЯ О ВАКЦИНЕ
Вакцина «Гам-КОВИД-Вак»
получена биотехнологическим путем, при котором не используется
ОСНОВНЫЕ ПОНЯТИЯ О ВАКЦИНЕ
Вакцина «Гам-КОВИД-Вак»
получена биотехнологическим путем, при котором не используется
ГБУ РД «РЦИБ и СПИД»
Срок годности: 6 месяцев.
Не применять по истечении срока годности.
Хранение вакцины: в виде замороженного раствора при температуре ниже минус 18°С.
Слайд 5СОП №1
ХРАНЕНИЕ И ПЕРЕВОЗКА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ COVID-19
ГБУ РД «РЦИБ и СПИД»
СТАНДАРТНАЯ
СОП №1
ХРАНЕНИЕ И ПЕРЕВОЗКА ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ COVID-19
ГБУ РД «РЦИБ и СПИД»
СТАНДАРТНАЯ

«ХРАНЕНИЕ И ПЕРЕВОЗКА (ТРАНСПОРТИРОВАНИЕ) ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ В МЕДИЦИНСКОЙ ОРГАНИЗАЦИИ»
СМК-СОП-№ ____
УТВЕРЖДАЮ
Руководитель юридического лица
_______________________________Ф. И. О.
«___» ________________ 20___ года
Слайд 6Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
1) Разгрузка и
Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
1) Разгрузка и

термоконтейнеров с ИЛП.
ГБУ РД «РЦИБ и СПИД»
1.1. К приемке вакцины «Гам-КОВИД-Вак» допускаются сотрудники медицинской организации, входящие в состав комиссии по приемке лекарственных препаратов для медицинского применения, назначенные руководителем юридического лица и изучившие данную стандартную операционную процедуру.
1.2. Ответственное лицо, назначенное руководителем юридического лица, проверяет наличие сопроводительных документов.
1.3. Особое внимание ответственное лицо уделяет сверке документов на соответствие номера серии, наименования лекарственного препарата, приемлемости срока годности.
1.4. После проверки сопроводительных документов ответственное лицо дает разрешение на выгрузку продукции из АТС в зону приемки – морозильного/холодильного оборудования (камеры) медицинской организации.
1.5. При разгрузке и приемке необходимо соблюдать общие требования безопасности
1.6. Перед вскрытием термоконтейнеров необходимо подготовить:
канцелярский нож (для вскрытия скотча на термоконтейнере);
перчатки (для извлечения верхнего слоя хладоэлементов и температурных регистраторов);
фото-, видеокамеру (для фиксации степени окрашивания контрольного элемента термоиндикаторов).
Слайд 7Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
2) Приемка ИЛП
ГБУ
Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
2) Приемка ИЛП
ГБУ

2.1. После выгрузки ИЛП термоконтейнеры должны быть незамедлительно перемещены в зону приемки морозильного/холодильного оборудования (камер).
2.2. В морозильном/холодильном оборудовании (камерах) должны работать сотрудники в соответствующей спецодежде, соблюдая технику безопасности.
2.3. Необходимо вскрыть контейнер, извлечь терморегистраторы/термоиндикаторы – эта работа должна быть выполнена за 5 минут, чтобы обеспечить сохранность ИЛП в замороженном состоянии.
2.4. Перед остановкой терморегистраторы (электронный датчик температуры) необходимо согреть при комнатной температуре – около 4 минут, до начала работы дисплея.
2.5. Ответственное лицо считывает и архивирует показания с терморегистраторов, подключая их к компьютеру через USB-порт (в открывшемся окне появившиеся два файла (PDF и текстовый TTV) необходимо сохранить).
2.6. В случае отсутствия температурных отклонений ответственное лицо проводит визуальный осмотр каждого тарного места поступивших ИЛП
2.7. При выявлении признаков механических повреждений: бой, намокание, подтеки, температурные отклонения, а также при подтверждении факта нахождения ИЛП в несоответствующих условиях, способных повлиять на качество ИЛП, ИЛП временно перемещается в зону «карантин» в холодильном/морозильном оборудовании (камере) до принятия окончательного решения.
Слайд 8Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
3) Хранение ИЛП
ГБУ
Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
3) Хранение ИЛП
ГБУ

3.1. Холодильное оборудование должно быть квалифицировано. Техническое обслуживание, поверка и калибровка оборудования должны осуществляться в соответствии с утверждаемым планом-графиком.
3.2. Для бесперебойной работы холодильных камер и электрических приборов для контроля температурного режима должна быть обеспечена стабильность напряжения в электросетях, а также возможность электроснабжения по резервным схемам или автоматическое подключение системы автономного электропитания.
3.3. При паллетном хранении не допускается размещение нескольких наименований ИЛП на одном паллете. Внутри холодильной камеры должно быть выделено место для упаковки ИЛП и пространство для охлаждения термоконтейнеров.
3.4. Хранение продукции осуществляется в вертикальном положении при температуре -18 °С согласно условиям, заявленным производителем и указанным на потребительской упаковке препарата и в паспорте качества.
3.5. Назначенный сотрудник медицинской организации размещает продукцию на хранение в холодильном оборудовании таким образом, чтобы к каждому паллету (коробу) был обеспечен доступ охлажденного воздуха.
3.6. Назначенные сотрудники медицинской организации осуществляют ежедневный контроль температуры.
Слайд 9Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
4) Транспортировка ИЛП
ГБУ
Порядок приема, разгрузки и хранения вакцины
«Гам-КОВИД- Вак» в медицинской организации
4) Транспортировка ИЛП
ГБУ

4.1. Сотрудники медицинской организации собирают ИЛП на основании требования- накладной структурного подразделения, схемы распределения ИЛП
4.2. Укладка ИЛП в термоконтейнеры осуществляется в холодильной камере.
4.3. Для перевозки обычным (не рефрижераторным) транспортом ИЛП упаковываются в специальные термоконтейнеры, изготовленные из теплоизоляционного материала, обеспечивающие соблюдение требуемого интервала температур в течение определенного времени.
4.4. Назначенный сотрудник закладывает хладоэлементы строго в соответствии с инструкциями.
4.5. Порядок укладки ИЛП в термоконтейнеры:
подобрать максимально подходящий по размерам термоконтейнер, заранее охлажденный;
уложить коробки с ИЛП;
заложить предварительно проверенные на герметичность и протертые насухо хладоэлементы;
заложить пустоты вспомогательным материалом;
заложить термоиндикатор/терморегистратор и контрольную карточку;
плотно закрыть термоконтейнер и проклеить скотчем;
наклеить этикетку на каждый термоконтейнер.
4.6. Готовые к отправке термоконтейнеры с ИЛП хранятся в холодильном оборудовании до момента загрузки в АТС
Слайд 10Распоряжение/приказ о назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП
ГБУ
Распоряжение/приказ о назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП
ГБУ

Распоряжение/приказ №
«___» _______________ 20___года г. Махачкала
О назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП
В целях организации соблюдения условий хранения и перевозки/транспортирования ИЛП и надлежащего выполнения комплекса организационных и технических мероприятий, обеспечивающих сохранность качества вакцины для профилактики новой коронавирусной инфекции COVID-19 при обращении в медицинской организации (далее – МО), расположенной по адресу: _______________________________________________________, в том числе при осуществлении приемочного контроля, размещении, хранении и отпуске вышеуказанного лекарственного препарата, а также в соответствии с требованиями пунктов 1, 2, 4, 5 приказа Минздрава от 31.08.2016 № 646н «Об утверждении Правил надлежащей практики хранения и перевозки лекарственных препаратов для медицинского применения», Стандартной операционной процедуры «Хранение и перевозка (транспортирование) вакцины для профилактики новой коронавирусной инфекции в медицинской организации» СМК-СОП-№___.
РАСПОРЯЖАЮСЬ/ПРИКАЗЫВАЮ:
1. _____________________________ (указать должность, Ф. И. О.) обеспечить организацию деятельности по соблюдению условий приемки, хранения, перевозки/транспортирования вакцины для профилактики новой коронавирусной инфекции COVID-19 в МО.
2. ______________________________ (указать должность, Ф. И. О.) надлежит обеспечить организацию выгрузки ИЛП при поступлении из автотранспортного средства (далее – АТС), а также отгрузки продукции в АТС при отпуске ИЛП из МО в обособленное структурное подразделение и перемещение ИЛП внутри МО в максимально сжатые регламентированные сроки:
время нахождения каждого из паллет (коробов – при поставке россыпью) вне установленных температурных пределов не должно превышать ___минут, включая перемещение продукции из одной холодильной/морозильной камеры в другую холодильную/морозильную камеру внутри одного здания (корпусов) МО.
3. Ответственному сотруднику МО, которому поручено выполнение операции по перемещению ИЛП, надлежит регистрировать всю информацию о перемещаемых ИЛП в Листе контроля перемещения ИЛП в соответствии с требованиями процедуры – Стандартной операционной процедуры «Хранение и перевозка (транспортирование) вакцины для профилактики новой коронавирусной инфекции в медицинской организации» СМК-СОП-№……
Слайд 11Распоряжение/приказ о назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП
ГБУ
Распоряжение/приказ о назначении лиц, ответственных за соблюдение условий хранения и перевозки/транспортирования ИЛП
ГБУ

4. _________________________________ (указать должность, Ф. И. О.) подлежит организовать проведение приемочного контроля при поступлении ИЛП в выделенной зоне холодильных камер/морозильных камер МО в соответствии с требованиями внутренних нормативных документов.
5. Работы по обнаружению, отключению и регистрации показаний терморегистраторов (термоиндикаторов), сопровождающих вакцины для профилактики новой коронавирусной инфекции COVID-19, надлежит осуществлять:
_____________________________________ (указать должность, Ф. И. О.)
6. ___________________________________ (указать должность, Ф. И. О.) надлежит организовывать надлежащее размещение ИЛП в холодильных камерах/морозильниках после проведения приемочного контроля в соответствии с температурным режимом хранения, определенным производителем.
7. ___________________________________ (указать должность, Ф. И. О.) осуществлять отгрузку/перемещение ИЛП в выделенную зону экспедиции МО.
8. Работы по контролю комплектования ИЛП надлежит осуществлять________________________ (указать должность, Ф. И. О.)
9. Работы по организации отпуска ИЛП в обособленные структурные подразделения МО согласно требованиям внутренней нормативной документации надлежит осуществлять _________________________________ (указать должность, Ф. И. О.).
10. В случае обнаружения отклонений условий температурного режима хранения ИЛП, сотрудникам МО необходимо незамедлительно проинформировать о данном факте _________________________________ (указать должность, Ф. И. О.).
11. (указать должность, Ф. И. О.) надлежит принимать меры по коррекции и своевременному документированию выявленных отклонений в соответствии с требованиями внутренних процедур.
12. Надлежит направлять Отчеты по расследованию неприемлемых отклонений в адрес ______________(указать должность, Ф. И. О.)
13. Контроль за исполнением настоящего распоряжения/приказа возложить на ______________________ (указать должность, Ф. И. О.)
Главный врач _____________________________________________________________
(Ф. И. О., подпись, дата)
Ознакомлены: ________________________________________________________________
(Ф. И. О., должность, подпись, дата)
Слайд 12Список допущенных сотрудников
Лист распределения документа СМК
ГБУ РД «РЦИБ и СПИД»
Список сотрудников, допущенных
Список допущенных сотрудников
Лист распределения документа СМК
ГБУ РД «РЦИБ и СПИД»
Список сотрудников, допущенных

Лист распределения документа СМК
Название документа: СМК-СОП-___
«ХРАНЕНИЕ И ПЕРЕВОЗКА (ТРАНСПОРТИРОВАНИЕ) ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИИ В МЕДИЦИНСКОЙ ОРГАНИЗАЦИИ»
Слайд 13Журнал учета движения ИЛП
ГБУ РД «РЦИБ и СПИД»
Образцы подписей сотрудников
Журнал
Журнал учета движения
Журнал учета движения ИЛП
ГБУ РД «РЦИБ и СПИД»
Образцы подписей сотрудников
Журнал
Журнал учета движения

Дата начала ведения журнала _______________________
Дата окончания ведения журнала ____________________
Слайд 14СОП №2
ПОРЯДОК ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ПРОТИВ COVID-19 ВЗР. НАСЕЛЕНИЮ
ГБУ РД «РЦИБ и СПИД»
СТАНДАРТНАЯ
СОП №2
ПОРЯДОК ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ПРОТИВ COVID-19 ВЗР. НАСЕЛЕНИЮ
ГБУ РД «РЦИБ и СПИД»
СТАНДАРТНАЯ

«ПОРЯДОК ПРОВЕДЕНИЯ ВАКЦИНАЦИИ ПРОТИВ COVID-19 ВЗРОСЛОМУ НАСЕЛЕНИЮ»
СМК-СОП-№ ____
УТВЕРЖДАЮ
Руководитель юридического лица
_______________________________Ф. И. О.
«___» ________________ 20___ года
Слайд 15МЕСТО ПРОВЕДЕНИЯ ВАКЦИНАЦИИ
ГБУ РД «РЦИБ и СПИД»
Вакцинация проводится в прививочном кабинете, который
МЕСТО ПРОВЕДЕНИЯ ВАКЦИНАЦИИ
ГБУ РД «РЦИБ и СПИД»
Вакцинация проводится в прививочном кабинете, который

Оснащение прививочного кабинета
Слайд 16МЕСТО ПРОВЕДЕНИЯ ВАКЦИНАЦИИ
ГБУ РД «РЦИБ и СПИД»
Оснащение прививочного кабинета
МЕСТО ПРОВЕДЕНИЯ ВАКЦИНАЦИИ
ГБУ РД «РЦИБ и СПИД»
Оснащение прививочного кабинета
Слайд 17СПОСОБ ПРИМЕНЕНИЯ ВАКЦИНЫ И ДОЗЫ
ГБУ РД «РЦИБ и СПИД»
Варианты выпуска препарата:
однодозовый (0,5
СПОСОБ ПРИМЕНЕНИЯ ВАКЦИНЫ И ДОЗЫ
ГБУ РД «РЦИБ и СПИД»
Варианты выпуска препарата:
однодозовый (0,5

многодозовый (3,0 мл во флаконах).
Перед вакцинированием флакон с компонентом I или II достают из морозильной камеры и выдерживают при комнатной температуре до полного размораживания.
Не допускается: интенсивное встряхивание флакона, наличие остатков льда во флаконе, повторное замораживание флакона с раствором!
Допускается хранение размороженной однодозовой ампулы не более 30 минут.
Флакон, содержащий 3,0 мл вакцины, предназначен для вакцинации пяти пациентов,
содержит 5 доз по 0,5 мл.
Допускается хранение вскрытого флакона по 3,0 мл не более 2 часов при комнатной температуре.
При использовании многодозовых флаконов необходимо строго следить за отбором необходимой дозы 0,5 мл и избегать передозировки препарата.
Слайд 18СПОСОБ ПРИМЕНЕНИЯ ВАКЦИНЫ И ДОЗЫ
ГБУ РД «РЦИБ и СПИД»
Вакцинацию проводят в два
СПОСОБ ПРИМЕНЕНИЯ ВАКЦИНЫ И ДОЗЫ
ГБУ РД «РЦИБ и СПИД»
Вакцинацию проводят в два

Компонентом I в дозе 0,5 мл,
На 21 день компонентом II в дозе 0,5 мл.
Перед проведением II этапа вакцинации проводится повторный осмотр врачом с измерением температуры, сбором эпидемиологического анализа, измерением сатурации, ЧСС, АД, аускультацией дыхательной и сердечно-сосудистой системы, осмотром зева.
Врач определяет отсутствие или наличие противопоказаний к вакцинации компонентом II.
Противопоказаниями к вакцинации компонентом II являются тяжелые поствакцинальные осложнения на введение компонента I вакцины.
Факт применения вакцины на I и II этапах подтверждается внесением информации по форме регистра вакцинированных от COVID-19 в ЕГИСЗ.
Вакцина предназначена только для внутримышечного введения.
Строго запрещено внутривенное введение препарата.
Вакцину вводят в дельтовидную мышцу (верхнюю треть наружной поверхности плеча). При невозможности введения в дельтовидную мышцу - препарат вводят в латеральную широкую мышцу бедра.
После вакцинации пациент должен находиться под наблюдением медицинского персонала в течение 30 минут!
Слайд 19Приложение №1
Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых
Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых

ГБУ РД «РЦИБ и СПИД»
Слайд 20Приложение №1
Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых
Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых

ГБУ РД «РЦИБ и СПИД»
Слайд 21Приложение №1
Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых
Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых

ГБУ РД «РЦИБ и СПИД»
Слайд 22Приложение №1
Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых
Приложение №1 Алгоритм действий медицинских работников, осуществляющих проведение вакцинации против COVID-19 у взрослых

ГБУ РД «РЦИБ и СПИД»
Слайд 23Приложение №2
АНКЕТА ПАЦИЕНТА
ГБУ РД «РЦИБ и СПИД»
Приложение №2
АНКЕТА ПАЦИЕНТА
ГБУ РД «РЦИБ и СПИД»

Слайд 24Приложение №3
Памятка пациента о проведении вакцинации против COVID-19
ГБУ РД «РЦИБ и СПИД»
Уважаемый
Приложение №3
Памятка пациента о проведении вакцинации против COVID-19
ГБУ РД «РЦИБ и СПИД»
Уважаемый

Ваше крепкое здоровье – наша главная цель! А для того, чтобы полностью реализовать наш потенциал в достижении главной цели, мы просим Вас соблюдать некоторые (основные и важные) правила, которые помогут нам в нашей работе:
1. Вакцинации подлежат лица, не болевшие COVID-19 и не имеющие антител к SARS-CoV-2 по результатам лабораторных исследований.
2. Противопоказаниями к вакцинации являются:
гиперчувствительность к какому-либо компоненту вакцины или вакцины, содержащей аналогичные компоненты;
тяжелые аллергические реакции в анамнезе;
острые инфекционные и неинфекционные заболевания;
обострение хронических заболеваний (вакцинацию проводят через 2-4 недели после выздоровления или ремиссии);
беременность и период грудного вскармливания;
возраст до 18 лет.
3. Перед проведением вакцинации необходим обязательный осмотр врача с измерением температуры, сбором эпидемиологического анамнеза, измерением сатурации, осмотром зева на основании которых врач-специалист определяет отсутствие или наличие противопоказаний к вакцинации.
Врач расскажет Вам о возможных реакциях на вакцинацию и поможет заполнить информированное добровольное согласие на проведение вакцинации.
4. Вакцинацию проводят в два этапа: вначале вводят компонент I в дозе 0,5 мл. Препарат вводят внутримышечно. На 21 день вводят компонент II в дозе 0,5 мл. Препарат вводят внутримышечно.
5. В течение 30 мин после вакцинации просим Вас оставаться в медицинской организации для предупреждения возможных аллергических реакций.
6. После проведения вакцинации в первые-вторые сутки могут развиваться и разрешаются в течение трех последующих дней кратковременные общие (непродолжительный гриппоподобный синдром, характеризующийся ознобом, повышением температуры тела, артралгией, миалгией, астенией, общим недомоганием, головной болью) и местные (болезненность в месте инъекции, гиперемия, отёчность) реакции.
Реже отмечаются тошнота, диспепсия, снижение аппетита, иногда -увеличение регионарных лимфоузлов. Возможно развитие аллергических реакций.
Рекомендуется в течение 3-х дней после вакцинации не мочить место инъекции, не посещать сауну, баню, не принимать алкоголь, избегать чрезмерных физических нагрузок.
При покраснении, отечности, болезненности места вакцинации принять антигистаминные средства. При повышении температуры тела после вакцинации – нестероидные противовоспалительные средства.
Вакцина против COVID-19 не отменяет для привитого пациента необходимость носить маски и перчатки, а также соблюдать социальную дистанцию.
Слайд 25Приложение №4
Осмотр врача перед вакцинацией от COVID-19
ГБУ РД «РЦИБ и СПИД»
Приложение №4
Осмотр врача перед вакцинацией от COVID-19
ГБУ РД «РЦИБ и СПИД»

Слайд 26ФАРМАКОНАДЗОР
ГБУ РД «РЦИБ и СПИД»
Вакцина «Гам-Ковид-Вак» зарегистрирована по особой процедуре регистрации, в
ФАРМАКОНАДЗОР
ГБУ РД «РЦИБ и СПИД»
Вакцина «Гам-Ковид-Вак» зарегистрирована по особой процедуре регистрации, в

В соответствии с приказом Росздравнадзора от 15.02.2017 № 1071 «Об утверждении порядка осуществления фармаконадзора» в медицинской организации должен быть организован фармаконадзор лекарственных препаратов.
При работе с побочными проявлениями после иммунизации вакцин следует учитывать положения «Методические рекомендации по выявлению, расследованию и профилактике побочных проявлений после иммунизации» (утверждены Минздравом России 12.04.2019).
Слайд 27Дополнительно
ГБУ РД «РЦИБ и СПИД»
Дополнительно
ГБУ РД «РЦИБ и СПИД»

 Глюкагоноподобный пептид-1 в терапии сахарного диабета 2-го типа
Глюкагоноподобный пептид-1 в терапии сахарного диабета 2-го типа Опорно-двигательная система
Опорно-двигательная система β - блокаторы
β - блокаторы Чем коронавирус нам поможет?
Чем коронавирус нам поможет? Тест-системы ПЦР в Реальном времени для определения коронавирусной инфекции - компании Гербион ГМБХ
Тест-системы ПЦР в Реальном времени для определения коронавирусной инфекции - компании Гербион ГМБХ Калорийность дневного рациона
Калорийность дневного рациона Мерцательная аритмия
Мерцательная аритмия Отравления пищевыми продуктами
Отравления пищевыми продуктами Презентация 5
Презентация 5 For breast cancer
For breast cancer Биологические ритмы
Биологические ритмы Российское общество профилактики неинфекционных заболеваний
Российское общество профилактики неинфекционных заболеваний Клинические проявления заболеваний нервной системы
Клинические проявления заболеваний нервной системы Способы защиты организна от возбудителей инфекционных болезней. Инмунитет
Способы защиты организна от возбудителей инфекционных болезней. Инмунитет Арнайы емі
Арнайы емі Материалы для распломбировки каналов
Материалы для распломбировки каналов Современные представления о кардиоваскулярном центре
Современные представления о кардиоваскулярном центре Критические нарушения жизнедеятельности у хирургических больных
Критические нарушения жизнедеятельности у хирургических больных Лихорадка Эбола
Лихорадка Эбола Система учета донорских органов и тканей человека, доноров органов и тканей человека, пациентов (реципиентов) в РФ
Система учета донорских органов и тканей человека, доноров органов и тканей человека, пациентов (реципиентов) в РФ Железа внутренней секреции: строение и функции
Железа внутренней секреции: строение и функции Организм человека, как единая биологическая система
Организм человека, как единая биологическая система Расшифровка клинического общего анализа мочи
Расшифровка клинического общего анализа мочи BIO-HELIX. Инновационный уход
BIO-HELIX. Инновационный уход Наглядная демонстрация проведения логопедического массажа при заикании
Наглядная демонстрация проведения логопедического массажа при заикании Йодомидол. Обогащение йодом яиц и мяса кур бройлеров
Йодомидол. Обогащение йодом яиц и мяса кур бройлеров Перспективи розвитку КНП “МДКЛ” Івано-Франківської міської ради
Перспективи розвитку КНП “МДКЛ” Івано-Франківської міської ради Государственное регулирование в социальной сфере (здравоохранение)
Государственное регулирование в социальной сфере (здравоохранение)