Содержание
- 2. Тканевая инженерия — современная инновационная технология Принципиально новый подход — клеточная и тканевая инженерия — является
- 3. Клетки и матриксы — основа основ для тканевой инженерии Наиболее важным элементом успеха является наличие необходимого
- 4. Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex
- 5. Стволовые клетки-недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в различные типы специализированных клеток
- 6. На сегодняшний день одна из стратегий тканевой инженерии такова: 1. Отбор и культивирование собственных или донорских
- 7. Исследования Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но перед созданием сложных
- 8. Испанские хирурги провели первую в мире трансплантацию трахеи, выращенной из стволовых клеток пациентки - 30-летней Клаудии
- 9. Клонирование— метод получения нескольких генетически идентичных организмов путем бесполого (в том числе вегетативного) размножения. Клонирование человека
- 10. Цель клонирования: создание генотипической и фенотипической копии, полностью тождественной клонируемой. Берется соматическая/ не половая / клетка,
- 12. Скачать презентацию
Слайд 2Тканевая инженерия — современная инновационная технология
Принципиально новый подход — клеточная и тканевая
Тканевая инженерия — современная инновационная технология Принципиально новый подход — клеточная и тканевая
Цель тканевой инженерии — конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Важно отметить, что обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, — в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям:
· способность к самовосстановлению;
· способность поддерживать кровоснабжение;
· способность изменять строение и свойства в ответ на факторы окружающей среды, включая механическую нагрузку.
Слайд 3Клетки и матриксы — основа основ для тканевой инженерии
Наиболее важным элементом успеха
Клетки и матриксы — основа основ для тканевой инженерии Наиболее важным элементом успеха
Слайд 4Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты
Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты
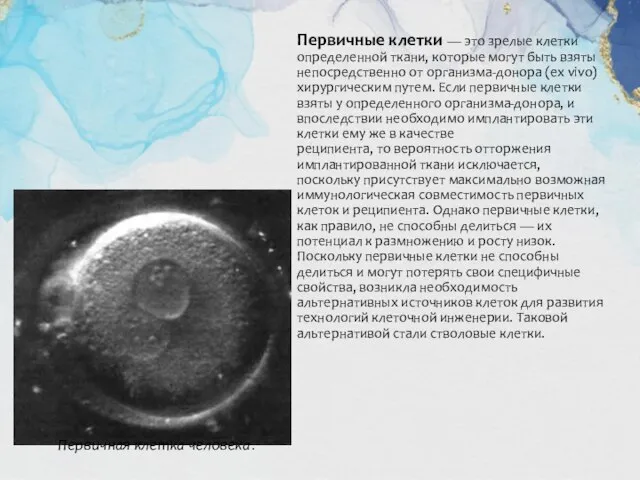
Первичная клетка человека.
Слайд 5Стволовые клетки-недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в
Стволовые клетки-недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в
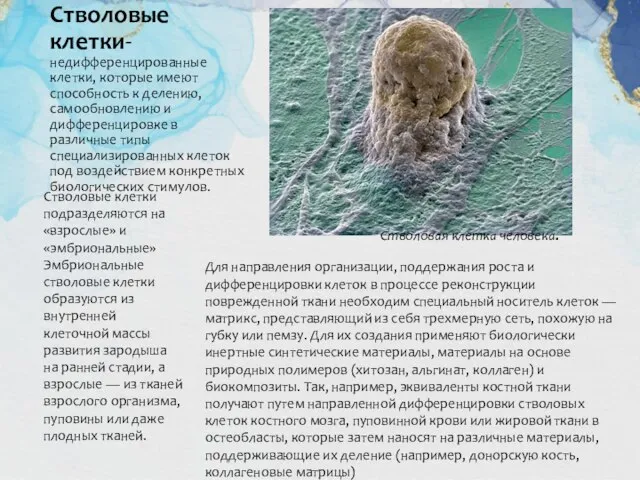
Стволовые клетки подразделяются на «взрослые» и «эмбриональные»
Эмбриональные стволовые клетки образуются из внутренней клеточной массы развития зародыша на ранней стадии, а взрослые — из тканей взрослого организма, пуповины или даже плодных тканей.
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток — матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу. Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы)
Стволовая клетка человека.
Слайд 6На сегодняшний день одна из стратегий тканевой инженерии такова:
1. Отбор и культивирование
На сегодняшний день одна из стратегий тканевой инженерии такова: 1. Отбор и культивирование

Слайд 7Исследования
Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но
Исследования Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но

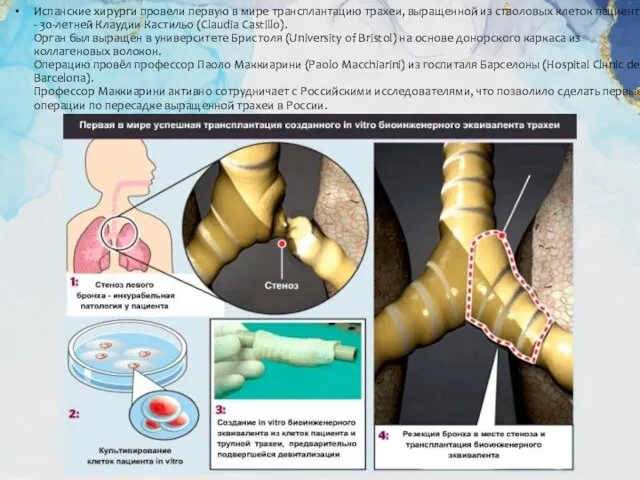
Слайд 8Испанские хирурги провели первую в мире трансплантацию трахеи, выращенной из стволовых клеток
Испанские хирурги провели первую в мире трансплантацию трахеи, выращенной из стволовых клеток
Слайд 9Клонирование— метод получения нескольких генетически идентичных организмов путем бесполого (в том числе
Клонирование— метод получения нескольких генетически идентичных организмов путем бесполого (в том числе

Слайд 10Цель клонирования: создание генотипической и фенотипической копии, полностью тождественной клонируемой. Берется соматическая/
Цель клонирования: создание генотипической и фенотипической копии, полностью тождественной клонируемой. Берется соматическая/

 Анатомо-физиологические особенности системы и синдромы поражения системы крови у детей
Анатомо-физиологические особенности системы и синдромы поражения системы крови у детей Ересек және балалардағы синкопальды жағдайлар
Ересек және балалардағы синкопальды жағдайлар urok
urok Нозокомиальные инфекции
Нозокомиальные инфекции Профилактика ИСМП. Лекция №1
Профилактика ИСМП. Лекция №1 Психопатология. Практическое занятие №3
Психопатология. Практическое занятие №3 Беременность и патология почек
Беременность и патология почек Рак шейки матки
Рак шейки матки Розвиток професійних хвороб зумовлений впливом на організм працівників шкідливих виробничих чинників
Розвиток професійних хвороб зумовлений впливом на організм працівників шкідливих виробничих чинників Міксома - доброякісна первинна пухлина
Міксома - доброякісна первинна пухлина Профилактика тромбозов вен нижних конечностей
Профилактика тромбозов вен нижних конечностей Ведение первичной медицинской документации в ходе исследования. Информированное согласие пациента, протокол исследования
Ведение первичной медицинской документации в ходе исследования. Информированное согласие пациента, протокол исследования Дії медичної сестри при масових спалахах грипу та ГРВЗ
Дії медичної сестри при масових спалахах грипу та ГРВЗ Аменорея
Аменорея Оказание первой помощи при приступе эпилепсии
Оказание первой помощи при приступе эпилепсии Лечебно-профилактическое предприятие Итальянский закат в Краснодарском крае
Лечебно-профилактическое предприятие Итальянский закат в Краснодарском крае Республиканское общественное объединение пациентов (родителей) с первичным иммунодефицитом Спасем иммунитет
Республиканское общественное объединение пациентов (родителей) с первичным иммунодефицитом Спасем иммунитет Приёмники излучения в традиционной рентгенологии
Приёмники излучения в традиционной рентгенологии Травмобезопасность коленей, поясничного и шейного отдела позвоночника при выполнении асан
Травмобезопасность коленей, поясничного и шейного отдела позвоночника при выполнении асан Здоровая еда - еда против COVID-19
Здоровая еда - еда против COVID-19 Особенности течения новой коронавирусной инфекции и организация медицинской помощи пациентам старшей возрастной группы
Особенности течения новой коронавирусной инфекции и организация медицинской помощи пациентам старшей возрастной группы Кариес и его предупреждение
Кариес и его предупреждение Органы кроветворения и иммунной защиты (Лекция 12)
Органы кроветворения и иммунной защиты (Лекция 12) Начальная, реанимационная и послереанимационная помощь новорожденным в Украине
Начальная, реанимационная и послереанимационная помощь новорожденным в Украине Вторичный и третичный периоды сифилиса
Вторичный и третичный периоды сифилиса Режим дня здорового человека
Режим дня здорового человека Кровь, ее функции, очищение
Кровь, ее функции, очищение Средства от головной боли
Средства от головной боли