Введение в экогенетику человека, фармакогенетику. Генетические основы индивидуальной чувствительности к лекарствам
Содержание
- 2. Экогенетика человека - это наука, которая изучает различные генетически обусловленные реакции людей на определённые агенты среды.
- 3. Среда обитания человека постоянно менялась на протяжении сотен тысяч лет. К её изменениям человек приспосабливался как
- 4. Изучение наследственной изменчивости человека под влиянием факторов научно-технического прогресса является важной генетической проблемой. В связи с
- 5. Экогенетика человека как раз и изучает вариации ответов разных людей на факторы внешней среды. Большинство патологических
- 6. Во время войны в Корее (1950-1952 годы) все американские солдаты проходили профилактический курс лечения противомалярийным препаратом
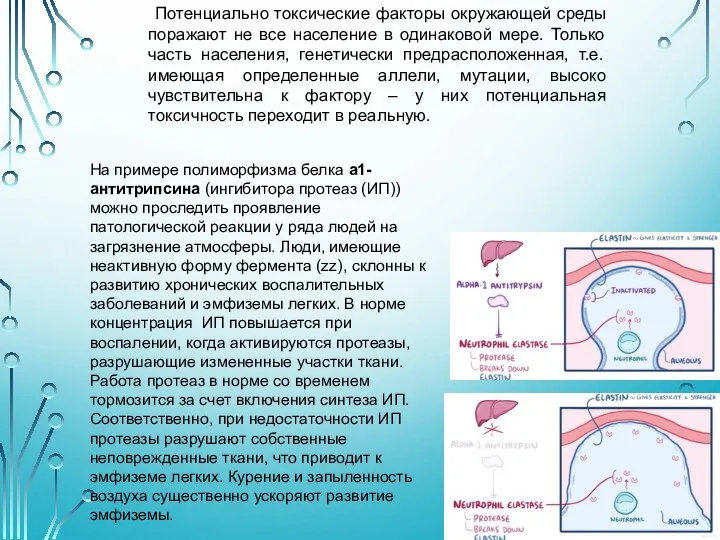
- 7. Потенциально токсические факторы окружающей среды поражают не все население в одинаковой мере. Только часть населения, генетически
- 8. ФАРМАКОГЕНЕТИКА Наука, изучающая место и роль генетических факторов в формировании ответа организма человека на лекарственные средства;
- 9. ИСТОРИЯ ФАРМАКОГЕНЕТИКИ 1957 – Признание генетической природы индивидуальной чувствительности к лекарствам (А. Мотульски: «Наследственность может объяснить
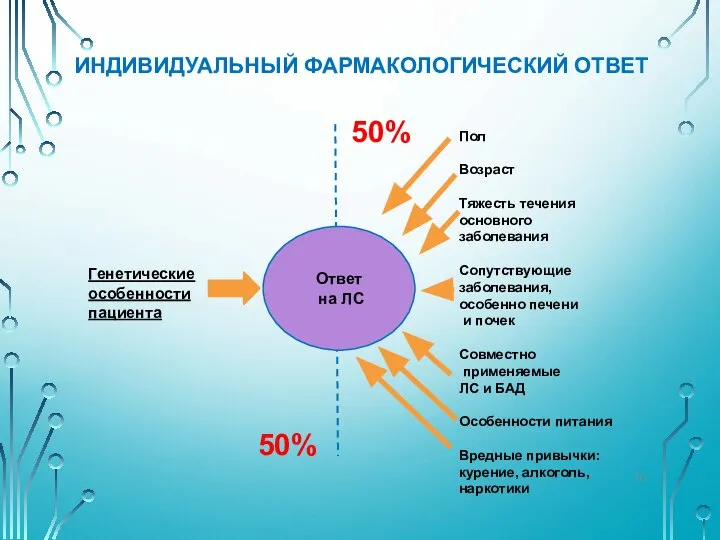
- 10. ИНДИВИДУАЛЬНЫЙ ФАРМАКОЛОГИЧЕСКИЙ ОТВЕТ Ответ на ЛС Генетические особенности пациента 50% 50% Пол Возраст Тяжесть течения основного
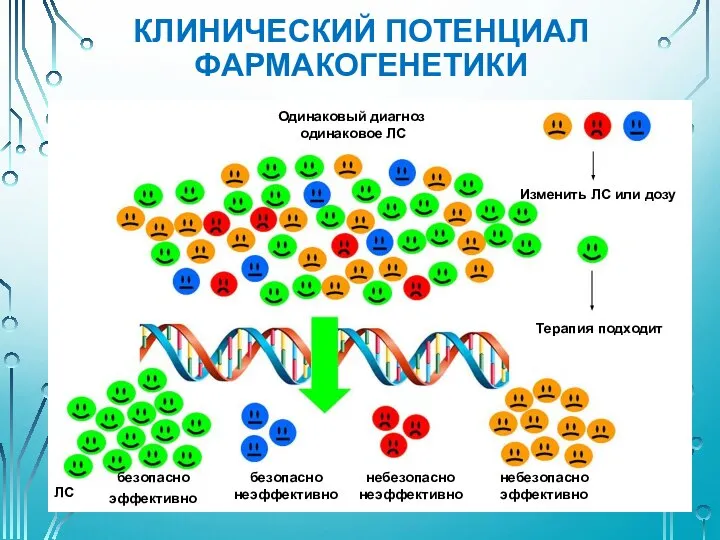
- 11. КЛИНИЧЕСКИЙ ПОТЕНЦИАЛ ФАРМАКОГЕНЕТИКИ
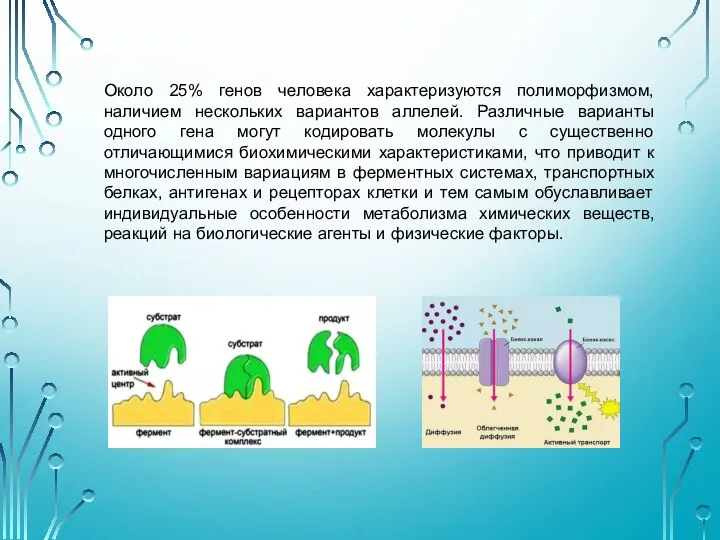
- 12. Около 25% генов человека характеризуются полиморфизмом, наличием нескольких вариантов аллелей. Различные варианты одного гена могут кодировать
- 13. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ Типы полиморфизмов: Однонуклеотидный полиморфизм (SNP): самый распространенный тип полиморфизма, встречается, в среднем, через каждый
- 14. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ
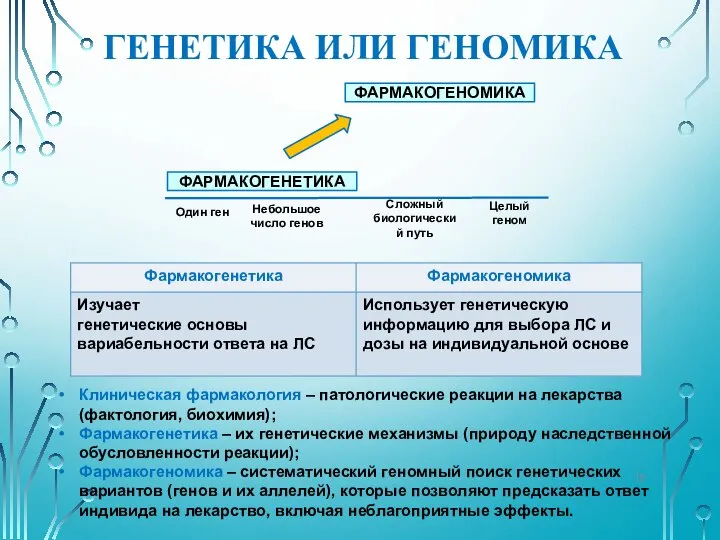
- 15. ГЕНЕТИКА ИЛИ ГЕНОМИКА Клиническая фармакология – патологические реакции на лекарства (фактология, биохимия); Фармакогенетика – их генетические
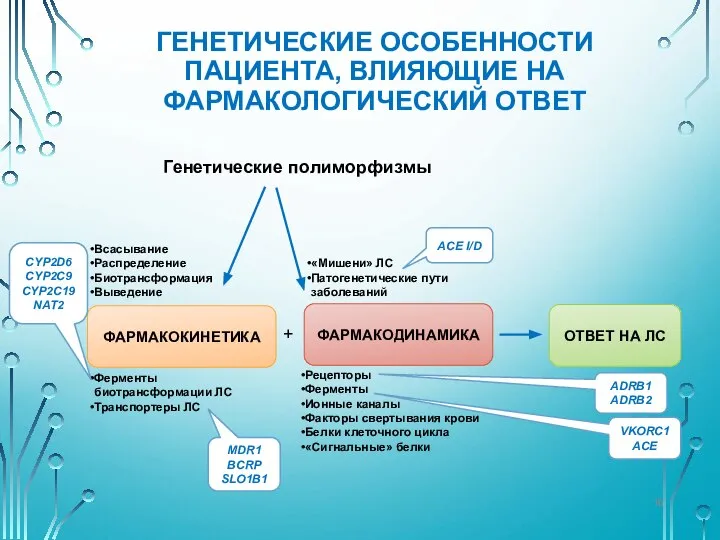
- 16. ГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ ПАЦИЕНТА, ВЛИЯЮЩИЕ НА ФАРМАКОЛОГИЧЕСКИЙ ОТВЕТ Всасывание Распределение Биотрансформация Выведение Ферменты биотрансформации ЛС Транспортеры ЛС
- 17. ИЗМЕНЕНИЯ ФАРМАКОЛОГИЧЕСКОГО ОТВЕТА Приводящие к серьезным реакциям – применение ЛС противопоказано; Приводящие к неблагоприятным побочным реакциям,
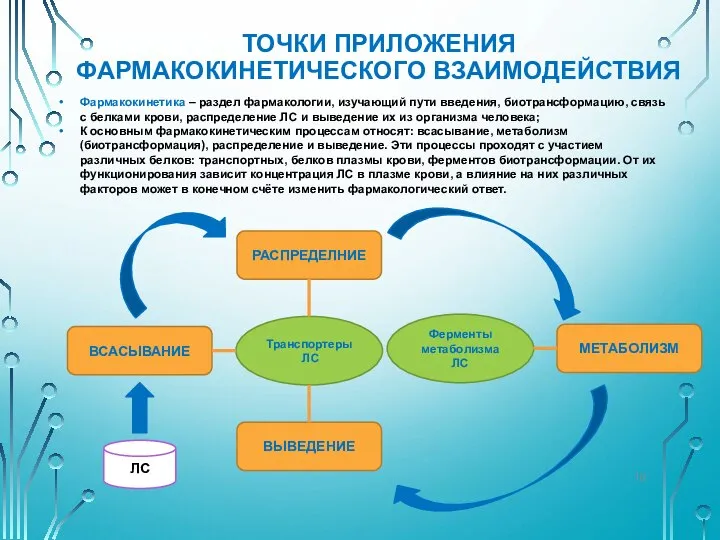
- 18. ТОЧКИ ПРИЛОЖЕНИЯ ФАРМАКОКИНЕТИЧЕСКОГО ВЗАИМОДЕЙСТВИЯ Фармакокинетика – раздел фармакологии, изучающий пути введения, биотрансформацию, связь с белками крови,
- 19. ТРАНСПОРТЕРЫ ЛС Ферменты, обеспечивающие функции всасывания, распределения и выведения из организмв ЛС; В фармакокинетике ЛС транспортёры
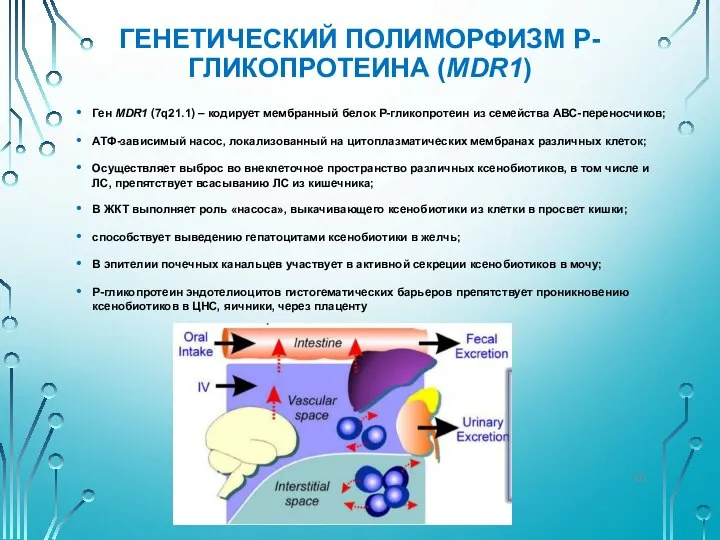
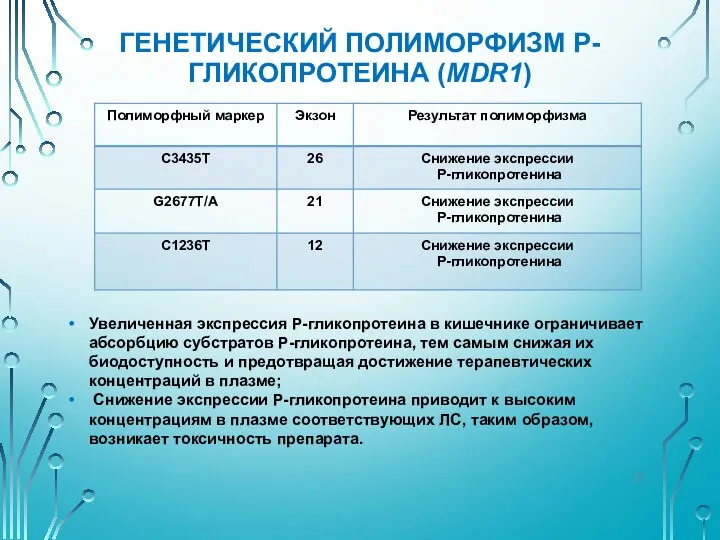
- 20. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ P-ГЛИКОПРОТЕИНА (MDR1) Ген MDR1 (7q21.1) – кодирует мембранный белок Р-гликопротеин из семейства АВС-переносчиков; АТФ-зависимый
- 21. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ P-ГЛИКОПРОТЕИНА (MDR1) Увеличенная экспрессия P-гликопротеина в кишечнике ограничивает абсорбцию субстратов Р-гликопротеина, тем самым снижая
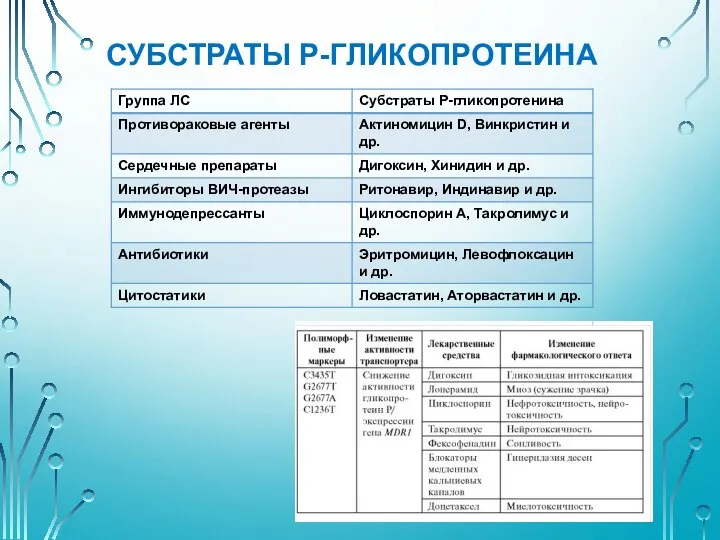
- 22. СУБСТРАТЫ Р-ГЛИКОПРОТЕИНА
- 23. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ ПРИ ОБНАРУЖЕНИИ ГЕНЕТИЧЕСКОГО ПОЛИМОРФИЗМА P-ГЛИКОПРОТЕИНА (MDR1) Следует снижать дозу лекарств-субстратов Р-гликопротеина с узкой терапевтической
- 24. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ТРАНСПОРТЕРОВ ОРГАНИЧЕСКИХ АНИОНОВ И КАТИОНОВ Трансмембранные белки, ответственные за перенос через мембрану эндогенных веществ
- 25. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ТРАНСПОРТЕРОВ ОРГАНИЧЕСКИХ АНИОНОВ И КАТИОНОВ
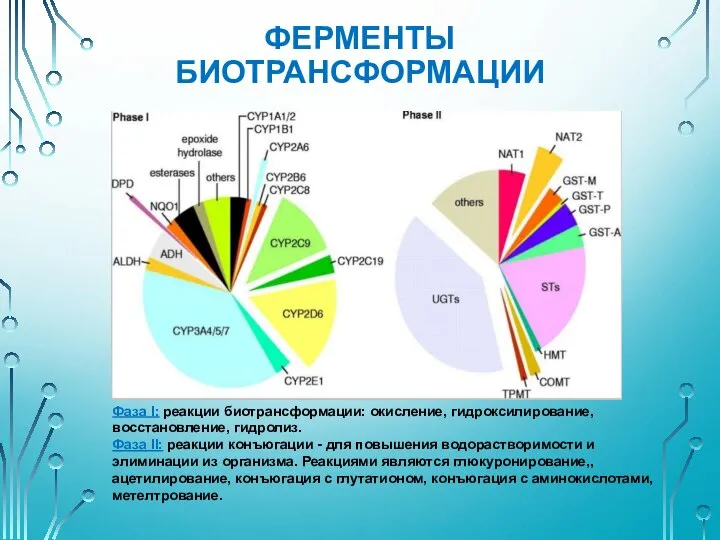
- 26. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ГЕНОВ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ Биотрансформация - понятие, включающее все химические изменения, происходящие с ЛС в
- 27. ФЕРМЕНТЫ БИОТРАНСФОРМАЦИИ Фаза I: реакции биотрансформации: окисление, гидроксилирование, восстановление, гидролиз. Фаза II: реакции конъюгации - для
- 28. ГРУППЫ ИНДИВИДУУМОВ, РАЗЛИЧНЫХ ПО АКТИВНОСТИ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ Экстенсивные метаболизаторы - индивиды с нормальной скоростью метаболизма рассматриваемых
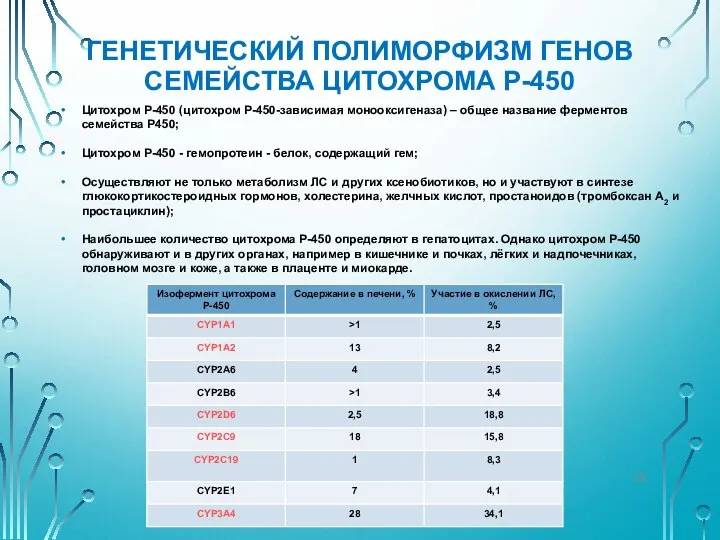
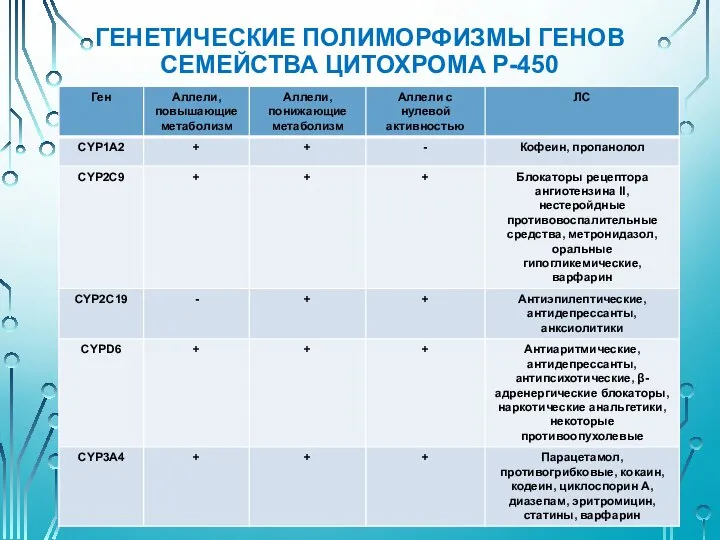
- 29. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ГЕНОВ СЕМЕЙСТВА ЦИТОХРОМА Р-450 Цитохром Р-450 (цитохром Р-450-зависимая монооксигеназа) – общее название ферментов семейства
- 30. ГЕНЕТИЧЕСКИЕ ПОЛИМОРФИЗМЫ ГЕНОВ СЕМЕЙСТВА ЦИТОХРОМА Р-450
- 31. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ БУТИРИЛХОЛИНЭСТЕРАЗЫ (ПСЕВДОХОЛИНЭСТЕРАЗЫ) Бутирилхолинэстераза – катализирует реакцию гидролиза ацетилхолина; Фермент катализирует реакцию гидролиза деполяризующего миорелаксанта
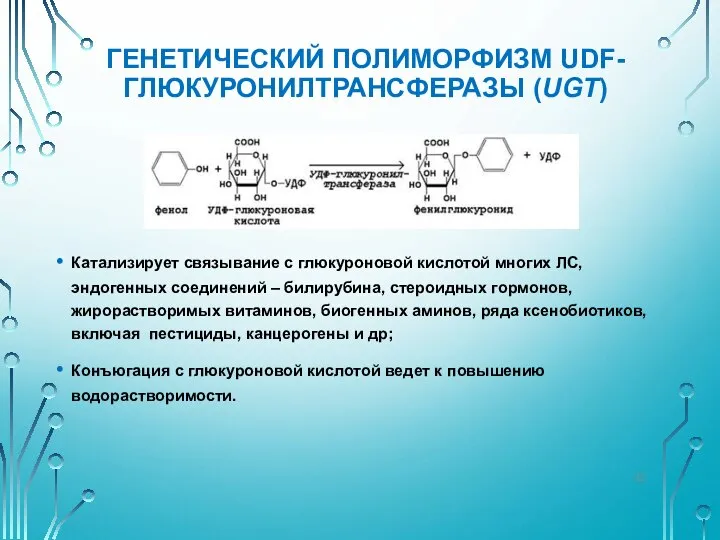
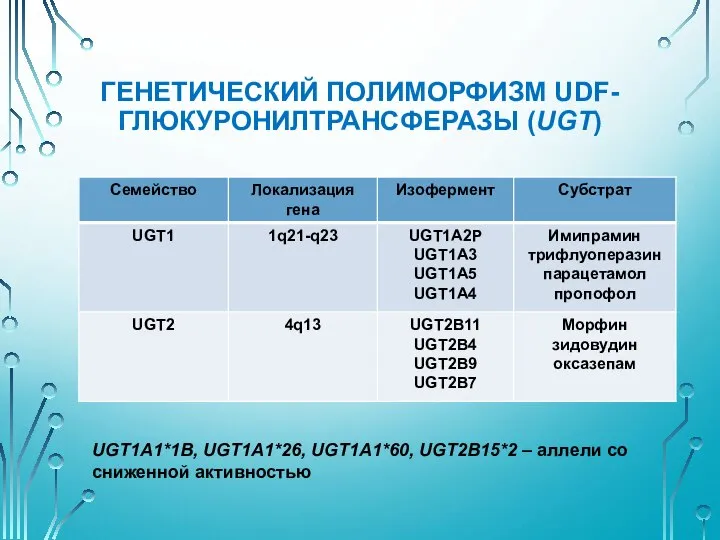
- 32. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ UDF-ГЛЮКУРОНИЛТРАНСФЕРАЗЫ (UGT) Катализирует связывание с глюкуроновой кислотой многих ЛС, эндогенных соединений – билирубина, стероидных
- 33. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ UDF-ГЛЮКУРОНИЛТРАНСФЕРАЗЫ (UGT) UGT1A1*1B, UGT1A1*26, UGT1A1*60, UGT2B15*2 – аллели со сниженной активностью
- 34. ГЕНЕТИЧЕСКИЕ ПОЛИМОРФИЗМЫ ГЛЮКУРОНИЛТРАНСФЕРАЗЫ Наследственные нарушения глюкуронирования билирубина (UGT1): Синдром Жильбера (AR) Синдром Криглера-Найара
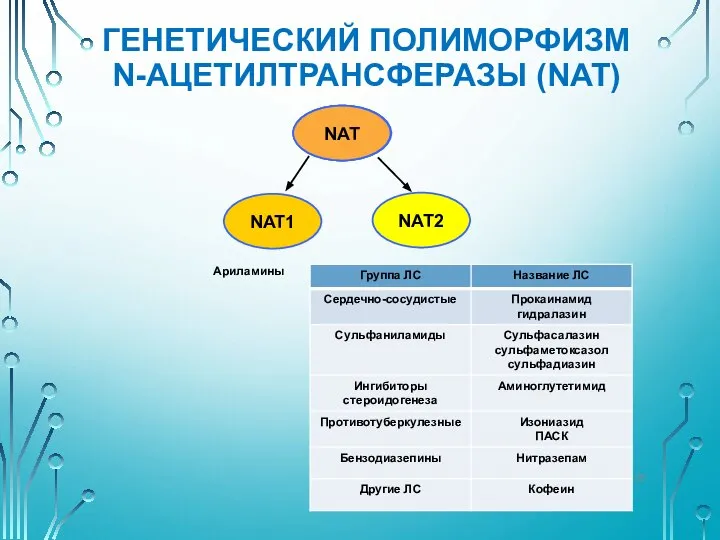
- 35. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ N-АЦЕТИЛТРАНСФЕРАЗЫ (NAT) NAT NAT NAT NAT2 NAT1 Ариламины
- 36. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ N-АЦЕТИЛТРАНСФЕРАЗЫ (NAT) Впервые полиморфизм ацетилирования был описан в 1960 г., при этом были выделены
- 37. ГЕНЕТИЧЕСКИЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ФАРМАКОДИНАМИКУ ЛС Полиморфизмы в генах, кодирующих белки, которые служат фармакологическими мишенями для
- 38. ИЗМЕНЕИНИЕ ФАРМАКОЛОГИЧЕСКОГО ОТВЕТА ПРИ НАСЛЕДСТВЕННЫХ ЗАБОЛЕВАНИЯХ Недостаточность глюкозо-6-фосфатдегидрогеназы; Порфирия.
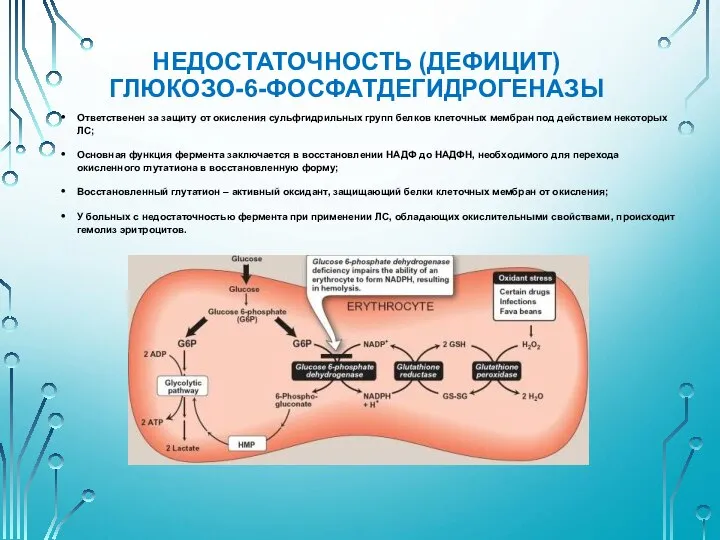
- 39. НЕДОСТАТОЧНОСТЬ (ДЕФИЦИТ) ГЛЮКОЗО-6-ФОСФАТДЕГИДРОГЕНАЗЫ Ответственен за защиту от окисления сульфгидрильных групп белков клеточных мембран под действием некоторых
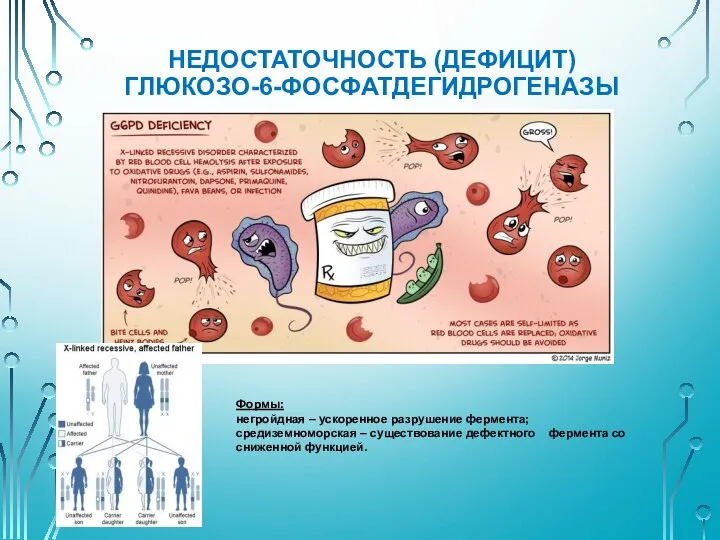
- 40. НЕДОСТАТОЧНОСТЬ (ДЕФИЦИТ) ГЛЮКОЗО-6-ФОСФАТДЕГИДРОГЕНАЗЫ Формы: негройдная – ускоренное разрушение фермента; средиземноморская – существование дефектного фермента со сниженной
- 41. ИЗМЕНЕНИЕ ФАРМАКОЛОГИЧЕСКОГО ОТВЕТА ПРИ ПОРФИРИИ Порфирия — наследственное заболевание, в основе которого лежит повышение активности синтетазы
- 42. Фармакогенетика в клинических исследованиях В настоящее время при клинических исследованиях (КИ) начинают использовать фармакогенетическую информацию. Первоначально
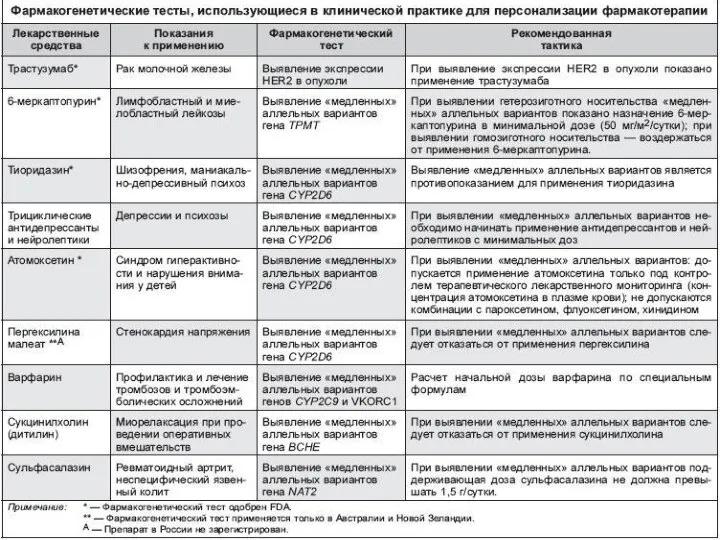
- 43. ФАРМАКОГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ В КЛИНИЧЕСКОЙ ПРАКТИКЕ Фармакогенетический тест — идентификация конкретных генотипов, ассоциированных с изменением фармакологического ответа;
- 44. ТРЕБОВАНИЯ К ФАРМАКОГЕНЕТИЧЕСКОМУ ТЕСТУ ДЛЯ ВНЕДРЕНИЯ В КЛИНИЧЕСКУЮ ПРАКТИКУ Наличие выраженной ассоциации между выявляемым аллелем того
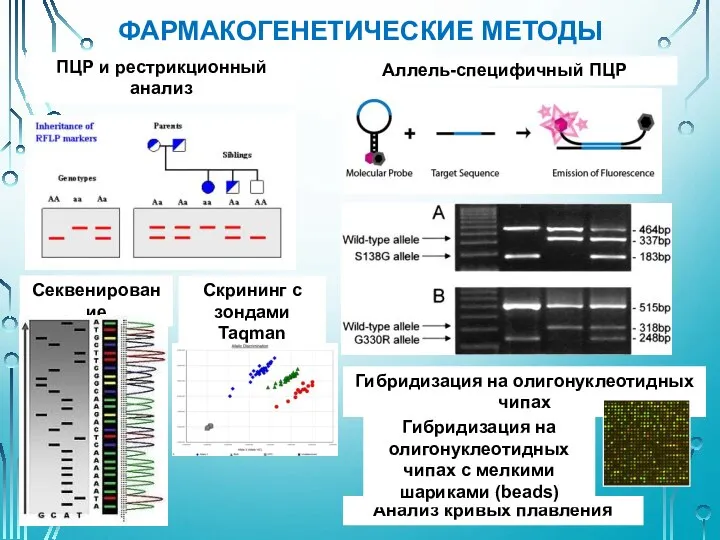
- 45. ФАРМАКОГЕНЕТИЧЕСКИЕ МЕТОДЫ ПЦР и рестрикционный анализ Аллель-специфичный ПЦР Секвенирование Скрининг с зондами Taqman Анализ кривых плавления
- 46. Выявление генетических особенностей позволяет ИНДИВИДУАЛЬНО подойти к выбору ЛС и его режима дозирования, что позволяет повысить
- 47. ПРИМЕРЫ ГЕНЕТИЧЕСКИХ ПОЛИМОРФИЗМОВ, АССОЦИИРОВАННЫХ С ВАРЬИРУЮЩИМИ ОТВЕТАМИ НА ЛЕКАРСТВА
- 48. ФАРМАКОГЕНЕТИЧЕСКОЕ ТЕСТИРОВАНИЕ НЕОБХОДИМЫ В СЛЕДУЮЩИХ КЛИНИЧЕСКИХ СИТУАЦИЯХ При длительном применении ЛС (сердечно-сосудистые, психотропные ЛС, гормональные препараты
- 49. В реальной клинической практике фармакогенетическое тестирование в клинической практике применяется редко; Сертифицированных тестов меньше, чем установленных
- 50. Антикоагулянты (варфарин, аценокумарол) – гены CYP2C9 и VKORC1 Антидепрессанты и нейролептики - ген CYP2C9 Изониазид, пиразинамид,
- 51. Варфарин Клопидогрель (Плавикс, Зилт, Эгитромб) – ген цитохрома CYP2C19 – у примерно 30% пациентов наблюдается редуцированный
- 53. ПЕРСПЕКТИВЫ ФАРМАКОГЕНЕТИКИ - ФАРМАКОГЕНОМИКА Разработка ДНК-чипов, которые позволяют определять последовательности всех известных генов, определяющих фармакологический ответ
- 54. ВСЕ ЛЮДИ РАЗНЫЕ И НА ЛЕКАРСТВА ОНИ «ОТВЕЧАЮТ» ПО-РАЗНОМУ! Стандартизированный подход на основе доказательной медицины (стандарты,
- 55. ДОКЛАДЫ НА ТЕМУ «ПЕРСОНАЛИЗИРОВАННАЯ МЕДИЦИНА» 1. Основные понятия персонализированной медицины. Индивидуализированная, прецизионная, предиктивная, стратифицированная. Этапы становления
- 57. Скачать презентацию


































 Здоровое сердце - путь к долгой жизни
Здоровое сердце - путь к долгой жизни РЕВМАТОЛОГИЯ - МЕТОДИКА
РЕВМАТОЛОГИЯ - МЕТОДИКА Нарушения кровообращения и лимфообращения
Нарушения кровообращения и лимфообращения Перфузия миокарда при метаболическом синдроме
Перфузия миокарда при метаболическом синдроме Вич-инфекция в отоларингологии
Вич-инфекция в отоларингологии Санаторий Сосны в Республике Беларусь
Санаторий Сосны в Республике Беларусь Седативные препараты. Фаб концепция
Седативные препараты. Фаб концепция Жедел Аппендициттің атипиялық түрлері
Жедел Аппендициттің атипиялық түрлері Эстрогены при беременности. Назначение Off Label
Эстрогены при беременности. Назначение Off Label Ребенок 0-3 мес
Ребенок 0-3 мес Псевдоопухоль головного мозга
Псевдоопухоль головного мозга Рефлекторная деятельность новорожденного
Рефлекторная деятельность новорожденного Department of Visual diagnostics Radiological research methods and radiological semiotics of acquired diseases
Department of Visual diagnostics Radiological research methods and radiological semiotics of acquired diseases Использование средств нормированного страхового запаса территориального фонда обязательного медицинского страховани
Использование средств нормированного страхового запаса территориального фонда обязательного медицинского страховани Нарушения обоняния
Нарушения обоняния Компенсаторно-приспособительные процессы
Компенсаторно-приспособительные процессы ТЕРМИНАЛЬНЫЕ СОСТОЯНИЯ
ТЕРМИНАЛЬНЫЕ СОСТОЯНИЯ Здоровый образ жизни
Здоровый образ жизни Нейрокоррекционный и психотерапевтический подход к процессу реабилитации управляющих функций
Нейрокоррекционный и психотерапевтический подход к процессу реабилитации управляющих функций Разработка базы данных – информационная система больницы
Разработка базы данных – информационная система больницы ThinPrep® Pap Test Diagnostic Challenges and Differential
ThinPrep® Pap Test Diagnostic Challenges and Differential Некоммерческое партнерство. Агентство поддержки медицинских учреждений
Некоммерческое партнерство. Агентство поддержки медицинских учреждений Деменция при соматических патологиях
Деменция при соматических патологиях Сестринская помощь при ревматоидном полиартрите
Сестринская помощь при ревматоидном полиартрите Гонорея. Определение. Семинар № 3
Гонорея. Определение. Семинар № 3 Осторожно, грипп
Осторожно, грипп Синдром сухого глаза
Синдром сухого глаза Пост. Процедурный кабинет
Пост. Процедурный кабинет