Содержание
- 2. Актуальность Теория экологических групп Крыжановского является обобщающей рыб С. Г. в экологической эмбриологии рыб и важна
- 3. Цель и задачи Цель работы – углубить и закрепить теоретические знания о специфике строения половых клеток,
- 4. Определение понятия Фитофилы – рыбы, которые размножаются среди растений, откладывают свою икру в стоячей или слаботекущей
- 5. Некоторые виды рыб – представители фитофильной группы К пресноводным фитофилам относят: сазан, лещ, плотва, линь, щука,
- 6. Некоторые виды рыб – представители фитофильной группы Рис. 1 – Фото сазана (лат. Cyprinus carpio).
- 7. Рис. 2 – Фото линя (лат. Tinca tinca).
- 8. Рис. 3 – Фото речного окуня (лат. Perca fluviatilis).
- 9. Рис. 4 – Фото атерины южноевропейской (лат. Atherina boyeri).
- 10. Икра некоторых фитофильных рыб Рис. 5 – Фото кладки икры фитофильной рыбы – скалярии.
- 11. Рис. 6 – Фото кладки икры речного окуня.
- 12. Морфологические признаки икры (на примере обыкновенного карпа) Икра обыкновенного карпа имеет зеленоватый цвет, очень клейкая, так
- 13. Рис. 7 – Фото икринок обыкновенного карпа.
- 14. Особенности строения яйцевых оболочек фитофилов Строение яйцевых оболочек рыб тесно связано с экологией их нереста. Наиболее
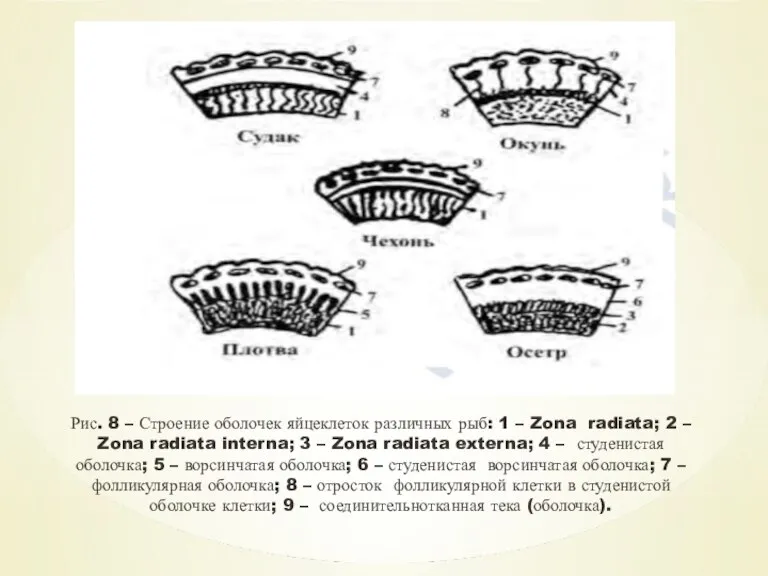
- 15. Очень сложно построены оболочки у осетровых. У них имеются две лучистые зоны – внутренняя и внешняя
- 16. Рис. 8 – Строение оболочек яйцеклеток различных рыб: 1 – Zona radiata; 2 – Zona radiata
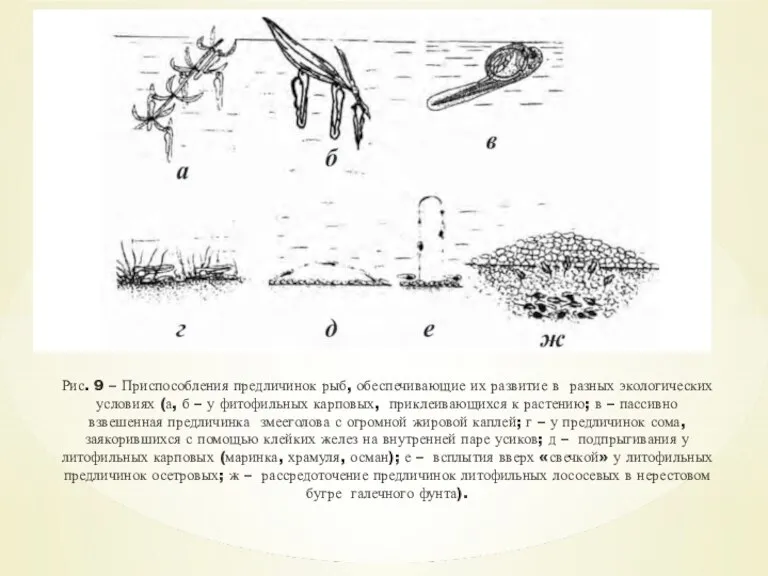
- 17. Приспособления к развитию у предличинок фитофильных рыб Для вылупившихся предличинок фитофильных рыб характерен способ развития в
- 18. Рис. 9 – Приспособления предличинок рыб, обеспечивающие их развитие в разных экологических условиях (а, б –
- 19. Биотехника выращивания фитофильных рыб (на примере карповых) Основные этапы искусственного воспроизводства : Выбор будущих производителей карпа
- 20. 3. Получение и осеменение икры карпа Получать половые продукты начинают через 18-20 часов после разрешающей инъекции.
- 21. 4. Обесклеивание икры После осеменения икру нужно обесклеить. Для этого можно использовать препарат ПАС-Г, порошок талька,
- 22. 5. Инкубация икры карпа Наиболее распространенным аппаратом для инкубации икры карпа является аппарат Вейса. Инкубацию икры
- 23. 6. Выдерживание предличинок карпа Вылупление эмбрионов карпа, инкубируемых в аппаратах Вейса, проходит на рамках, устанавливаемых в
- 24. 7. Подращивание личинок карпа Более удобны в эксплуатации для подращивания личинок карпа – бассейны. Они компактны
- 25. Важным направлением является разработка рецептов искусственных кормов, заменяющих полностью или частично живые корма. Разработано много рецептов
- 26. 8. Выращивание сеголеток карпа Технология получения стандартных сеголетков карпа в выростных прудах включает следующие процессы: подготовку
- 27. Классификация способов размножения (гильдий) у круглоротых и рыб (по Е. К. Балону)
- 28. Классификация способов размножения (гильдий) у круглоротых и рыб (по Е. К. Балону) (продолжение)
- 29. Классификация способов размножения (гильдий) у круглоротых и рыб (по Е. К. Балону) (продолжение)
- 30. Заключение В процессе выполнения данной работы ознакомились с особенностями эмбрионального и постэмбрионального развития рыб фитофильной группы.
- 32. Скачать презентацию



























 Расследование в Сказочной Австралии
Расследование в Сказочной Австралии Виховна толерантність
Виховна толерантність Развитие грамматического строя речи у детей дошкольного старшего возраста с ОНР
Развитие грамматического строя речи у детей дошкольного старшего возраста с ОНР Сержант Армейкин приглашает
Сержант Армейкин приглашает lapbuk
lapbuk Кот на прогулке. Систематизация знаний детей об осени и осенних явлениях
Кот на прогулке. Систематизация знаний детей об осени и осенних явлениях Пальчиковая гимнастика
Пальчиковая гимнастика Масленица
Масленица Родительское собрание. Подготовка будущего первоклассника к школе
Родительское собрание. Подготовка будущего первоклассника к школе Аппликация Совушка
Аппликация Совушка Закладка для книги Коала
Закладка для книги Коала Августовский педагогический форум
Августовский педагогический форум Оценочная ситуация на уроке математики в 1 классе по теме Числа 1-10. Нумерация
Оценочная ситуация на уроке математики в 1 классе по теме Числа 1-10. Нумерация Проектная деятельность в детском саду. По программе Детство
Проектная деятельность в детском саду. По программе Детство С Днём Защитника Отечества
С Днём Защитника Отечества Вагон
Вагон Аттестационная работа. Методика ознакомления с жанровой живописью детей старшего дошкольного возраста
Аттестационная работа. Методика ознакомления с жанровой живописью детей старшего дошкольного возраста Уроки мира. Мир глазами детей!
Уроки мира. Мир глазами детей! Новогодние игрушки на конусе
Новогодние игрушки на конусе Мастер-класс – одна из эффективных форм распространения передового педагогического опыта
Мастер-класс – одна из эффективных форм распространения передового педагогического опыта Мои цели
Мои цели Ярославская студенческая весна
Ярославская студенческая весна История игры. Урок для 1 класса
История игры. Урок для 1 класса Весенняя викторина
Весенняя викторина Природа в творчестве человека. 1 класс
Природа в творчестве человека. 1 класс Мама - главное слово в каждой судьбе
Мама - главное слово в каждой судьбе Дөньяда песиләрне иң нык яратучы кеше
Дөньяда песиләрне иң нык яратучы кеше Для чего животным нужны хвосты?
Для чего животным нужны хвосты?