Содержание
- 2. Подходы к анализу производных барбитуровой кислоты
- 3. Приказ по МЗ СССР г.Москва № 1021 от 25 декабря 1973г «О введении нового перечня токсикологических
- 4. Барбитураты - 5,5'-дизамещенные производные барбитуровой кислоты. Атом азота в положении 1 может метилироваться, (метилфенобарбитала), а замещение
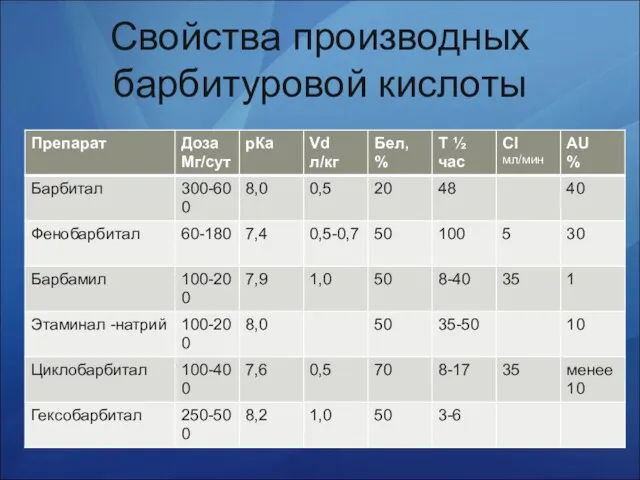
- 5. Свойства производных барбитуровой кислоты
- 6. Свойства. Барбитураты плохо растворяются в воде, хорошо растворимы в этаноле, хлороформе, эфире, в водных растворах щелочей.
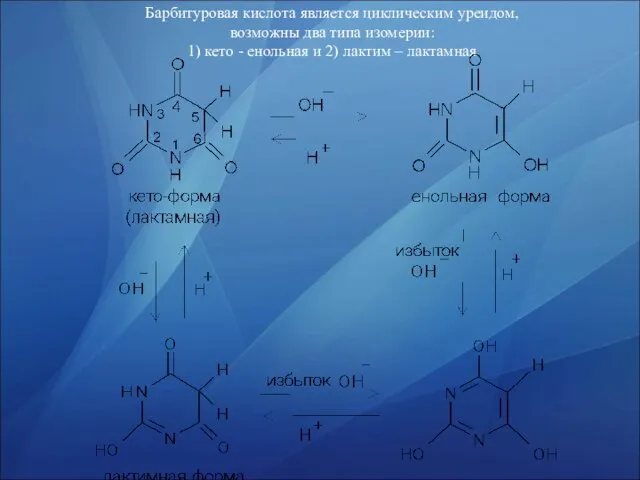
- 7. Барбитуровая кислота является циклическим уреидом, возможны два типа изомерии: 1) кето - енольная и 2) лактим
- 8. Основные характеристические частоты ИК-спектров барбитуратов (см-1): –NH– (деформационные) 1680–1693; С=O (валентные) 1712–1725; –CONH–(валентные) 1744–1770; =C–N– (валентные)
- 9. Биотрансформация Фенобарбитал – 1. N-глюкозилирование по азоту в 1. 2. окисление фенольного фрагмента в пара-положении и
- 10. Биотрансформация Барбамил – 1. конъюг. с глюкуроновой кислотой по азоту в 1. 2. Окисление в радикале
- 11. Выделение Общие методы (Васильевой, Стасса-Отто) – кислое хлороформенное извлечение. Частные методы: Метод Валова (подщелоченой водой) Метод
- 12. Метод Валова 100 г измельченного биологического материала, + 180 мл воды и 20 мл 10 %-го
- 13. Обнаружение барбитуратов Цветные и микрокристаллические реакции ТСХ в частных системах ИК и УФ спектроскопия Иммунно-ферментный анализ
- 14. Цветные реакции Реакция барбитуратов с изопропиламином и солями кобальта.(Парри) (фиолетовое окрашивание) Реакция с солями кобальта и
- 15. Микрокристаллические реакции Выделение кислотной формы барбитуратов. На предметное стекло наносят несколько капель раствора барбитурата в хлороформе,
- 16. УФ спектроскопия К сухому остатку, полученному при выпаривании вытяжек из биологического материала или лекарственных форм, прибавляют
- 18. ФЭК – метод Поповой Сухие остатки барбитуратов, растворяют в хлороформе или в метиловом спирте. Сухие остатки
- 19. ТСХ Сорбент – силикагель КСК, забуференный 0,1н раствором борной кислоты. Растворители – хлороформ:н-бутанол:25% раствор аммиака (70:40:5)
- 20. ВЭЖХ Детекция - 240нм Сорбент – ODS Элюэнт – смесь метанол – р-р фосфата аммония Количественное
- 21. ГЖХ Дериватизация - получение ацетилпроизводных по реакции с уксусным ангидридом в безводном растворителе (пиридине): Внутрений стандарт.
- 22. Подходы к анализу производных 1,4 бенздиазепина
- 23. Приказ по МЗ СССР г.Москва № 1021 от 25 декабря 1973г «О введении нового перечня токсикологических
- 24. 1,4 Бенздиазепины Доступность Высокий терапевтический индекс Широкий спектр действия Меньшее количество побочных эфектов Высока частота случаев
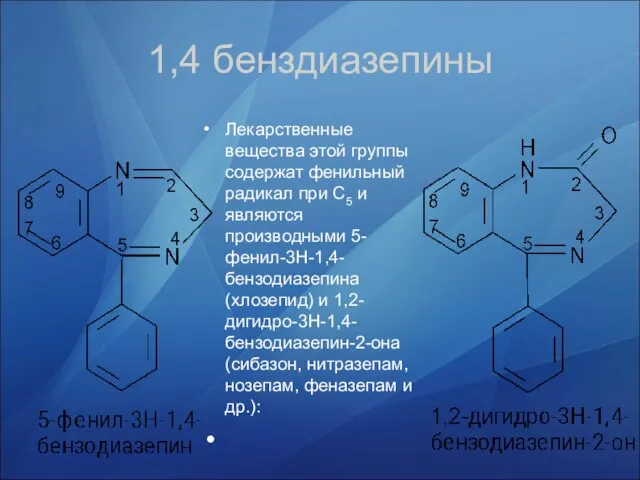
- 25. Лекарственные вещества этой группы содержат фенильный радикал при С5 и являются производными 5-фенил-3Н-1,4-бензодиазепина (хлозепид) и 1,2-дигидро-3Н-1,4-бензодиазепин-2-она
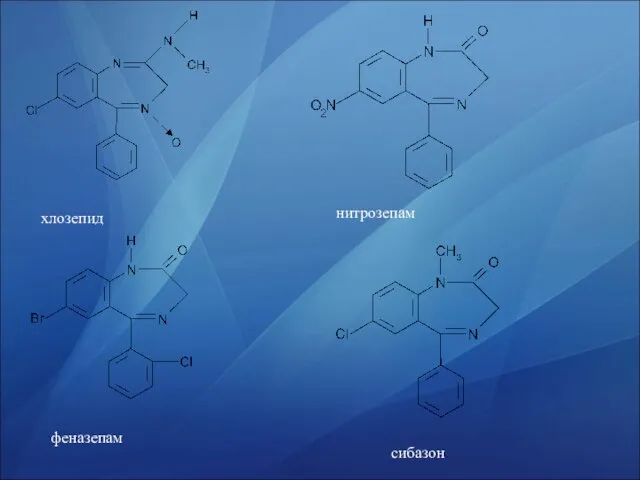
- 26. хлозепид нитрозепам феназепам сибазон
- 27. Свойства Растворимость. Большинство 1,4-бенздиазепинов представляют собой бесцветные, хорошо кристаллизующиеся вещества. Практически нерастворимы в воде, растворимы в
- 28. Свойства Кислотно-основные свойства 1,4-бенздиазепины являются слабыми основаниями. Основность увеличивается при наличии основных заместителей. Так, хлордиазепоксид дает
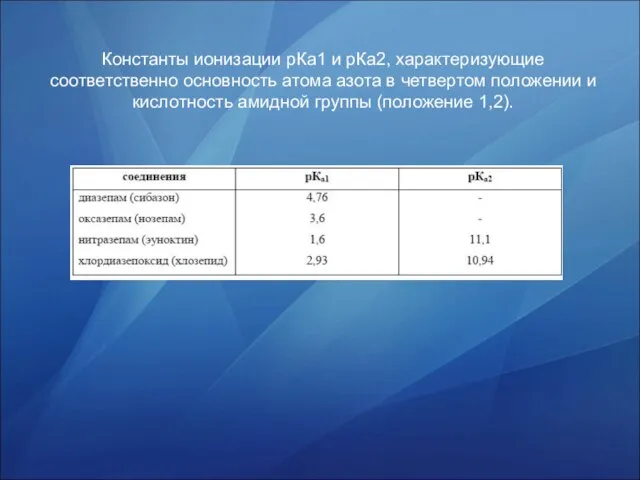
- 29. Константы ионизации рКа1 и рКа2, характеризующие соответственно основность атома азота в четвертом положении и кислотность амидной
- 30. УФ - спектры В электронных спектрах производных 1,4-бенздиазепина имеется 3 полосы поглощения с λmax в областях:
- 31. Тосикокинетика Механизм всасывания - простая диффузия. Попадая в кровь, на 80-95% связываются с белками плазмы, поэтому
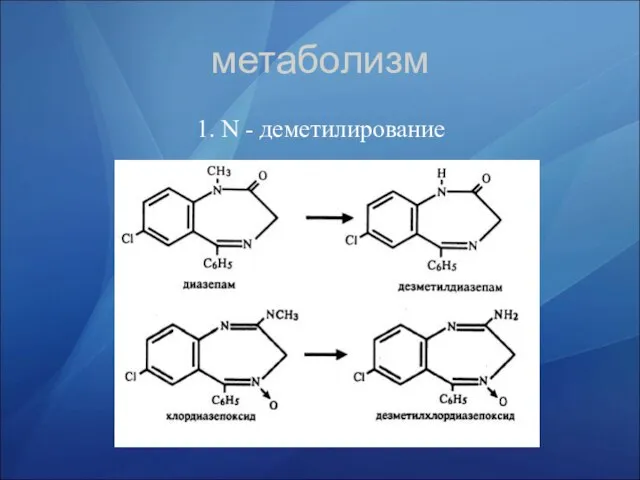
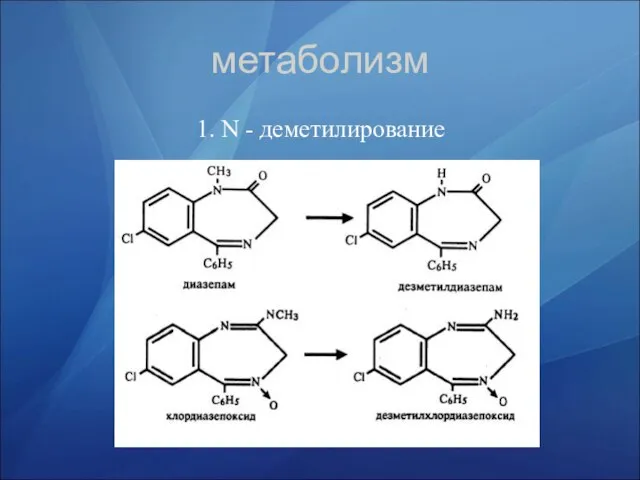
- 32. метаболизм 1. N - деметилирование
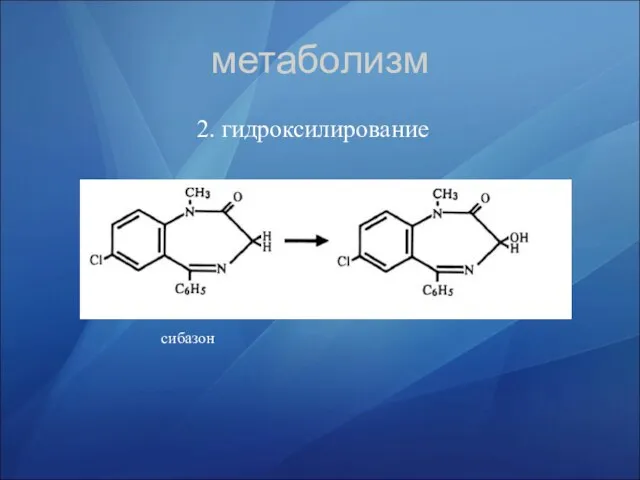
- 33. метаболизм 2. гидроксилирование сибазон
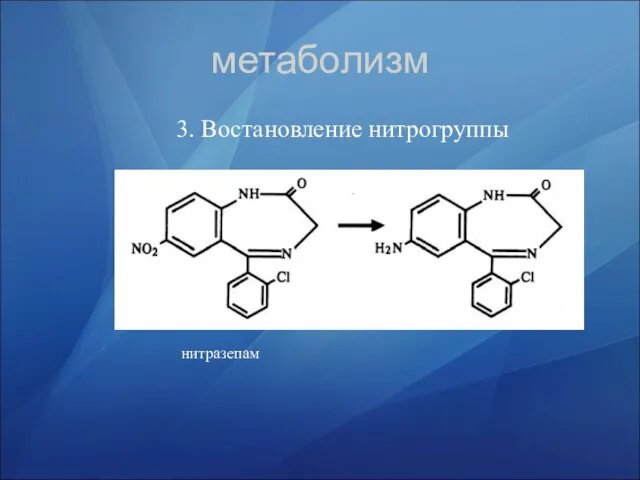
- 34. метаболизм 3. Востановление нитрогруппы нитразепам
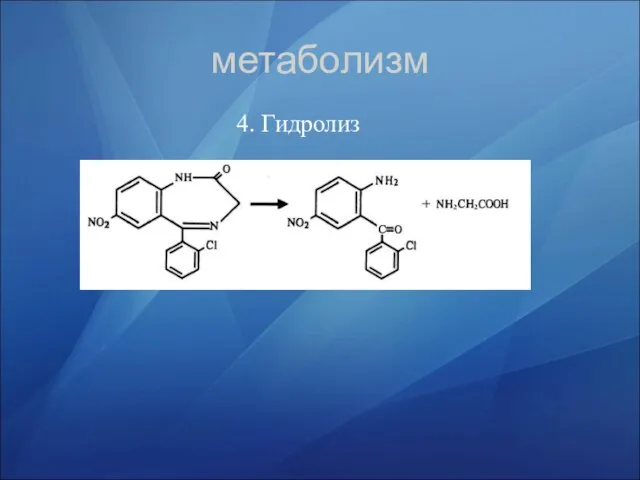
- 35. метаболизм 4. Гидролиз
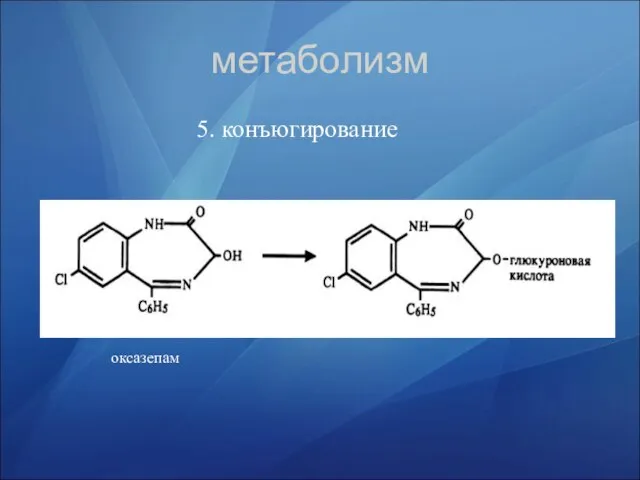
- 36. метаболизм 5. конъюгирование оксазепам
- 37. метаболизм 1. N - деметилирование
- 38. Метаболиты, образованные в результате процессов окисления и восстановления, фармакологически активны. Наибольшей активностью обладают метаболиты, полученные в
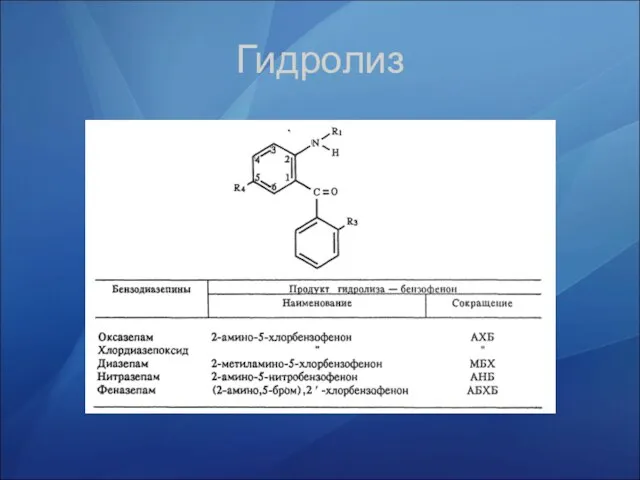
- 39. Гидролиз
- 41. Скачать презентацию


























 Практическая работа Металлургия РФ по
Практическая работа Металлургия РФ по 8 марта в детском саду (фотографии)
8 марта в детском саду (фотографии) Новогодний филворд
Новогодний филворд Эко стиль в нордическом интерьере
Эко стиль в нордическом интерьере Россия в XVII-XVIII век
Россия в XVII-XVIII век Презентация на тему Луч и угол 7 класс
Презентация на тему Луч и угол 7 класс Линейная парная регрессия
Линейная парная регрессия  Методические аспекты проведения ОВОС объектов гидроэнергетики Корнеев В.Н. , Гертман Л.Н. РУП «Центральный научно-исследовательс
Методические аспекты проведения ОВОС объектов гидроэнергетики Корнеев В.Н. , Гертман Л.Н. РУП «Центральный научно-исследовательс Генрих IV
Генрих IV Витамины
Витамины МБОУ Школа №7 для обучающихся с ОВЗ. Визитная карточка команды Берёзки
МБОУ Школа №7 для обучающихся с ОВЗ. Визитная карточка команды Берёзки Motywacja osiągnięć
Motywacja osiągnięć Вода. Знакомая незнакомка
Вода. Знакомая незнакомка Опыт проектирования и строительства СТК для объектов сталеплавильного производства. Вопросы энергоэффективности.
Опыт проектирования и строительства СТК для объектов сталеплавильного производства. Вопросы энергоэффективности. Торговый дом Милк Трейд
Торговый дом Милк Трейд Особенности уголовного законодательства федеративных государств (на примере США, Канады, Австралии)
Особенности уголовного законодательства федеративных государств (на примере США, Канады, Австралии) Библейские фразеологизмы
Библейские фразеологизмы Seminar 1 (3)
Seminar 1 (3) Влияние природы на здоровье человека
Влияние природы на здоровье человека Презентация на тему Загрязнение атмосферы
Презентация на тему Загрязнение атмосферы  Файловая система.Основные понятия
Файловая система.Основные понятия Применение метода мандалы в психокоррекционной и диагностической работе с дошкольниками
Применение метода мандалы в психокоррекционной и диагностической работе с дошкольниками Презентация на тему Семь чудес света. Александрийский маяк
Презентация на тему Семь чудес света. Александрийский маяк  В8 ЕГЭ
В8 ЕГЭ Временно исполняющий обязанности
Временно исполняющий обязанности 10 Нейминговых решений
10 Нейминговых решений Tony Ray-Jones (photographer)
Tony Ray-Jones (photographer) Горные породы. Образование горных пород
Горные породы. Образование горных пород