Содержание
- 2. ЛЕКАРСТВЕННЫЕ СРЕДСТВА Оригинальные Инновационные Брендовые Воспроизведенные Дженерики Генерики Биоаналоги Копии и т.д.
- 3. «Оригинальный» или «инновационный» ЛП (бренд) Ранее неизвестный и впервые выпущенный на рынок фирмой-разработчиком лекарственный препарат, прошедший
- 4. Воспроизведеныый препарат или дженерик (от англ. generic – родовой) Непатентованный лекарственный препарат, являющийся воспроизведением оригинального препарата,
- 5. Права больных В 2004 году ВОЗ приняла резолюцию, провозгласившую приоритетной задачей увеличение безопасности лечения. Этим решением
- 6. Права больных Информированное согласие предполагает, в том числе, право пациента знать какие препараты (оригинальные или воспроизведенные)
- 7. Приказ Минздрава России от 20 декабря 2012 года N 1175н "Об утверждении порядка назначения и выписывания
- 8. Доля дженериков в объеме лекарственных препаратов на фармацевтическом рынке Россия 61-90 % Франция – 50 %
- 9. Рынок дженериков в России Некоторые оригинальные препараты имеют огромное количество дженериков: Более 100 дженериков нифедипина 120
- 10. Дженерики в РФ низкого качества Субстанции из мало доступных для контроля стран (Китай, Индия) Поставки через
- 11. Влияние дженериков низкого качества на здоровье популяции Резистентность бактерий, вирусов и грибов к антимикробным препаратам Хронизация
- 12. Влияние дженериков низкого качества на здоровье популяции Австралия, 2003 г.: 250 000 побочных эффектов ЛС 50
- 13. Опасность лечения некачественными ЛП Вероятность несчастного случая вследствие авиакатастрофы - 1:3 000 000 Вследствие лечения -
- 14. Как отличить дженерики от оригинальных препаратов В России отсутствуют источники информации, позволяющие идентифицировать дженерики, присутствующие на
- 15. R & D компании Bayer GlaxoSmithKline Pfizer MSD Sanofi-Aventis Bristol-Myers Squibb Novartis Schering-Plough Abbott Novo Nordisk
- 16. Стоимость оригинальных препаратов Стоимость оригинальных препаратов значительно выше, чем дженериков. Фирмы-разработчики формируют более высокие цены на
- 17. Стоимость оригинальных препаратов На создание оригинального препарата требуется от 800 млн. до 1,5 млрд. долларов Только
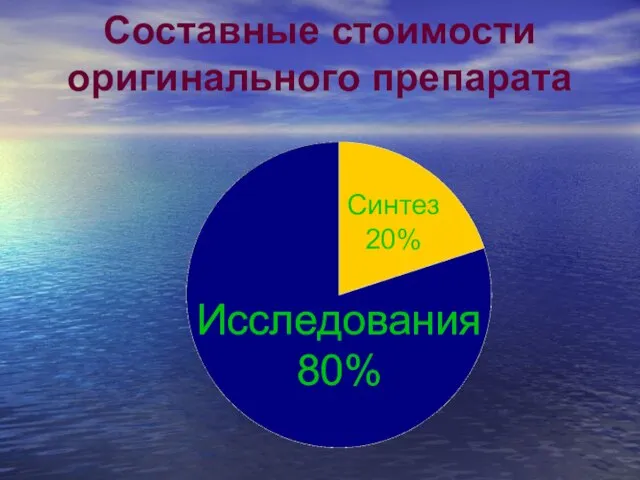
- 18. Составные стоимости оригинального препарата Исследования 80% Синтез 20%
- 19. Стоимость дженериков При производстве дженериков 50 % стоимости составляет активная субстанция Для снижения цены конечного продукта
- 20. Оригинальные препараты От синтеза нового лекарственного вещества до срока окончания действия патента проходит в среднем 35-40
- 21. Оригинальные препараты Первый этап – доклинические исследования (фармакологические, аналитические, фармакокинетические, биофармацевтические, технологические и др.) Второй этап
- 22. Оригинальные препараты Разрабатываются, изучаются и производятся в соответствии с требованиями международных стандартов - - Правила GLP
- 23. Правила GLP Определяют условия и процесс проведения доклинических исследований, включающий планирование, выполнение, контроль и регистрацию, позволяя
- 24. Клинические исследования В первой фазе устанавливают: переносимость безопасность фармакокинетические и фармакодинамические характеристики терапевтическое действие исследуемого лекарственного
- 25. Клинические исследования Целью второй фазы является доказать клиническую эффективность лекарственного средства при испытании на группе пациентов
- 26. Клинические исследования В третьей фазе определяют: эффективность и безопасность лекарственного средства устанавливают характер и частоту побочных
- 27. Клинические исследования Четвертая фаза клинических испытаний проводится после получения разрешения на медицинское применение препарата. Устанавливают новые
- 28. Правила GMP Единая система требований по организации технологических процессов и контрольных испытаний промежуточных и конечных продуктов
- 29. Основной принцип GMP «Избегать дефектов, а не обнаруживать их в готовой продукции»
- 30. Суть правил GMP Делать все как положено (согласно нормативной документации) Не допускать загрязнений Использовать только качественные
- 31. Правила GMP Соблюдение этих требований является гарантией того, что лекарственное средство Изготовлено в соответствии с его
- 32. Внедрение стандартов GMP в России В РФ 525 отечественных фармацевтических предприятий, из них только 10 соответствуют
- 33. GMP в России (2010 год) Из 1100 фармпредприятий 10 % оборудованы в соответствии со стандартами GMP
- 34. Фармпредприятия в РФ, работающие по стандартам GMP «Нижфарм» «Хемофарм» «Макиз-Фарма» «Петровакс-Фарм» «Сотекс» ЗиО-Здоровье (ГК Actavis) Из
- 35. Фармпредприятия в РФ, имеющие участки, оборудованные по стандартам GMP «Фармстандарт» «Верофарм» Из доклада Е.А.Тельновой на конференции
- 36. GMP в России Приказ Минпромторга России от 14 июня 2013 г. № 916 «ОБ УТВЕРЖДЕНИИ ПРАВИЛ
- 37. Дженерики Термин дженерик возник в 70-е годы ХХ века В то время дженерики должны были называться
- 38. Дженерики Сегодня по внешним признакам отличить оригинальный препарат от дженерика невозможно В Бразилии для распознавания дженерика
- 39. Полная информация о ЛП на рынке США Сведения о лекарственных препаратах общедоступны В Интернете - таблицы
- 40. “Orange Book” Кодом «А» обозначены дженерики, которые можно использовать наравне с оригинальными препаратами (терапевтически эквивалентны и
- 41. “Orange Book” Кодом «В» обозначены дженерики, которые нельзя считать терапевтически эквивалентными оригинальному препарату Соколов А.В. и
- 42. Оригинальные препараты и дженерики Для оценки качества, эффективности, безопасности и адекватной замены установлены три вида эквивалентности:
- 43. Фармацевтическая эквивалентность Фармацевтически эквивалентные лекарственные препараты содержат одинаковые активные ингредиенты в одинаковой лекарственной форме, предназначены для
- 44. Биоэквивалентность Биоэквивалентные лекарственные препараты – это фармацевтически эквивалентные или фармацевтически альтернативные препараты, обладающие сопоставимой биологической доступностью,
- 45. Биологическая доступность «Биологическая доступность – это степень, в которой лекарственное вещество всасывается из места введения в
- 46. Показатели биодоступности максимальная концентрация активной субстванции в плазме крови (Сmax) время достижения этой концентрации в крови
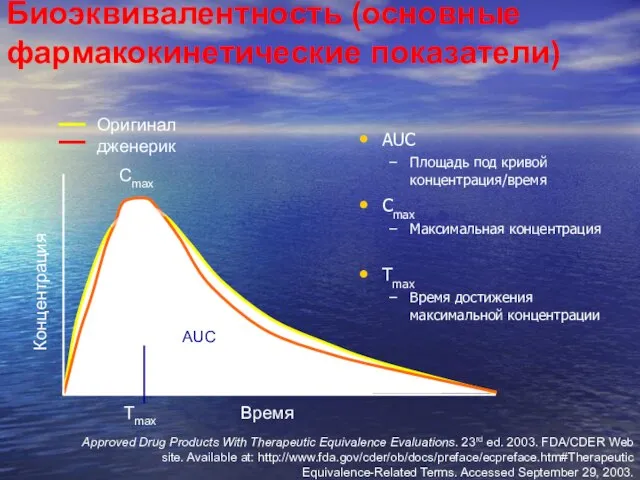
- 47. Биоэквивалентность (основные фармакокинетические показатели) AUC Площадь под кривой концентрация/время Cmax Максимальная концентрация Tmax Время достижения максимальной
- 48. Биоэквивалентность Препараты считаются биоэквивалентными, если границы доверительного интервала дженерика в 90 % случаев для Cmax находятся
- 49. Биоэквивалентность В России в 2004 г. утверждены правила «Проведение качественных исследований биоэквивалентности лекарственных средств» Содержание действующего
- 50. Правила регистрации дженериков в РФ упрощены. Не учитываются: Состав вспомогательных веществ Содержание токсичных примесей Содержание продуктов
- 51. В 2000 году проведена проверка биоэквивалентности по стандартам Американской фармакопеи ного 40 дженериков кларитромицина из 13
- 52. Кларитромицин и его дженерики Результаты проверки: из 70 % дженериков действующее вещество высвобождалось значительно медленнее 20
- 53. Биоэквивалентность – это не гарантия, а предположение терапевтической эквивалентности и безопасности ЛП
- 54. Терапевтическая эквивалентность Терапевтическая эквивалентность, согласно Европейским и Американским определениям, предусматривает кроме сходного фармакинетического профиля еще и
- 55. Терапевтическая эквивалентность Дженерик терапевтически эквивалентен другому препарату, если он по результатам клинических исследований обладает такой же
- 56. Терапевтическая эквивалентность В 1998 году FDA был опубликован проект правил оценки терапевтической эквивалентности дженериков. Было предложено
- 57. Опрос врачей в Израиле 61 % врачей назначают дженерики, исходя из экономических соображений 73 % считают,
- 58. Биологические препараты (высокомолекулярные соединения) Биосимиляры (Biosimilar) Каждый биопрепарат (гормоны, вакцины, ферменты, факторы свертывания крови и пр.)
- 59. ФАРМАЦЕВТИЧЕСКИЕ ФАКТОРЫ Физическое состояние ЛВ (размер частиц, форма кристаллов, наличие или отсутствие заряда на поверхности частиц
- 60. Технологические или производственные процессы Очистка Сушка Измельчение Перекристаллизация Способ грануляции Давление прессования таблеток Плотность масс в
- 61. Вспомогательные вещества Растворители Основы для мазей Основы для суппозиториев Основы для присыпок Основы для разбавления порошков
- 62. Вспомогательные вещества Вещества для покрытий Поверхностно-активные вещества Вещества, увеличивающие вязкость Вещества, сохраняющие влажность Корригирующие вещества Красители
- 63. Типы взаимодействия в системе ЛВ – вспомогательное вещество Образование водородных связей Силы Ван-дер-Ваальса Ковалентные связи Т.С.Кондратьева
- 64. Результат взаимодействия между лекарственными и вспомогательными веществами Реакции комплексообразования Реакции адсорбции Оказывают влияние на: биологическую доступность;
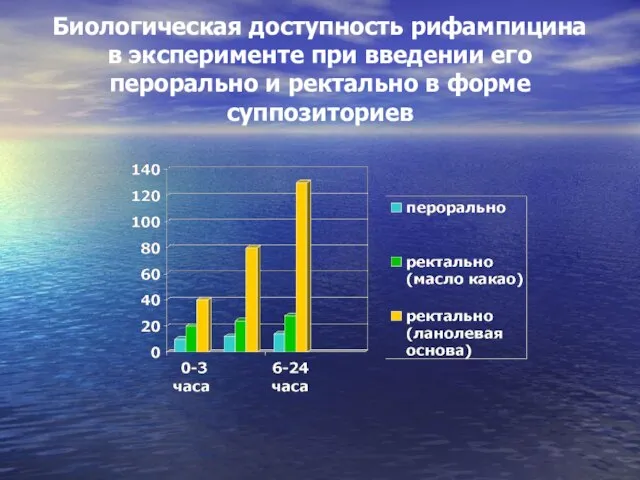
- 65. Биологическая доступность рифампицина в эксперименте при введении его перорально и ректально в форме суппозиториев
- 66. Единственный оригинальный флуконазол, рекомендованный ВОЗ для лечения кандидозного вульвовагинита (молочницы)5
- 67. Формы выпуска Дифлюкана Дифлюкан капсулы 150 мг №1, №4 и № 12 Дифлюкан капсулы 50 мг
- 68. Дифлюкан В процессе изучения Дифлюкана было проведено 28 клинических испытаний в 19 странах мира приняли участие
- 69. Дженерики Дифлюкана (30) Дифлузол Микофлюкан Медофлюкон Фунголон Нофунг Флукозан Проканазол Флукомицид Флюмикон Флуконазол-Верте Флузол Флуконазол-КФ Флукозид
- 70. Дженерики Дифлюкана в РФ Дифлазон (KRKA, Словения) Флюкостат (Фармстандарт, Россия) Микосист (Gedeon Richter, Венгрия) Флуконазол (Hemofarm,
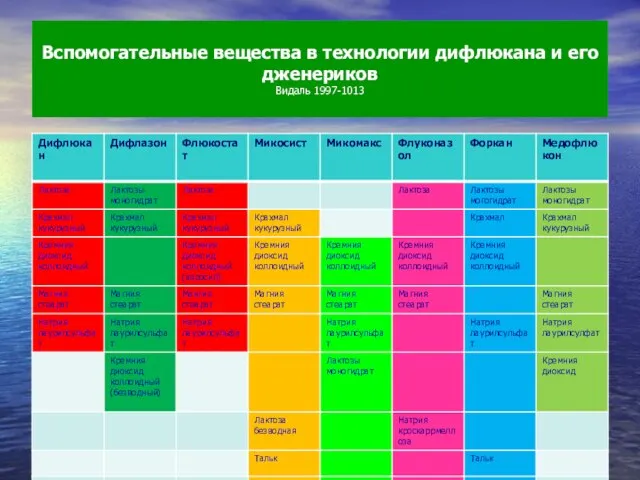
- 71. Вспомогательные вещества в технологии дифлюкана и его дженериков Видаль 1997-1013
- 72. Сравнение фунгицидной активности различных препаратов, содержащих флуконазол (in vitro ) НИИ медицинской микологии им.П.Н.Кашкина, С.Петербург Метод
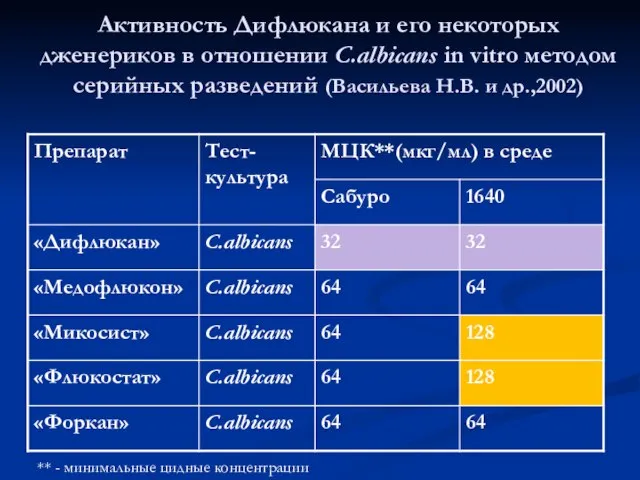
- 73. Активность Дифлюкана и его некоторых дженериков в отношении C.albicans in vitro методом серийных разведений (Васильева Н.В.
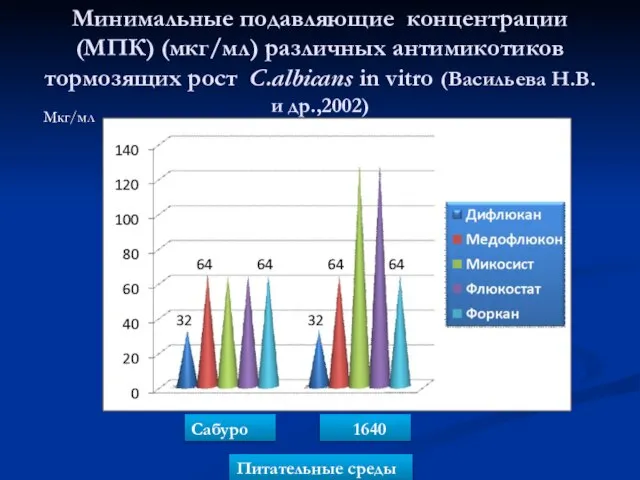
- 74. Минимальные подавляющие концентрации (МПК) (мкг/мл) различных антимикотиков тормозящих рост C.albicans in vitro (Васильева Н.В. и др.,2002)
- 75. Оценка эффективности Дифлюкана и его дженериков в опытах in vitro НИИ вакцин и сывороток им. И.И.
- 76. Музейные штаммы дрожжей Candida albicans (ВКПМ Y-3108) Candida glabrata (КБП 3049) Candida рarapsilosis (КБП 3050) Эксперименты
- 77. Метод измерения зон ингибиции роста дрожжей (Луночно-диффузионный метод, МУК 4.2. 1890-04)
- 78. Дифлюкан и дженерики Во всех случаях была установлена наибольшая активность Дифлюкана – оригинального препарата Т.М.Желтикова, А.М.
- 79. Дифлюкан®. Фармакоэкономика. Цель : изучение клинической и экономической эффективности Дифлюкана и некоторых его дженериков при лечении
- 80. Фармакоэкономическое исследование Дизайн исследования: проспективное, сравнительное, рандомизированное. В исследование вошло 330 пациенток, которые были разделены на
- 81. Результаты клинической эффективности: Критерий: отсутствие каких-либо жалоб, клинических симптомов и нормализация лабораторных показателей. у 98,4% пациенток,
- 82. Цена в аптеках г.Москвы различных препаратов, содержащих флуконазол (150 мг) на 19.11.13 www.aptekamos.ru
- 83. Сроки годности капсул Дифлюкана и его дженериков Дифлюкан – 5 лет Флюкостат – 2 года Микосист
- 85. Скачать презентацию












































































 Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк)
Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк) Особенности истории информатики
Особенности истории информатики Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты
Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты = 1
= 1 Изустная среда мордовского села
Изустная среда мордовского села Показатели рыночной активности
Показатели рыночной активности Выхухоль. Красная книга
Выхухоль. Красная книга Обработка текстовой и графической информации. Создаём комбинированный документ
Обработка текстовой и графической информации. Создаём комбинированный документ Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год
Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке
Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке Туалетная вода для мужчин Faberlic Intense
Туалетная вода для мужчин Faberlic Intense Межпроцедурные анализы и оптимизации
Межпроцедурные анализы и оптимизации Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны
Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны Урок 3 Человек и Бог в православии-повторение
Урок 3 Человек и Бог в православии-повторение 17 век
17 век ПЕРЕГОВОРЫ
ПЕРЕГОВОРЫ Изготовление вечернего платья
Изготовление вечернего платья Теорiя iгор
Теорiя iгор  Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс аня хочет санчо панчо
аня хочет санчо панчо Создание таблиц в Microsoft Word
Создание таблиц в Microsoft Word Teenagers’ society problems
Teenagers’ society problems Воля познавать
Воля познавать Любимое блюдо моей семьи
Любимое блюдо моей семьи Ладья. Урок №8
Ладья. Урок №8 Описательные характеристики распределения тестовых результатов
Описательные характеристики распределения тестовых результатов Презентация на тему Одиночество
Презентация на тему Одиночество Ich gehe mit meine Laterne
Ich gehe mit meine Laterne