Содержание
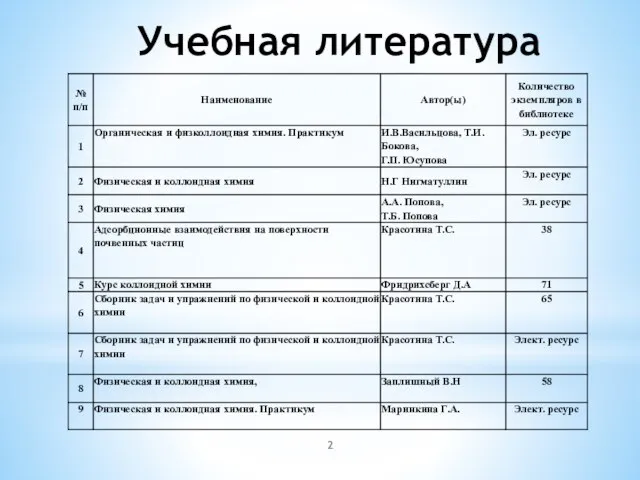
- 2. Учебная литература
- 3. Физическая химия- это теоретическая химия, которая рассматривает общие законы, определяющие химические процессы, а именно направление химических
- 4. Химическая термодинамика- это наука, которая изучает превращения различных видов энергии при химических реакциях, а также исследует
- 5. Основные понятия: 1. Термодинамическая система - это тело или совокупность тел, мысленно обособленных от окружающей среды.
- 6. 2. Термодинамический процесс- изменение состояние системы, которое характеризуется изменением ее термодинамических параметров. Выделяют следующие термодинамические процессы:
- 7. 4. Внутренняя энергия ( U) - сумма потенциальной энергии взаимодействия всех частиц тела между собой и
- 8. Первое начало термодинамики Существует несколько формулировок: 1. В любой изолированной системе общий запас энергии остается постоянным
- 9. В химической термодинамике рассматривается работа только против сил внутреннего давления (работа расширения): ∂W=pΔV Применение I-ого начала
- 10. Тепловые эффекты химических реакций. Закон Гесса Если процесс протекает при постоянном объеме или давлении, при этом
- 11. Следствия из закона Гесса Следствия из закона Гесса - это расчет теплового эффекта химической реакции по
- 12. Тепловой эффект химической реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов
- 13. Значение закона Гесса: 1) расчет тепловых эффектов химических реакций, не определяя экспериментально; 2) позволяет вычислять тепловые
- 14. Второе начало термодинамики Первое начало термодинамики не дает ответы на вопрос в каком направлении и до
- 15. Для математической записи второго начала термодинамики ввели дополнительную термодинамическую величину. Такой термодинамической функцией состояния системы является
- 16. Энтропия является мерой неупорядоченности системы. Такие процессы как плавление, растворение испарение, химические реакции, идущие с увеличением
- 17. Свободная энергия и направление химических процессов Критерием направленности самопроизвольных процессов при Р,Т= const учитывающий энтальпийную и
- 19. Скачать презентацию















 ТУЛЬСКИЙ ФИЛИАЛ С 20 ИЮНЯ 2012 ГОДА ОСУЩЕСТВЛЯЕТ НАБОР ПО ПРОГРАММАМ БАКАЛАВРИАТА.
ТУЛЬСКИЙ ФИЛИАЛ С 20 ИЮНЯ 2012 ГОДА ОСУЩЕСТВЛЯЕТ НАБОР ПО ПРОГРАММАМ БАКАЛАВРИАТА. Комп’ютерні телекомунікації в системі загальної середньої освіти
Комп’ютерні телекомунікації в системі загальної середньої освіти Арт-студия фантазия МБУ ДО Калейдоскоп
Арт-студия фантазия МБУ ДО Калейдоскоп Команда N&J. 4 неделя
Команда N&J. 4 неделя Брестская крепость
Брестская крепость За́мок для сказочного героя
За́мок для сказочного героя 90 лет Энергетическому техникуму
90 лет Энергетическому техникуму Факторы, влияющие на скорость химических реакций
Факторы, влияющие на скорость химических реакций Презентация на тему Русская икона
Презентация на тему Русская икона  Стандартный вид числа
Стандартный вид числа Процесс и его компоненты
Процесс и его компоненты  Подземная разработка месторождений полезных ископаемых. Специальности МАГУ
Подземная разработка месторождений полезных ископаемых. Специальности МАГУ ОБУЧЕНИЕ ГРАМОТЕ в 1 классе
ОБУЧЕНИЕ ГРАМОТЕ в 1 классе Vegetables (1-2ой год обучения)
Vegetables (1-2ой год обучения) Коллекция эфирных масел Священного писания
Коллекция эфирных масел Священного писания Идеи для рукоделия. Пуговицы + фантазия. Подборка креативных идей нетрадиционного использования пуговиц
Идеи для рукоделия. Пуговицы + фантазия. Подборка креативных идей нетрадиционного использования пуговиц Декларация на товары
Декларация на товары Программа создания национального домена .РФ на основе кириллицы Андрей Колесников АНО «Координационный центр национального доме
Программа создания национального домена .РФ на основе кириллицы Андрей Колесников АНО «Координационный центр национального доме Нормативные документы по ОАШ и Образовательному округу на базе ОАШ, принятые в 2011 году
Нормативные документы по ОАШ и Образовательному округу на базе ОАШ, принятые в 2011 году АУЕ или новая опасная молодёжная субкультура в России
АУЕ или новая опасная молодёжная субкультура в России What language do dolphins speak?
What language do dolphins speak? Организация СП, СПТ, П
Организация СП, СПТ, П Материал и образ. Скрутим куклу ладную, милую нарядную
Материал и образ. Скрутим куклу ладную, милую нарядную Королева Речь
Королева Речь Презентация на тему Что такое биоинформатика?
Презентация на тему Что такое биоинформатика? 1900-1916 история
1900-1916 история Усуни и канглы
Усуни и канглы Государственное устройство. Международные регионы. Лекция 12
Государственное устройство. Международные регионы. Лекция 12