Содержание
- 2. Тема урока "Строение атома и его электронных оболочек». Цель урока: сформировать у учащихся понятия о строении
- 3. Актуализация знаний: а) Как на опыте показать, что электрический заряд делится на части? б) Можно ли
- 4. В 1903г. английский физик Джозеф Джон Томсон предложил одну из первых моделей строения атома.
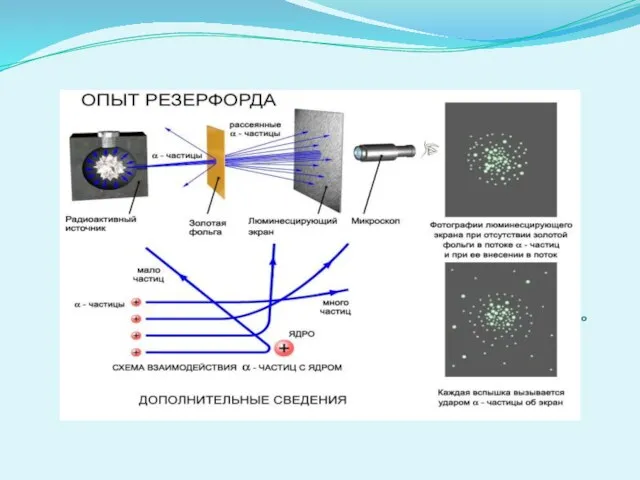
- 5. Модель строения атома Томсона нуждалась в экспериментальной проверке Поэтому в 1911 г. Резерфорд совместно со своими
- 6. °
- 7. Резерфорд предложил ядерную («планетарную») модель атома: * атомы любого элемента состоят из положительно заряженной части, получившей
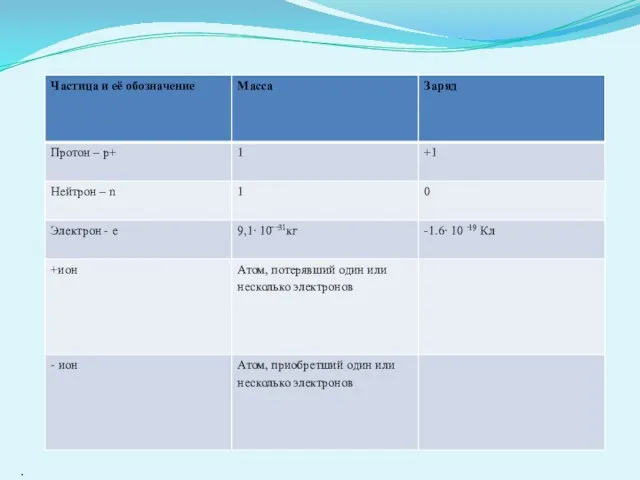
- 8. .
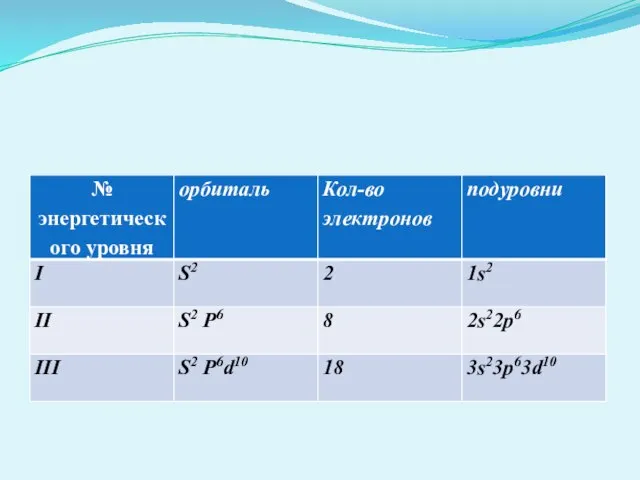
- 9. Максимальное число электронов на энергетическом уровне. I ___ 2 II_______ 8 III___________18 Число энергетических уровней равно
- 11. Обобщение изученного материала. В ядре атома углерода содержится 12 частиц. Вокруг ядра движутся 6 электронов. Сколько
- 13. Скачать презентацию







 Паспорт місця митного оформлення
Паспорт місця митного оформлення Пирография
Пирография 20141110_prezentatsiya_2
20141110_prezentatsiya_2 Проектирование дизайна организационной культуры на предприятии (на примере ООО Эльдорадо)
Проектирование дизайна организационной культуры на предприятии (на примере ООО Эльдорадо) Материалы к презентации для педагогического совета «Взаимодействие ДОУ и семьи» Выполнила Лупейкене Наталия А
Материалы к презентации для педагогического совета «Взаимодействие ДОУ и семьи» Выполнила Лупейкене Наталия А Зимние виды спорта
Зимние виды спорта Презентация1
Презентация1 Десерт Зимняя сказка
Десерт Зимняя сказка Ипотека в России: смена трендов
Ипотека в России: смена трендов Нравственно-патриотическое восприятие дошкольников в процессе взаимодействия с семьями воспитанников
Нравственно-патриотическое восприятие дошкольников в процессе взаимодействия с семьями воспитанников Тайна усыновления
Тайна усыновления Современные материалы в интерьере
Современные материалы в интерьере My dream town
My dream town ПРЕОДОЛЕВАЯ РАССТОЯНИЯ
ПРЕОДОЛЕВАЯ РАССТОЯНИЯ Разрешение конфликтной ситуации.
Разрешение конфликтной ситуации. Human Ecology and Anthropogenic Pressure
Human Ecology and Anthropogenic Pressure Живопись на Руси в 15 - 16 веках
Живопись на Руси в 15 - 16 веках Путешествие по материкам (2 класс)
Путешествие по материкам (2 класс) Тематический апперцептивный тест
Тематический апперцептивный тест Вижу цель – иду к ней
Вижу цель – иду к ней Принципы построения комплексных систем автоматики на железной дороге
Принципы построения комплексных систем автоматики на железной дороге Педагогическое взаимодействие в основе «школы без агрессии»
Педагогическое взаимодействие в основе «школы без агрессии» Древние способы сохранения и передачи информации
Древние способы сохранения и передачи информации Taonga Test CG Generalist Brief
Taonga Test CG Generalist Brief Теоретические основы денежно-кредитного регулирования
Теоретические основы денежно-кредитного регулирования Как зарабатывать на сверхдоходном токене - Biruza каждые 2 месяца по 500%
Как зарабатывать на сверхдоходном токене - Biruza каждые 2 месяца по 500% Стратегія розвитку LG
Стратегія розвитку LG Презентация на тему Примеры моделирования
Презентация на тему Примеры моделирования