Содержание
- 2. Первый закон термодинамики – закон сохранения энергии Энергия не возникает из ничего и не исчезает бесследно,
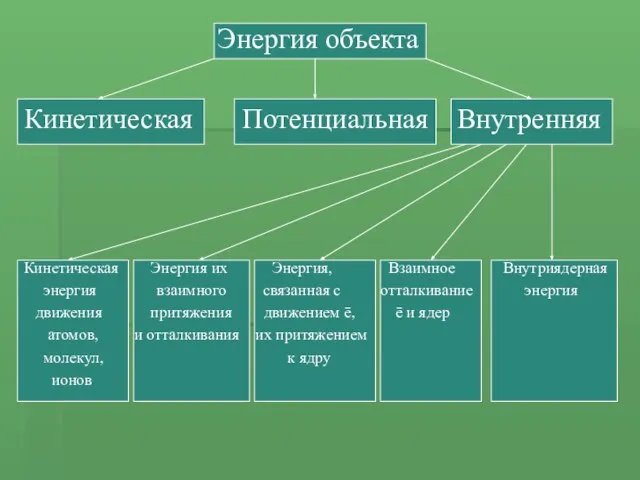
- 3. Энергия объекта Кинетическая Потенциальная Внутренняя Кинетическая Энергия их Энергия, Взаимное Внутриядерная энергия взаимного связанная с отталкивание
- 4. Е реагентов > Е продуктов Энергия выделяется в окружающую среду Реакции, при которых выделяется энергия и
- 5. Е реагентов Энергия поглощается из окружающей среды, температура системы понижается Реакции, при протекании которых энергия поглощается
- 6. Энергия, которая выделяется или поглощается в химической реакции, называется тепловым эффектом реакции. Тепловой эффект реакции выражается
- 7. Для расчета тепловых эффектов реакций используют значения величин теплот образования исходных веществ и продуктов реакции Теплота
- 8. Закон Гесса (1840) Тепловой эффект химической реакции не зависит от промежуточных стадий (при условии, что исходные
- 9. Следствие из закона Гесса Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус
- 10. Fe2O3 + 2Al = 2Fe + Al2O3 + Qр По справочнику: Qобр(Al2O3) = 1670 кДж/моль Qобр(Fe2O3)
- 11. Энтальпия (теплосодержание) – это величина, которая характеризует запас энергии в веществе. ΔH = ΣHпродукты – ΣHреагенты
- 12. Движущая сила реакций Для экзотермических реакций – стремление системы к состоянию с наименьшей внутренней энергией. Для
- 14. Выводы Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии и стремлением к увеличению
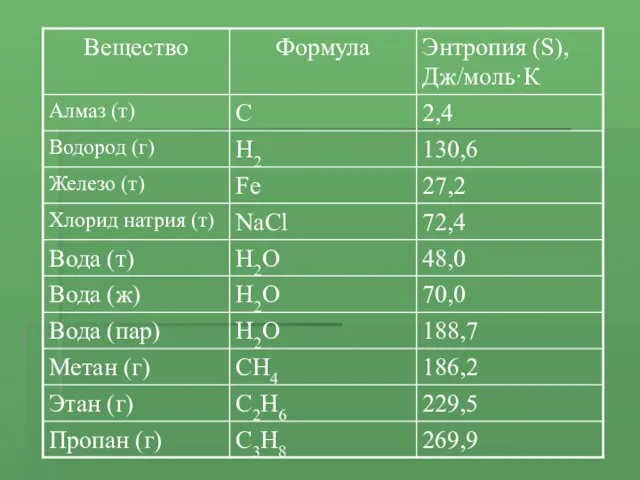
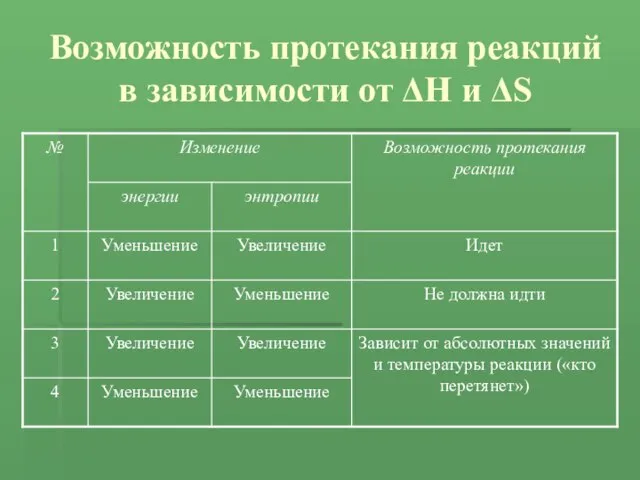
- 15. Возможность протекания реакций в зависимости от ΔH и ΔS
- 17. Скачать презентацию







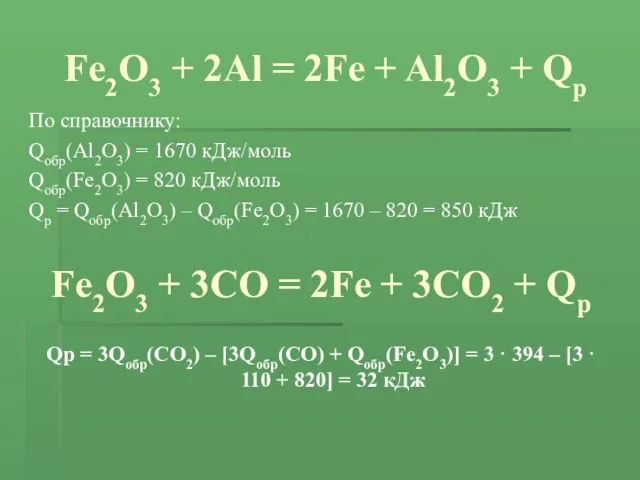



 Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк)
Денежные переводы физических лиц: состояние и тенденции развития (на примере ПАО Сбербанк) Особенности истории информатики
Особенности истории информатики Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты
Мотивирование топ-менеджеров в банковской сфере: подходы и инструменты = 1
= 1 Изустная среда мордовского села
Изустная среда мордовского села Показатели рыночной активности
Показатели рыночной активности Выхухоль. Красная книга
Выхухоль. Красная книга Обработка текстовой и графической информации. Создаём комбинированный документ
Обработка текстовой и графической информации. Создаём комбинированный документ Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год
Телевидение: я выбираю или меня выбирают. Автор и руководитель проекта: Симонова Ольга Владимировна 2004 год Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке
Что я сделаю, чтобы доверенный мне магазин стал лучшим на рынке Туалетная вода для мужчин Faberlic Intense
Туалетная вода для мужчин Faberlic Intense Межпроцедурные анализы и оптимизации
Межпроцедурные анализы и оптимизации Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны
Внешняя политика СССР в 1930-е гг. и накануне Великой Отечественной войны Урок 3 Человек и Бог в православии-повторение
Урок 3 Человек и Бог в православии-повторение 17 век
17 век ПЕРЕГОВОРЫ
ПЕРЕГОВОРЫ Изготовление вечернего платья
Изготовление вечернего платья Теорiя iгор
Теорiя iгор  Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс
Презентация на тему Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс аня хочет санчо панчо
аня хочет санчо панчо Создание таблиц в Microsoft Word
Создание таблиц в Microsoft Word Teenagers’ society problems
Teenagers’ society problems Воля познавать
Воля познавать Любимое блюдо моей семьи
Любимое блюдо моей семьи Ладья. Урок №8
Ладья. Урок №8 Описательные характеристики распределения тестовых результатов
Описательные характеристики распределения тестовых результатов Презентация на тему Одиночество
Презентация на тему Одиночество Ich gehe mit meine Laterne
Ich gehe mit meine Laterne