Слайд 2Цель урока:
1. на основе положения металлов в ПСХЭ прийти к пониманию

особенностей строения их атомов и кристаллов (металлической химической связи и кристаллической металлической решетки).
2.Обобщить и расширить знания о физических свойствах металлов и их классификаций.
3. Развивать умение анализировать, делать выводы исходя из положения металлов в периодической системе химических элементов.
Слайд 3МЕДЬ
Иду на мелкую монету,
В колоколах люблю звенеть,
Мне ставят памятник за это
И знают:

имя мое-….
Слайд 4ЖЕЛЕЗО
Пахать и строить -
все он может,
если ему уголек в том

поможет…
Слайд 5Металлы – это группа веществ с общими свойствами.

Слайд 6Металлами являются элементы I – III групп главных подгрупп, и IV-VIII групп
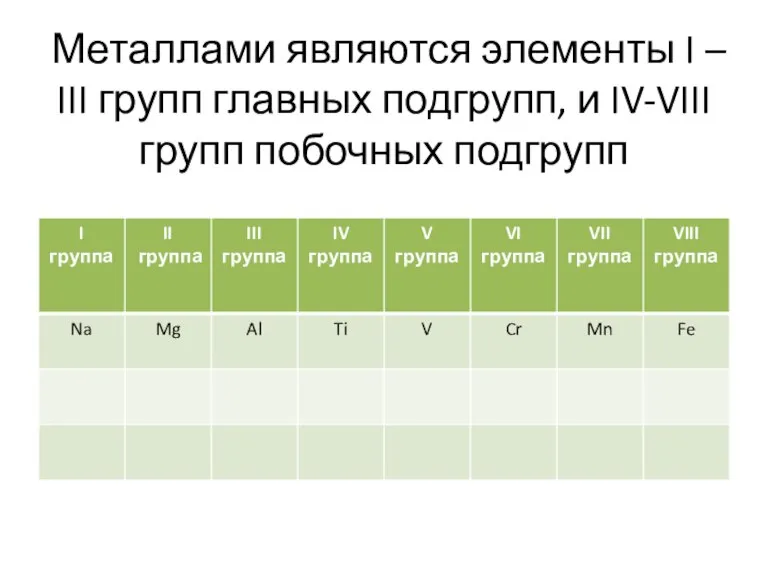
побочных подгрупп
Слайд 7Из 109 элементов ПСХЭ 85 являются металлами: выделены голубым, зелёным и розовым
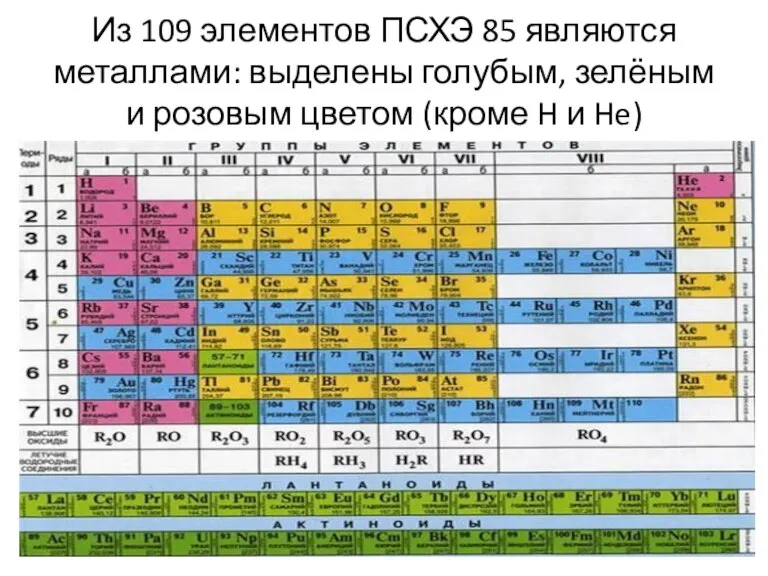
цветом (кроме H и He)
Слайд 8Положение элемента в ПС отражает строение его атомов

Слайд 10Электронное строение атома натрия
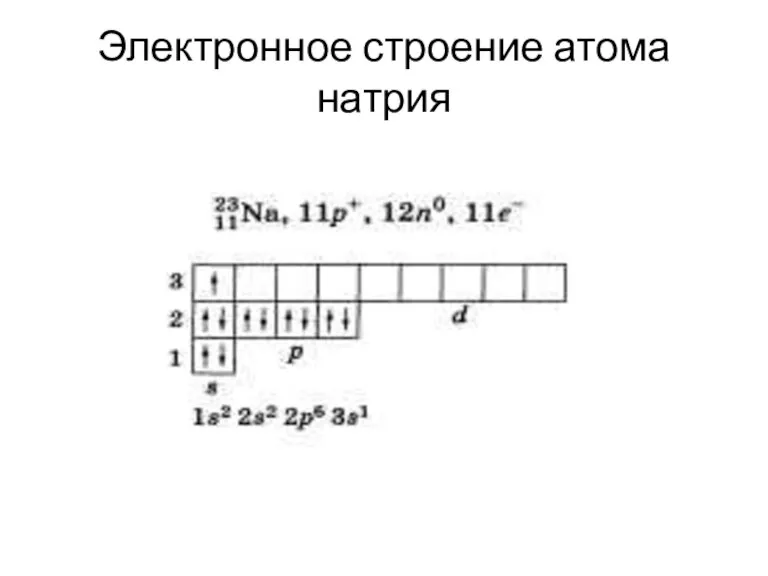
Слайд 11Задание 2.
Составьте схему электронного строения атома алюминия и кальция в тетради самостоятельно

по примеру с атомом натрия.
Слайд 12Вывод:
1. Металлы– элементы, имеющие на внешнем энергетическом уровне 1-3 электрона, реже

4-6.
2. Металлы – это химические элементы атомы которых отдают электроны внешнего (а иногда предвнешнего) электронного слоя превращаясь в положительные ионы. Металлы – восстановители. Это обусловлено небольшим числом электронов внешнего слоя, большим радиусом атомов, вследствие чего эти электроны слабо удерживаются с ядром.
Слайд 13Металлическая химическая связь характеризуется:
- делокализацией связи, т.к. сравнительно небольшое количество электронов одновременно

связывают множество ядер;
- валентные электроны свободно перемещаются по всему куску металла, который в целом электронейтрален;
- металлическая связь не обладает направленностью и насыщенностью.
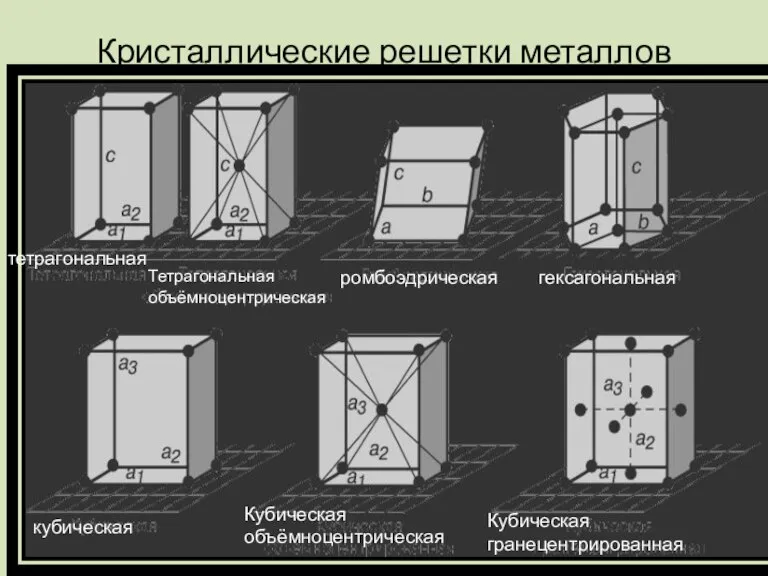
Слайд 14Кристаллические решетки металлов
тетрагональная
Тетрагональная объёмноцентрическая
ромбоэдрическая
гексагональная
кубическая
Кубическая объёмноцентрическая
Кубическая гранецентрированная
Слайд 15Видеоинформация о кристаллах металлов

Слайд 16Свойства металлов определяются строением их атомов.

Слайд 17Проверьте усвоение знаний на уроке тестированием



















 Отчет
Отчет ГЕОГРАФИЯ
ГЕОГРАФИЯ Школа музыки GUITARDO
Школа музыки GUITARDO Презентация на тему Русская икона. Древнерусская живопись
Презентация на тему Русская икона. Древнерусская живопись Прочитай загадку, найди отгадку
Прочитай загадку, найди отгадку Два художника (Дружба Чехова и Левитана)
Два художника (Дружба Чехова и Левитана) Спирты
Спирты Презентация на тему Час общения «Времена года»
Презентация на тему Час общения «Времена года» Презентация на тему Платоники и Элидо-эритрийская школа
Презентация на тему Платоники и Элидо-эритрийская школа Стратегия муниципальных выборов в новой реальности
Стратегия муниципальных выборов в новой реальности Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ
Презентация на тему Этические правила служебного поведения и проф. служебной деятельности гос. гражданских служащих РФ  НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ КАК ПРЕДМЕТ Васильева Анна Сергеевна зав. сектором электронного каталога отдела научной обработки ф
НАИМЕНОВАНИЕ ОРГАНИЗАЦИИ КАК ПРЕДМЕТ Васильева Анна Сергеевна зав. сектором электронного каталога отдела научной обработки ф Презентация на тему Правила поведения на железной дороге (3 класс)
Презентация на тему Правила поведения на железной дороге (3 класс) ПОЛОЖЕНИЕ о выборах членовМолодежного парламентаМО «Увинский район»
ПОЛОЖЕНИЕ о выборах членовМолодежного парламентаМО «Увинский район» Мастер-класс Изготовление театральной куклы
Мастер-класс Изготовление театральной куклы The Family Law
The Family Law  Бойко Алесандра
Бойко Алесандра Elektron sənəd. Dövri̇yyəsi̇ si̇stemi̇
Elektron sənəd. Dövri̇yyəsi̇ si̇stemi̇ Правовые дебаты: «ЗА» и «ПРОТИВ»
Правовые дебаты: «ЗА» и «ПРОТИВ» Благотворительная программа «Подарим детям сказку»
Благотворительная программа «Подарим детям сказку» ЛУГАНСКАЯ ОБЛАСТЬ, УКРАИНА
ЛУГАНСКАЯ ОБЛАСТЬ, УКРАИНА Направления современной живописи
Направления современной живописи Натрий
Натрий Электронная физкультминутка boom-boom
Электронная физкультминутка boom-boom Царь Иван Грозный
Царь Иван Грозный Размещение рекламы в ВУЗах РФ
Размещение рекламы в ВУЗах РФ Психология общения Берн
Психология общения Берн «Моя математика» 1 класс
«Моя математика» 1 класс