Содержание
- 2. ОПЫТ 1. Получение негашеной извести СаО и ее гашение Оборудование и реактивы: Муфельная печь; алундовый тигель;
- 3. Выполнение опыта: Для получения негашеной извести, кусочек мела прокаливают в тигле при температуре муфельной печи 900
- 4. б) К кусочку негашеной извести в фарфоровой чашечке, добавляют избыток воды, содержимое перемешивают и отфильтровывают через
- 5. ОПЫТ 2. Качественные реакции на катионы кальция Оборудование и реактивы: Пробирки; Растворы 0,1н: оксалата аммония (NH4)2C2O4,
- 6. Выполнение опыта: 1) Оксалат аммония с ионами кальция образует белый осадок оксалата кальция. К небольшому количеству
- 7. 2) Раствор соды (карбонат натрия) с ионами кальция образует белый осадок. К небольшому количеству раствора хлорида
- 8. 3) Проведите качественные реакции на катионы кальция с растворами гашеной извести (полученной в опыте 1).
- 9. ОПЫТ 3. Определение температуры и времени гашения извести Оборудование и реактивы: Двустенный сосуд с теплоизоляционной прокладкой
- 10. Выполнение опыта: Реакция гашения извести протекает по уравнению: Берут навеску (m), расчитанную по формуле: где A
- 11. 2) Помещают навеску в колбу или стакан (3), которую устанавливают в двустенный сосуд (4) с теплоизоляционной
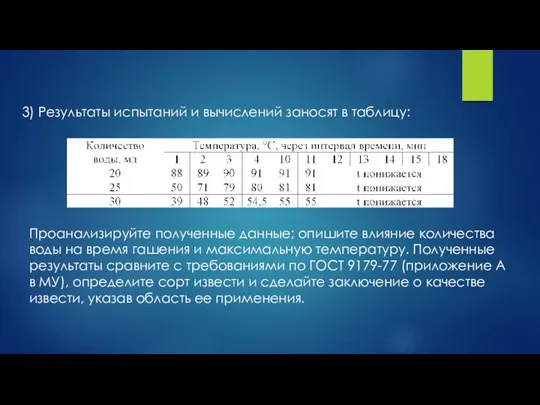
- 12. 3) Результаты испытаний и вычислений заносят в таблицу: Проанализируйте полученные данные; опишите влияние количества воды на
- 14. Скачать презентацию










 Infectious disease
Infectious disease Кто все эти люди?
Кто все эти люди? Атмосферное давление
Атмосферное давление Гигиенические требования к организации обучения детей 6-летнего возраста
Гигиенические требования к организации обучения детей 6-летнего возраста Реализация Бизнес-стратегии компании через системы управления деятельностью
Реализация Бизнес-стратегии компании через системы управления деятельностью Дорожная карта «Детство 2030»
Дорожная карта «Детство 2030» Презентация на тему Кукла из ниток
Презентация на тему Кукла из ниток Правило буравчика, левой и правой руки
Правило буравчика, левой и правой руки Vegetable Soup
Vegetable Soup All Eyes and Ears
All Eyes and Ears Радиостанции ТАКТ
Радиостанции ТАКТ Специальные налоговые режимы
Специальные налоговые режимы Число «Пи» вокруг нас
Число «Пи» вокруг нас Поэт Есенин
Поэт Есенин Атомная трагедия XX века
Атомная трагедия XX века Теоретические методы исследования
Теоретические методы исследования Формирование основных образовательных программ на основе ФГОС СПО и НПО нового поколения
Формирование основных образовательных программ на основе ФГОС СПО и НПО нового поколения Переход к предоставлению услуги «Предоставление информации об очередности предоставления жилых помещений на условиях социально
Переход к предоставлению услуги «Предоставление информации об очередности предоставления жилых помещений на условиях социально Кафедра географии, экологии и природопользования
Кафедра географии, экологии и природопользования Недвижимость как объект управления и оценки
Недвижимость как объект управления и оценки Информатика и информация
Информатика и информация «Стили детско-родительских отношений и формы личностной дезадаптации подростка».
«Стили детско-родительских отношений и формы личностной дезадаптации подростка». ИГРА
ИГРА Это надо знать
Это надо знать Презентация
Презентация Природные явления. Наводнения
Природные явления. Наводнения Становление герба Самарской губернии
Становление герба Самарской губернии Эрнест Миллер Хемингуэй
Эрнест Миллер Хемингуэй