Проведение клинических исследований в России: анализ ситуации после внедрения закона «Об обращении лекарственных средств» и перс
Содержание
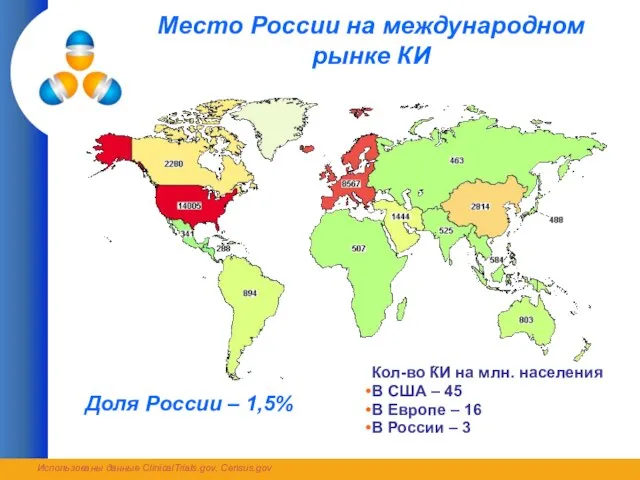
- 2. Место России на международном рынке КИ Кол-во КИ на млн. населения В США – 45 В
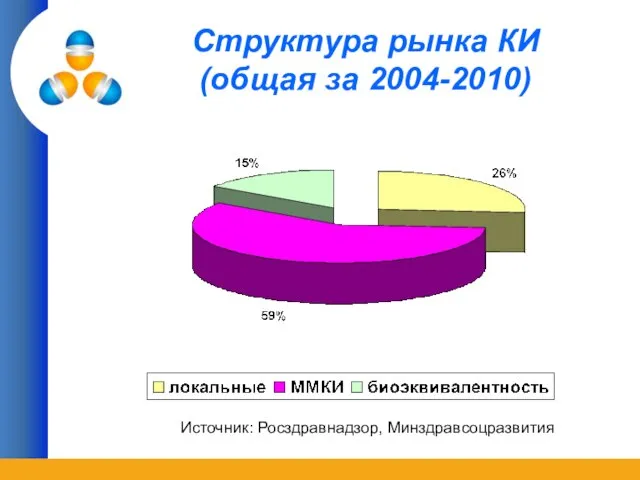
- 3. Структура рынка КИ (общая за 2004-2010) Источник: Росздравнадзор, Минздравсоцразвития
- 4. Качество ММКИ в России Данные основаны на 75 инспекциях FDA 1995 - 2010: No Actions Indicated
- 5. Фарма 2020: инновационное развитие фармацевтического сектора российской экономики
- 6. Минздравсоцразвития о ММКИ: Татьяна Голикова: …Мы никогда не были против того, что мы проводим международные многоцентровые
- 7. А за забором?
- 8. Закон от 12 апреля 2010 года № 61 ФЗ «Об обращении лекарственных средств»
- 9. Требование о проведении локальных КИ Задержка регистрации новых препаратов, в ММКИ которых Россия не участвовала; Практическая
- 10. Российский фармацевтический рынок – перспективы как они есть Требование о проведении локальных КИ
- 11. Перспективы «взаимного признания» Пункт 5 статьи 3 В РФ в соответствии с международными договорами РФ и
- 12. Ответ Еврокомиссии
- 13. Поручения Президента РФ от 02.06.2011 д) организовать проведение переговоров со странами Европейского союза и США в
- 14. Другие проблемы закона для рынка КИ Требования к PI – 5 лет опыта + специализация; Этическая
- 15. Год спустя Наши будни
- 16. Аккредитация: удалось избежать Областей аккредитации по «профилю деятельности» Привязки к опыту исследователей Требования о доп. проф.
- 17. Вывоз биообразцов: удалось избежать Разовое разрешение на каждое пересечение границы; Разрешение страны, куда вывозятся образцы; Подтверждение
- 18. Страхование: проблемы Списки пациентов с указанием персональных данных (проблема решена в новых Правилах, принятых 18.05.2011) Осталось:
- 19. Ввоз препаратов С октября 2010 г. - МЗСР отказывался выдавать разрешения на ввоз зарегистрированных препаратов для
- 20. Практические проблемы Не выполняются сроки выдачи разрешительных документов; Произошло сокращение количества исследователей; Не ведется надлежащим образом
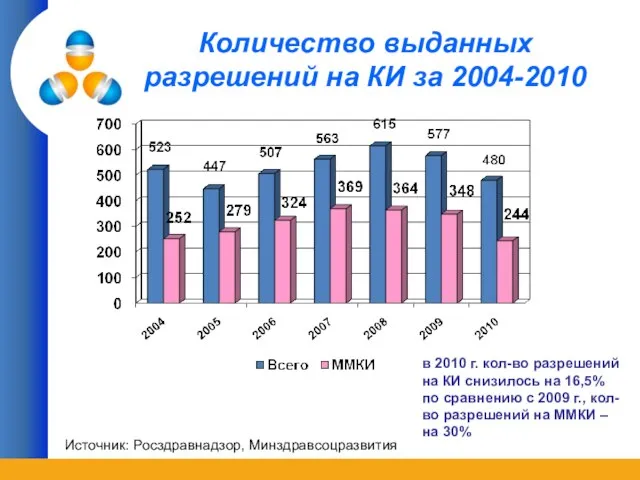
- 21. Количество выданных разрешений на КИ за 2004-2010 Источник: Росздравнадзор, Минздравсоцразвития в 2010 г. кол-во разрешений на
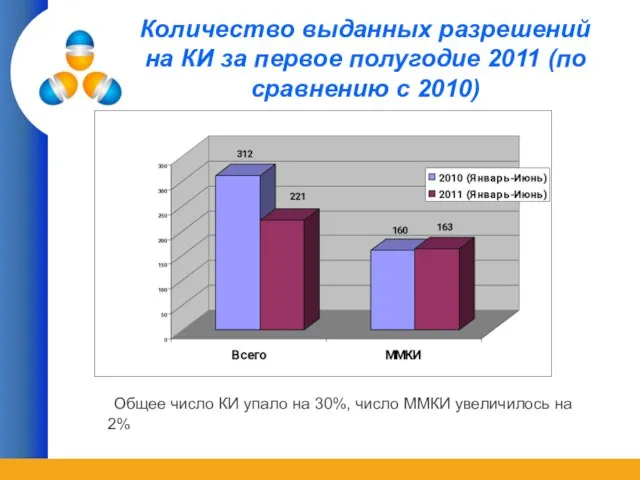
- 22. Количество выданных разрешений на КИ за первое полугодие 2011 (по сравнению с 2010) Общее число КИ
- 23. Факторы, влияющие на рынок ММКИ Соответствие нормативной правовой базы международным требованиям; Работа разрешительной системы (сроки выдачи
- 24. КИ в России завтра?
- 26. Скачать презентацию



















 Занятость и социальная защита населения
Занятость и социальная защита населения Дополнительный флакон с жидкостью от комаров на 45 ночей (без запаха) Эффективно уничтожает комаров в помещении в течение 45 ночей. В
Дополнительный флакон с жидкостью от комаров на 45 ночей (без запаха) Эффективно уничтожает комаров в помещении в течение 45 ночей. В 1929г
1929г ЧЕКАНКА ( тиснение по фольге)
ЧЕКАНКА ( тиснение по фольге) Тип Губки. Тип Кишечнополостные
Тип Губки. Тип Кишечнополостные Российские и международные гранты для молодых ученых:
Российские и международные гранты для молодых ученых: Основы философии
Основы философии Рейтинг надежности страховой компании: возможности и преимущества
Рейтинг надежности страховой компании: возможности и преимущества Командировка в восточное Оренбуржье
Командировка в восточное Оренбуржье Датчик
Датчик Копия Первые механизмы 4 года
Копия Первые механизмы 4 года Презентация на тему Советские деньги
Презентация на тему Советские деньги «О стратегии опережающего развития российской экономики в условиях глобальной нестабильности»19 марта 2012москва
«О стратегии опережающего развития российской экономики в условиях глобальной нестабильности»19 марта 2012москва Побег. Строение и значение
Побег. Строение и значение ОАО Туймазинский мясокомбинат
ОАО Туймазинский мясокомбинат Понятие о пищевых цепях и сетях. Экологические пирамиды
Понятие о пищевых цепях и сетях. Экологические пирамиды 1. Какой многоугольник называется правильным?
1. Какой многоугольник называется правильным? Организация системы управления предприятием ООО Автокрот+ в условиях неопределенности
Организация системы управления предприятием ООО Автокрот+ в условиях неопределенности Управление надежностью как инструмент достижения долгосрочных целей ОАО «ОГК-1»
Управление надежностью как инструмент достижения долгосрочных целей ОАО «ОГК-1» Монументальная скульптура и образ истории народа
Монументальная скульптура и образ истории народа Экслибрис. Виды экслибрисов
Экслибрис. Виды экслибрисов Анри Мари Раймон де Тулуз-Лотрек - французский живописец и график, один из ярчайших представителей постимпрессионизма
Анри Мари Раймон де Тулуз-Лотрек - французский живописец и график, один из ярчайших представителей постимпрессионизма НЕСТИ ДОБРО И РАДОСТЬ ДЕТЯМ!
НЕСТИ ДОБРО И РАДОСТЬ ДЕТЯМ! Программа обновления информации на сайте из файлов excel
Программа обновления информации на сайте из файлов excel ОМСКАЯ ОБЛАСТЬ
ОМСКАЯ ОБЛАСТЬ Оценка - aertalcream.ru
Оценка - aertalcream.ru Операції Європолу
Операції Європолу Языки программирования. Язык Паскаль.
Языки программирования. Язык Паскаль.