Содержание
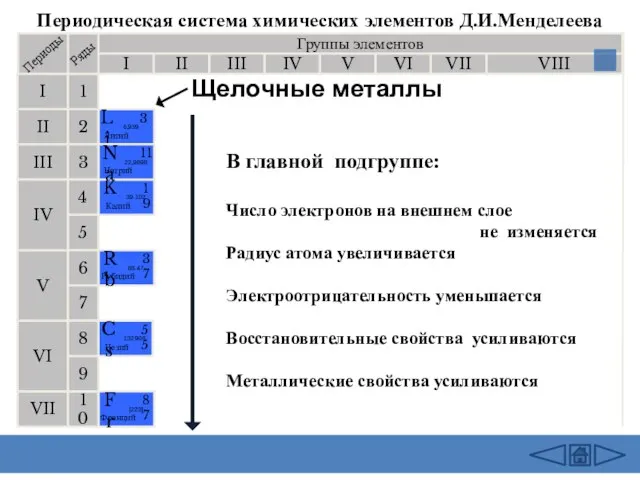
- 2. Щелочные металлы
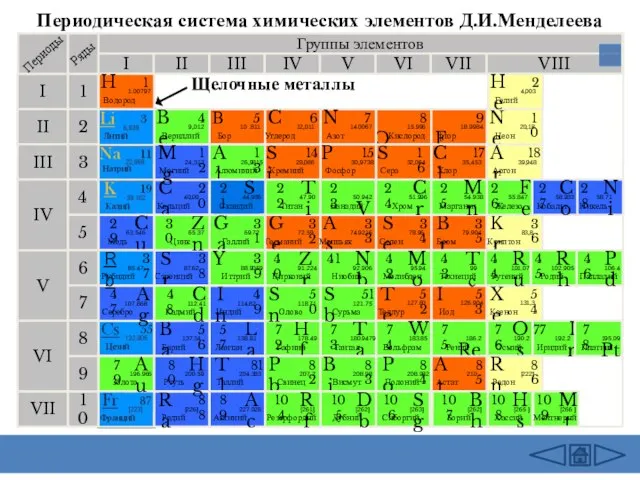
- 3. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 4. Группы элементов I III II VIII IV V VI VII II I III VII VI V
- 5. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 6. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 7. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 8. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 9. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
- 10. Периодическая система химических элементов Д.И.Менделеева Группы элементов I III II VIII IV V VI VII II
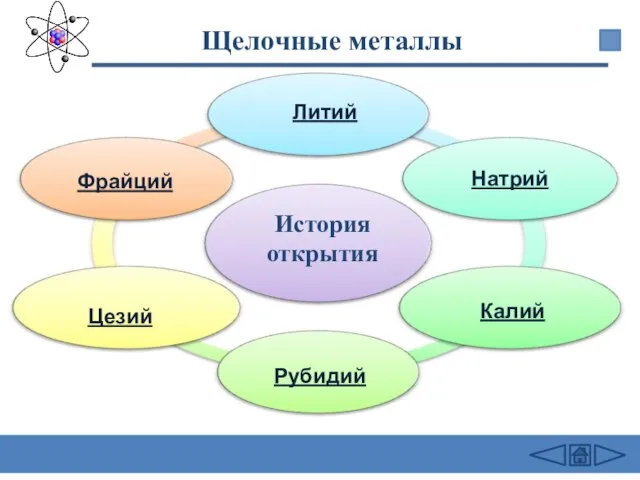
- 11. Щелочные металлы Литий Натрий Калий Рубидий Цезий Фрайций История открытия
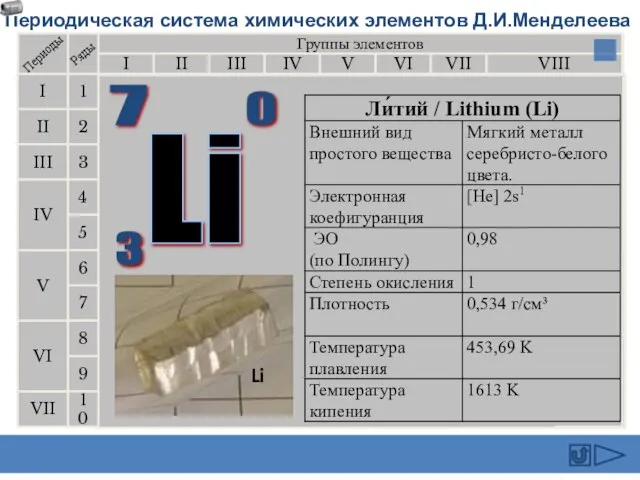
- 12. Литий был открыт в 1817 г. А. Арфведсоном в минерале петалите. Берцелиус предложил назвать ее литионом
- 13. Натрий (Natrium, от англ. и франц. Sodium, нем. Natrium от древнеевр. neter — бурлящее вещество. В
- 14. Калий (англ. Potassium, франц. Potassium, нем. Kalium) открыл в 1807 г. Г.Дэви, производивший электролиз твердого, слегка
- 15. При спектроскопическом анализе минерала лепидолит (фторсиликат лития и алюминия) и обнаружились две новые красные линии в
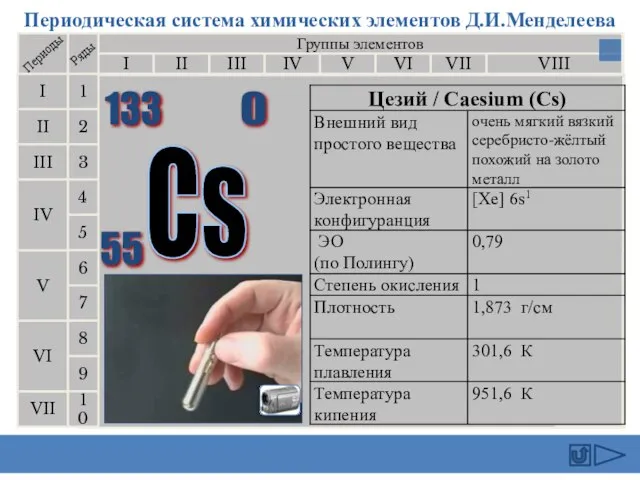
- 16. Цезий (англ. Cesium, франц. Cesium, нем. Caesium) - первый элемент, открытый с помощью спектрального анализа. Р.Бунзен
- 17. Этот элемент был предсказан Д.И.Менделеевым (как Эка-цезий), и был открыт (по его радиоактивности) в 1939 г.
- 18. Природные соединения лития Сподуменн
- 19. Природные соединения натрия Галит
- 20. Природные соединения калия Сильвин
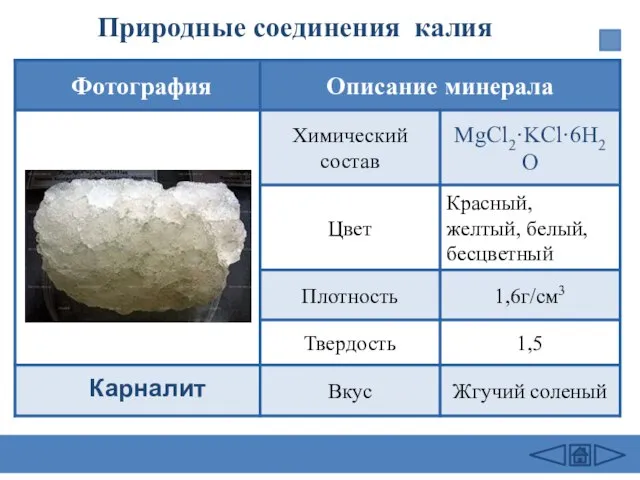
- 21. Природные соединения калия Карналит
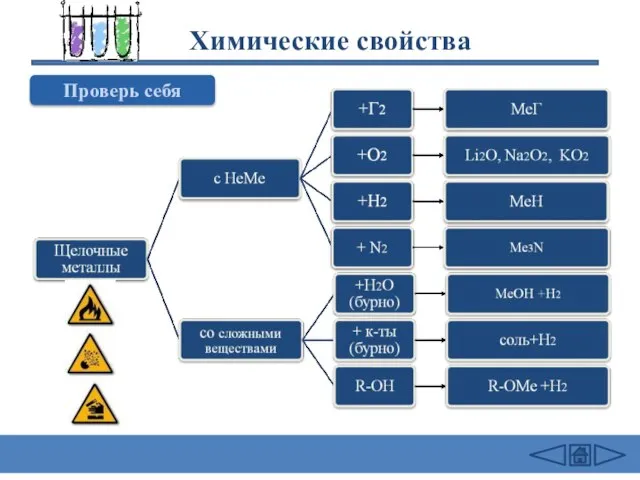
- 22. Химические свойства Проверь себя
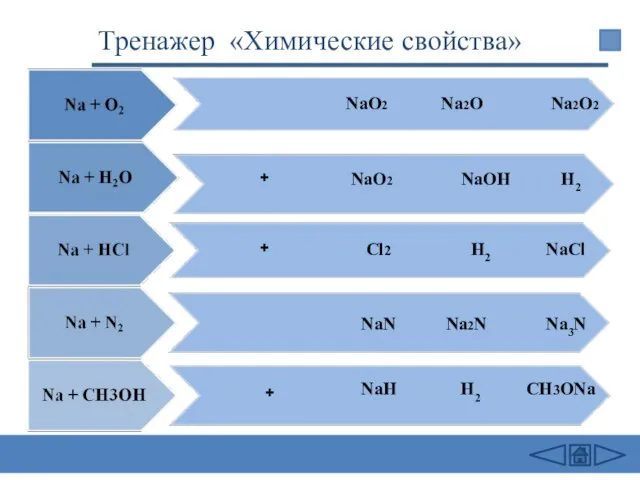
- 23. Химические свойства 2Na + Cl2 = 2NaCl (в атмосфере F2 и Cl2 щелочные Me самовоспламеняются) 4Li
- 24. Качественное определение щелочных металлов Li+ Na+ K+ Для распознавания соединений щелочных металлов по окраске пламени исследуемое
- 25. 1) Электролиз расплавов соединений щелочных металлов: 2МеCl = 2Ме + Cl2 4МеOH = 4Ме + 2Н2О
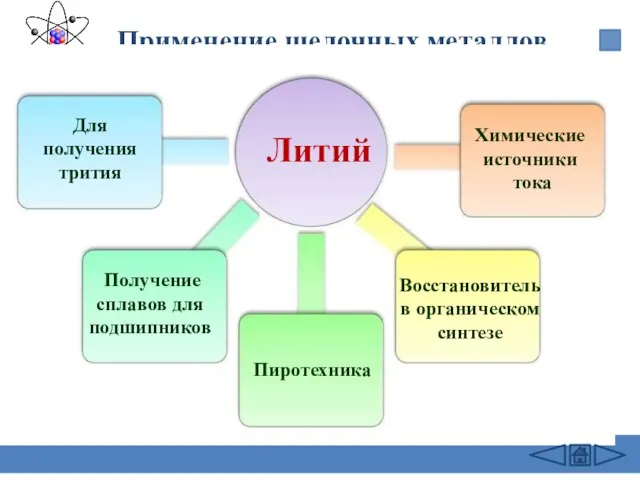
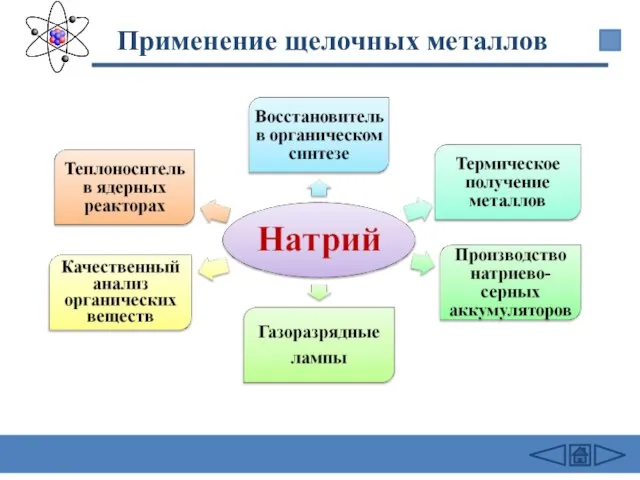
- 26. Применение щелочных металлов Литий Для получения трития Получение сплавов для подшипников Восстановитель в органическом синтезе Химические
- 27. Применение щелочных металлов
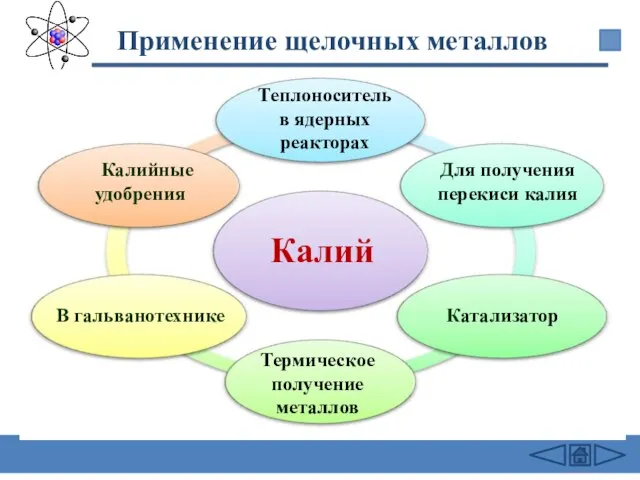
- 28. Применение щелочных металлов Калий В гальванотехнике Калийные удобрения Для получения перекиси калия Катализатор Термическое получение металлов
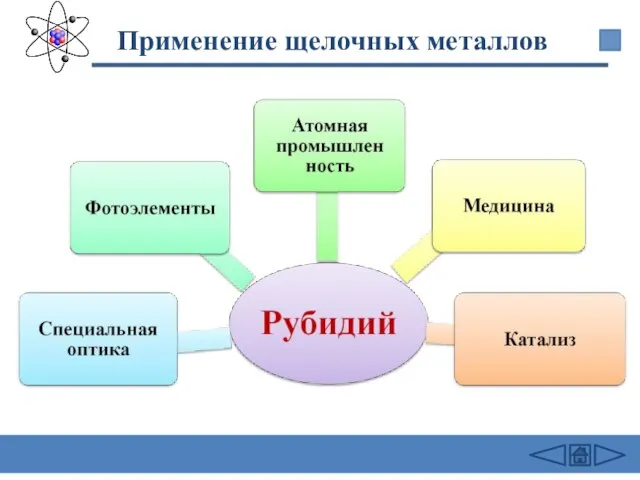
- 29. Применение щелочных металлов
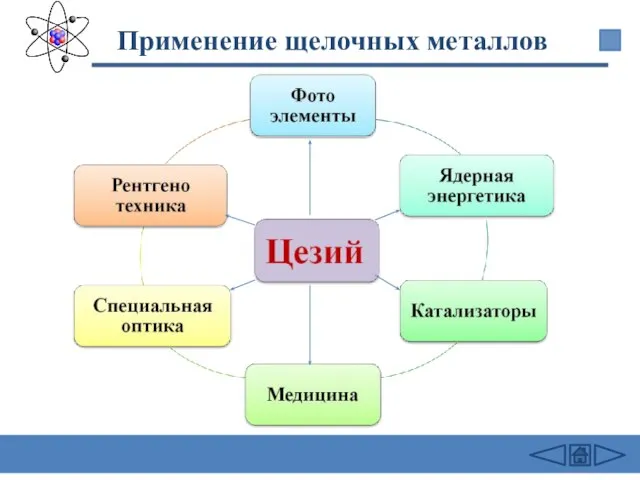
- 30. Применение щелочных металлов
- 31. Физические свойства щелочных металлов Щелочные металлы - серебристо–белые вещества, за исключением цезия - серебристо-желтого цвета, с
- 32. 1. Предложил назвать калий от арабского «алкали» - щелочь И. Арфведсон Г.Деви Й. Берцеллиус 2. В
- 33. + + + NаО2 Nа2O2 NаОН NaCl Na2N Na3N NаО2 Cl2 NaN NaH Na2O H2 H2
- 34. Габриелян О.С. Химия. 9 класс: Учеб. для общеобразоват.учебн. заведений.-М.: Дрофа, Ахметов Н. С. Общая и неорганическая
- 36. Скачать презентацию



















 Домашние кошечки.
Домашние кошечки. Особенности учебного курса «Основы религиозных культур и светской этики»
Особенности учебного курса «Основы религиозных культур и светской этики» Свет и тень
Свет и тень Параметризация типов в Java
Параметризация типов в Java САХАРНЫЙ ДИАБЕТ
САХАРНЫЙ ДИАБЕТ Речевой портрет носителя просторечия
Речевой портрет носителя просторечия Оптимизация функции группировки, ввод формы дизайна
Оптимизация функции группировки, ввод формы дизайна Государственное управление в космической отрасли
Государственное управление в космической отрасли Мои любимые животные
Мои любимые животные Творческая галерея педагогов Габдулла Тукай Эш беткәч уйнарга ярый
Творческая галерея педагогов Габдулла Тукай Эш беткәч уйнарга ярый Операционная система
Операционная система Местообитание и экологические ниши. Основные типы взаимодействий организмов
Местообитание и экологические ниши. Основные типы взаимодействий организмов Дисциплинарная политика Аbsolem
Дисциплинарная политика Аbsolem Презентация на тему Рисуем дельфина
Презентация на тему Рисуем дельфина  Введение в специальность (Лекция 2)
Введение в специальность (Лекция 2) стив джобс
стив джобс Коммерческое предложение по аренде офисного помещения
Коммерческое предложение по аренде офисного помещения ДИАБЕТИЧЕСКАЯ НЕФРОПАТИЯ
ДИАБЕТИЧЕСКАЯ НЕФРОПАТИЯ  Правоспособность и дееспособность человека 7 класс
Правоспособность и дееспособность человека 7 класс Арт-кино. ЧЧВ. Короткометражный фильм
Арт-кино. ЧЧВ. Короткометражный фильм Презентация на тему Грузия
Презентация на тему Грузия Презентация в форме КВН на тему:
Презентация в форме КВН на тему: ЗАСЕДАНИЕ ОРГКОМИТЕТА ПО ПОДГОТОВКЕ И ПРОВЕДЕНИЮ ПРАЗДНОВАНИЯ 65-ЛЕТИЯ ПОБЕДЫ В ВЕЛИКОЙ ОТЕЧЕСТВЕННОЙ ВОЙНЕ
ЗАСЕДАНИЕ ОРГКОМИТЕТА ПО ПОДГОТОВКЕ И ПРОВЕДЕНИЮ ПРАЗДНОВАНИЯ 65-ЛЕТИЯ ПОБЕДЫ В ВЕЛИКОЙ ОТЕЧЕСТВЕННОЙ ВОЙНЕ Международная стандартная классификация занятий (ISCO-08) Ирина Мелех Субрегиональное бюро МОТ
Международная стандартная классификация занятий (ISCO-08) Ирина Мелех Субрегиональное бюро МОТ ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ РАСПОРЯЖЕНИЕ О проведении Международной научной конференции по проблемам адаптации к измене
ПРАВИТЕЛЬСТВО РОССИЙСКОЙ ФЕДЕРАЦИИ РАСПОРЯЖЕНИЕ О проведении Международной научной конференции по проблемам адаптации к измене Бизнес-планированиеЗанятие 4
Бизнес-планированиеЗанятие 4 Самопрезентация специалиста
Самопрезентация специалиста ПЛАТЕЖНЫЕ СИСТЕМЫ И ПЛАСТИКОВЫЕ КАРТЫ В ЭЛЕКТРОННОЙ КОММЕРЦИИ Москва, 2006
ПЛАТЕЖНЫЕ СИСТЕМЫ И ПЛАСТИКОВЫЕ КАРТЫ В ЭЛЕКТРОННОЙ КОММЕРЦИИ Москва, 2006