Содержание
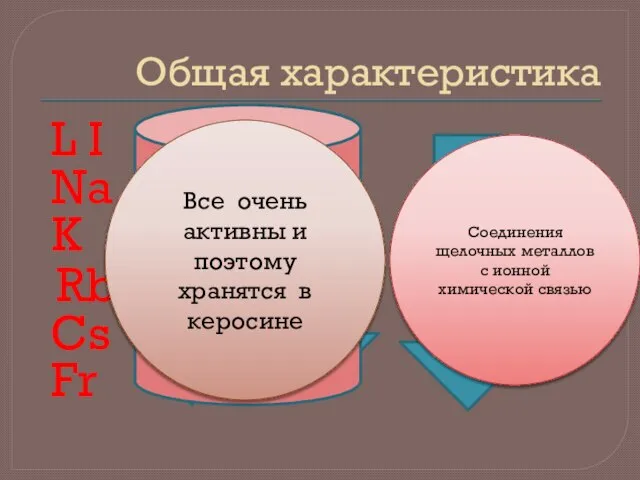
- 2. Общая характеристика L I Na K Rb Cs Fr Заряд ядра Радиус атома Металлические свойства nS
- 3. Физические свойства В свободном состоянии эти элементы представляют металлы мягкие, быстро окисляющиеся на влажном воздухе, разлагающие
- 4. Открытие металлов 1807г Гемфри Деви провёл электролиз едкого натра и едкого кали и выделил металлический натрий
- 5. Получение металлов Электролиз расплавов хлоридов и гидроксидов этих металлов 4 KOH= 4K +O2 +H2O
- 6. Химические свойства Реакция с кислородом 4Li+O2=2Li2O оксид лития 2Na+O2=Na2O2 пероксид натрия K +O2 =KO2 надпероксид калия
- 7. Взаимодействие с водой происходит по общей схеме. Me +2H2O =2MeOH +H2
- 8. Едкие щёлочи . Гидроксиды щелочных металлов называют едкими щёлочами. Они представляют собой белые кристаллические вещества. Устойчивые
- 9. Получение гидроксидов металлов 2Na Cl электролиз 2Na (Hg катод)+ Cl2(анод) амальгама Амальгамный (ртутный способ), на ртутном
- 10. Химические свойства 2NaOH+Cl2=NaCl+NaClO+H2O холодный раствор 6NaOH+3Cl2=5NaCl+NaClO3+2H2O горячий раствор NaOH + HCl=NaCl+H2O 2NaOH+2NO2=NaNO2+NaNO3+H2O связывание оксидов азота 2NaOH+CO2=Na2CO3+H2O
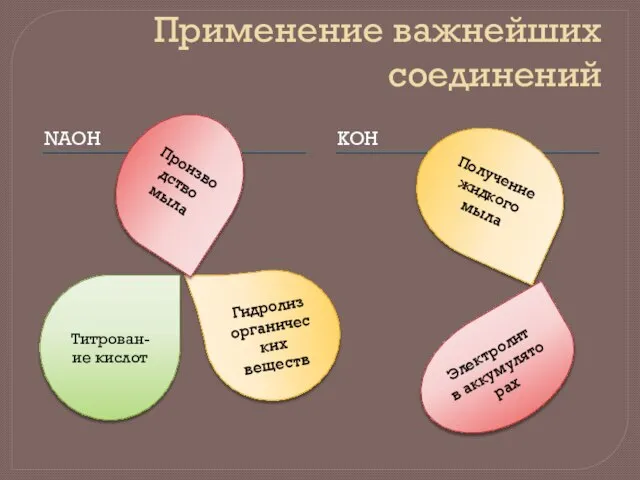
- 11. Применение важнейших соединений NAOH KOH Титрован- ие кислот Гидролиз органических веществ Производство мыла Получение жидкого мыла
- 13. Скачать презентацию








 Собор Парижской Богоматери
Собор Парижской Богоматери  АгроБарабоень
АгроБарабоень Презентация на тему Уральские самоцветы
Презентация на тему Уральские самоцветы Регистрационные документы и ОКВЭД
Регистрационные документы и ОКВЭД Мисс Гуманитарный Институт 2020. Конкурс красоты, таланта и ума
Мисс Гуманитарный Институт 2020. Конкурс красоты, таланта и ума Модернизация г.Красноярска
Модернизация г.Красноярска Учителями славится Россия
Учителями славится Россия Презентация на темум Одежда в мире человека 1 класс Плешакова
Презентация на темум Одежда в мире человека 1 класс Плешакова Multilingualism
Multilingualism Что это за листья ?
Что это за листья ? Создание проекта «Анимированная открытка ветерану» в среде ЛогоМиры
Создание проекта «Анимированная открытка ветерану» в среде ЛогоМиры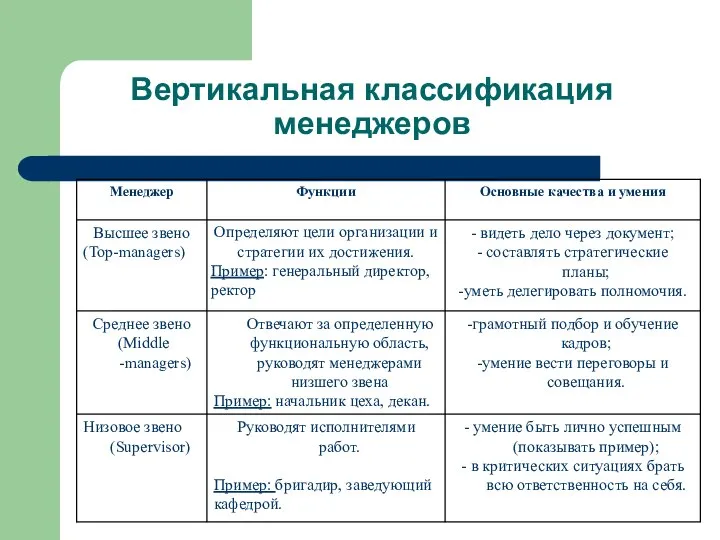 Вертикальная классификация менеджеров
Вертикальная классификация менеджеров Круглый стол д.э.н., проф. Кузнецовой О.Д.
Круглый стол д.э.н., проф. Кузнецовой О.Д. Рождество в Петербурге. Фестиваль
Рождество в Петербурге. Фестиваль Виртуальный музей эпохи Возрождения
Виртуальный музей эпохи Возрождения Псалом 53. Боже,во имя Твоё спаси меня,и силой Твоей укрепи меня
Псалом 53. Боже,во имя Твоё спаси меня,и силой Твоей укрепи меня Игры с мячом
Игры с мячом Kawai. Обои
Kawai. Обои Основной капитал организации
Основной капитал организации Понятие информационных технологии
Понятие информационных технологии  Шетёмина Елена Петровна мастер производственного обучения в группе по профессии «Повар, кондитер»
Шетёмина Елена Петровна мастер производственного обучения в группе по профессии «Повар, кондитер» Королева Елизавета I
Королева Елизавета I Русский язык в таблицах и схемах (часть 2)Гласные -о-е, -и-ы после шипящих и ц в суффиксах и окончаниях
Русский язык в таблицах и схемах (часть 2)Гласные -о-е, -и-ы после шипящих и ц в суффиксах и окончаниях Предоставление государственных гарантий Красноярского края
Предоставление государственных гарантий Красноярского края Полухина Татьяна Викторовна
Полухина Татьяна Викторовна Гарнизонный наряд
Гарнизонный наряд Сравнительный анализ методов подведения итогов конкурса
Сравнительный анализ методов подведения итогов конкурса Государство, его признаки и формы
Государство, его признаки и формы