Содержание
- 2. При взаимодействии спиртов с натрием образуются газообразный водород и соответствующие алкоголяты натрия. Приготовили пробирки с метиловым,
- 3. Опустили натрий в пробирку с этиловым спиртом. Выделяющийся водород можно поджечь. По окончании реакции выделим этилат
- 4. Наблюдения В пробирке с бутиловым спиртом реакция с натрием идет еще медленнее. 2С4Н9ОН + 2 Na
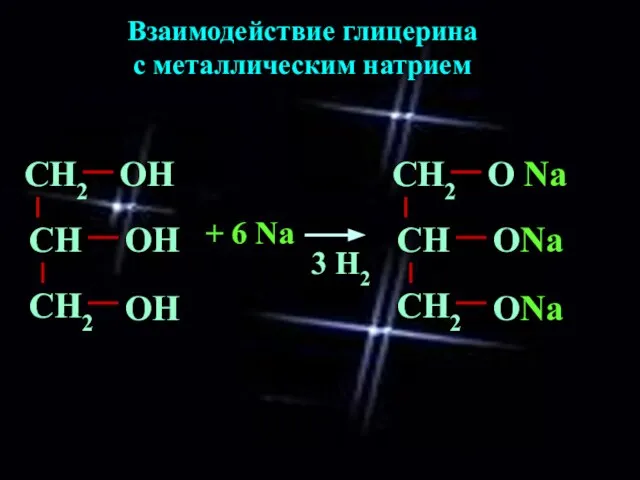
- 5. В пробирку с глицерином поместили кусочек натрия. Пробирку слегка подогрели. Реакция идет вначале медленно, затем более
- 6. Взаимодействие глицерина с металлическим натрием + 6 Na СН2 О Na СН СН2 ОNa ОNa 3
- 7. Взаимодействие этилового спирта с бромоводородом В прибор для получения галоидоалканов налили смесь этилового спирта с концентрированной
- 8. Взаимодействие этилового спирта с бромоводородом HBr +С2Н5ОН = C2H5Br + H2O Наблюдения Бромэтан - легкокипящая жидкость.
- 9. Задание Получите гидроксид меди (II) путем сливания растворов гидроксида натрия и сульфата меди (II). Прилейте полученный
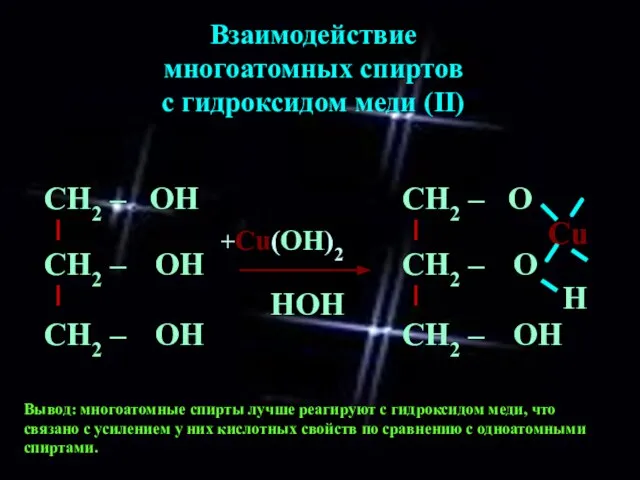
- 10. Взаимодействие многоатомных спиртов с гидроксидом меди (II) Вывод: многоатомные спирты лучше реагируют с гидроксидом меди, что
- 11. Взаимодействие многоатомных спиртов с гидроксидом меди (II) Вывод: С увеличением числа гидроксильных групп в молекуле вещества
- 12. К растертому в тонкий порошок перманганату калия прилейте немного глицерина. Взаимодействие глицерина с кристаллическим перманганатом калия
- 13. СН3-СН2-ОН + [О] = CH3 -COH + H2O Окисление этилового спирта кристаллическим перманганатом калия Очень энергично
- 14. СН3-СН2-ОН + [О] = CH3 -COH + H2O Окисление этилового спирта раствором перманганата калия Спирты легко
- 15. 2СН3-СН2-ОН + О2 = 2CH3 -COH + 2H2O Каталитическое окисление этанола Окисление этилового спирта кислородом воздуха
- 16. СН3-СН2-ОН + СuO = CH3 -COH + Cu + H2O Окисление этилового спирта оксидом меди (II)
- 17. С2Н5ОН + 3О2 = 2СО2 + 3 Н2О С4Н9ОН + 6О2 = 4СО2 + 5 Н2О
- 18. Этиловый спирт быстро загорается и горит голубоватым, слабосветящимся пламенем. Бутиловый спирт горит светящимся пламенем. Труднее загорается
- 20. Скачать презентацию









![СН3-СН2-ОН + [О] = CH3 -COH + H2O Окисление этилового спирта кристаллическим](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/459995/slide-12.jpg)
![СН3-СН2-ОН + [О] = CH3 -COH + H2O Окисление этилового спирта раствором](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/459995/slide-13.jpg)




 Живая и неживая природа.
Живая и неживая природа. Занятость и безработица
Занятость и безработица Ортологическая разминка
Ортологическая разминка Стратегический анализ внешней среды организации
Стратегический анализ внешней среды организации Салонные женские стрижки
Салонные женские стрижки Пермский филиал ГУ ВШЭ Архипов Валерий Михайлович, зам. директора ПФ ГУ-ВШЭ, доцент каф.фин.менеджмента ПФ ГУ-ВШЭ. Ведерников Серге
Пермский филиал ГУ ВШЭ Архипов Валерий Михайлович, зам. директора ПФ ГУ-ВШЭ, доцент каф.фин.менеджмента ПФ ГУ-ВШЭ. Ведерников Серге Фотоэффект (11 класс)
Фотоэффект (11 класс) Что такое мастер-класс?
Что такое мастер-класс? ВЫСТУПЛЕНИЕ РУКОВОДИТЕЛЯ ГМО Белковой Елены Александровны
ВЫСТУПЛЕНИЕ РУКОВОДИТЕЛЯ ГМО Белковой Елены Александровны Выбор и обоснование выбора материала для ________________. Образец презентации по материаловедению
Выбор и обоснование выбора материала для ________________. Образец презентации по материаловедению Оценка и развитие бизнеса
Оценка и развитие бизнеса Ambient Media Что это такое? Что это такое? Ambient против классик и Ambient против классик и Эффективност ь Эффективност ь For ex. For ex. Вывод ы Вывод
Ambient Media Что это такое? Что это такое? Ambient против классик и Ambient против классик и Эффективност ь Эффективност ь For ex. For ex. Вывод ы Вывод Оценка движимого имущества. Практика решения задач
Оценка движимого имущества. Практика решения задач Разделы информатики, используемые в олимпиадных задачах
Разделы информатики, используемые в олимпиадных задачах РАЗВИТИЕ ТЕХНОЛОГИЙ ПРОВЕДЕНИЯ МЕЖРЕГИОНАЛЬНЫХ СДЕЛОК
РАЗВИТИЕ ТЕХНОЛОГИЙ ПРОВЕДЕНИЯ МЕЖРЕГИОНАЛЬНЫХ СДЕЛОК В объятьях двух морей новый
В объятьях двух морей новый Итоги 2009 – 2010 учебного года в 1 – 4 классахПедсовет 30.08 .2010г.
Итоги 2009 – 2010 учебного года в 1 – 4 классахПедсовет 30.08 .2010г.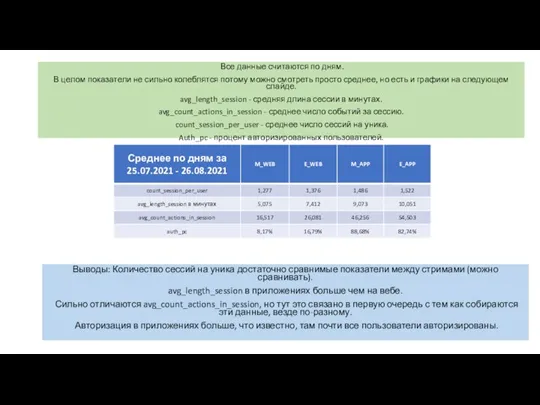 Количество сессий на уника
Количество сессий на уника Сказка о стране чисел
Сказка о стране чисел Актуальные проблемы литературы ХХ века и современной литературы
Актуальные проблемы литературы ХХ века и современной литературы Брейн-ринг Волшебные сказки
Брейн-ринг Волшебные сказки Стили в архитектуре
Стили в архитектуре O
O Мисс Филология
Мисс Филология Презентація Івкової Ольги ФГН-1,філологія, група 2
Презентація Івкової Ольги ФГН-1,філологія, група 2 Humor in advertising
Humor in advertising Презентация на тему Что мы знаем о тексте 5 класс
Презентация на тему Что мы знаем о тексте 5 класс Приготовление рабочих растворов
Приготовление рабочих растворов