Содержание
- 2. Прогноз реакционной способности алкенов – наличие двойной связи позволяет отнести алкены к ненасыщенным соединениям. Превращение их
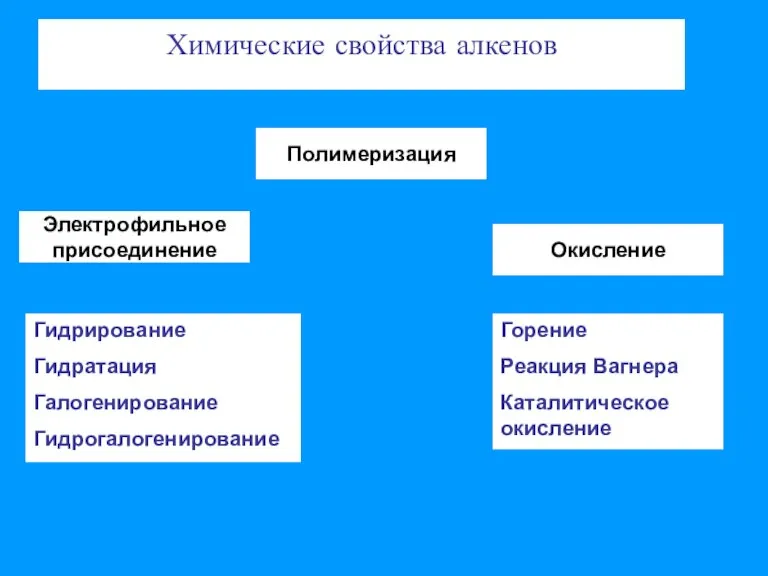
- 3. Химические свойства алкенов Электрофильное присоединение Полимеризация Окисление Гидрирование Гидратация Галогенирование Гидрогалогенирование Горение Реакция Вагнера Каталитическое окисление
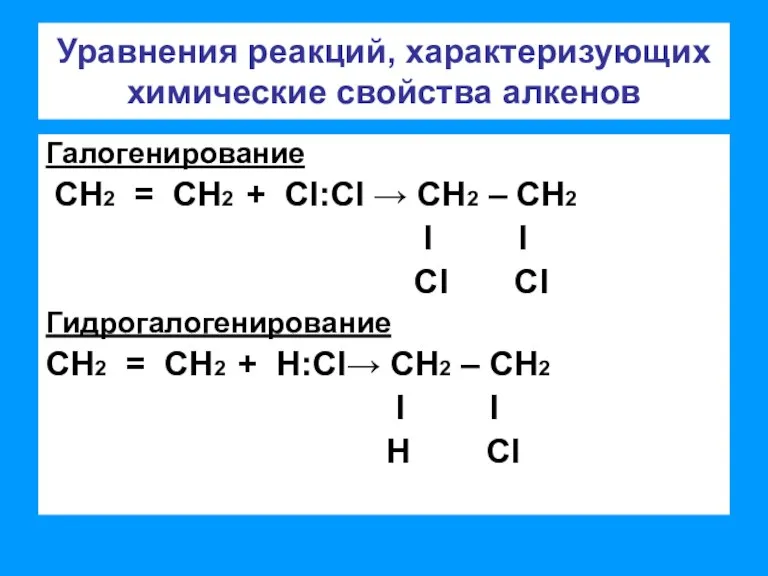
- 5. Уравнения реакций, характеризующих химические свойства алкенов Галогенирование СН2 = СН2 + CI:CI → СН2 – СН2
- 6. Качественная реакция на непредельные углеводороды (в т.ч. алкены) СН2 = СН2 + Br2 → СН2 –
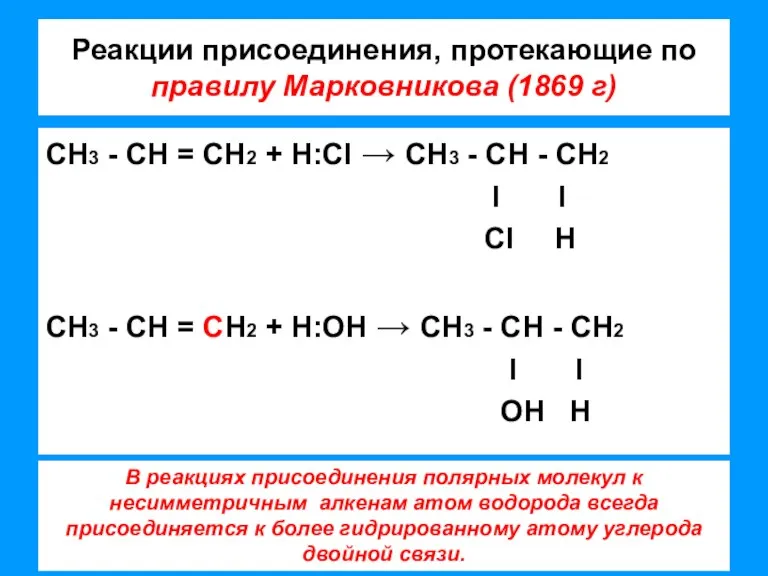
- 7. Реакции присоединения, протекающие по правилу Марковникова (1869 г) СН3 - СН = СН2 + Н:CI →
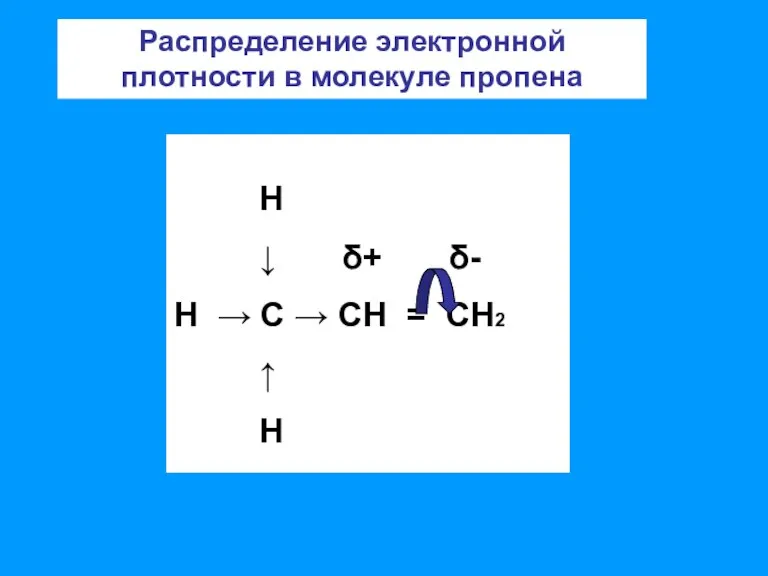
- 8. Н ↓ δ+ δ- Н → С → СН = СН2 ↑ Н Распределение электронной плотности
- 9. Уравнения реакций, характеризующих химические свойства алкенов Окисление Реакция Вагнера 3СН2 = СН2 + 4Н2О + 2KMnO4
- 10. Уравнения реакций, характеризующих химические свойства алкенов Каталитическое окисление В присутствии хлоридов меди и палладия: 2СН2 =
- 11. Уравнения реакций, характеризующих химические свойства алкенов Реакция полимеризации n(СН2 = СН2) → (- СН2 – СН2
- 12. Получение алкенов Промышленные способы 1. Крекинг алканов С8Н18 → С4Н8 + С4Н10 2. Дегидрирование алканов СН3-СН2-СН2-СН3
- 13. Получение алкенов Лабораторные способы Дегалогенирование галогенпроизводных алканов Дегидрогалогенирование галогенпроизводных алканов Дегидратация спиртов
- 15. Скачать презентацию








 Восприятие (перцепция)
Восприятие (перцепция) Презентация на тему Здоровьесберегающая среда классной комнаты
Презентация на тему Здоровьесберегающая среда классной комнаты Этапы развития жизни на Земле
Этапы развития жизни на Земле Программы повышения результативности персонала
Программы повышения результативности персонала Основные документы
Основные документы Кружок «Юный музеевед»
Кружок «Юный музеевед» Содержание и проблемы реализации государственной программы Доступная среда для инвалидов и людей с ограниченными возможностями
Содержание и проблемы реализации государственной программы Доступная среда для инвалидов и людей с ограниченными возможностями Решения FTTx
Решения FTTx Игуана
Игуана Презентация на тему Лагеря смерти
Презентация на тему Лагеря смерти  Портал (правки)
Портал (правки) Цель Конкурса – выявление и распространение инновационного педагогического опыта в области преподавания физической культуры и ф
Цель Конкурса – выявление и распространение инновационного педагогического опыта в области преподавания физической культуры и ф Пожертвования
Пожертвования Политика качества
Политика качества Односоставные предложения в произведениях Ивана Алексеевича Бунина
Односоставные предложения в произведениях Ивана Алексеевича Бунина Азаматтық іс жүргізудегі үшінші түлғалар
Азаматтық іс жүргізудегі үшінші түлғалар Каток под открытым небом
Каток под открытым небом От повышения качества обучения школьников к повышению доходов педагогов
От повышения качества обучения школьников к повышению доходов педагогов Основные факторы, влияющие на электоральное поведение граждан
Основные факторы, влияющие на электоральное поведение граждан Исследовательский проект«Река Ихаланийоки»
Исследовательский проект«Река Ихаланийоки» Углы, связанные с окружностью
Углы, связанные с окружностью Презентация на тему Фольклор урок
Презентация на тему Фольклор урок  ЦЕНТР МЕЖДУНАРОДНОГООБРАЗОВАНИЯ (ЦМО) СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ
ЦЕНТР МЕЖДУНАРОДНОГООБРАЗОВАНИЯ (ЦМО) СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ Органы государственной власти
Органы государственной власти Фотография. Искусство фотопейзажа и интерьера. Видео. Правила съёмки пейзажа
Фотография. Искусство фотопейзажа и интерьера. Видео. Правила съёмки пейзажа Презентация на тему Киевское и Черниговское княжества
Презентация на тему Киевское и Черниговское княжества Семинар Мобильные приложения 4.10.22
Семинар Мобильные приложения 4.10.22 Презентация на тему Происхождение и эволюция человека
Презентация на тему Происхождение и эволюция человека