Содержание
- 2. Тип урока: урок изучения нового материала Цель урока: через анализ фундаментальных исторических опытов подвести учащихся к
- 3. Вспоминаем Как происходило развитие взглядов на строение атома? Опыт Резерфорда К какому выводу привели Резерфорда результаты
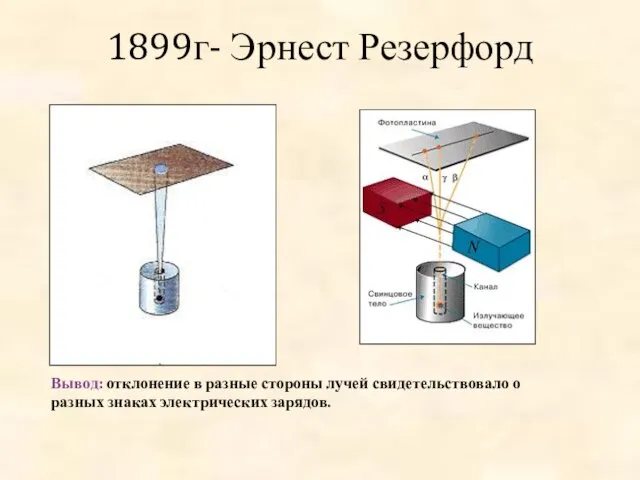
- 4. 1899г- Эрнест Резерфорд Вывод: отклонение в разные стороны лучей свидетельствовало о разных знаках электрических зарядов.
- 6. 1903Г – ДЖОЗЕФ ТОМСОН Атом представляет шар по всему объему которого распределен положительный заряд, а внутри
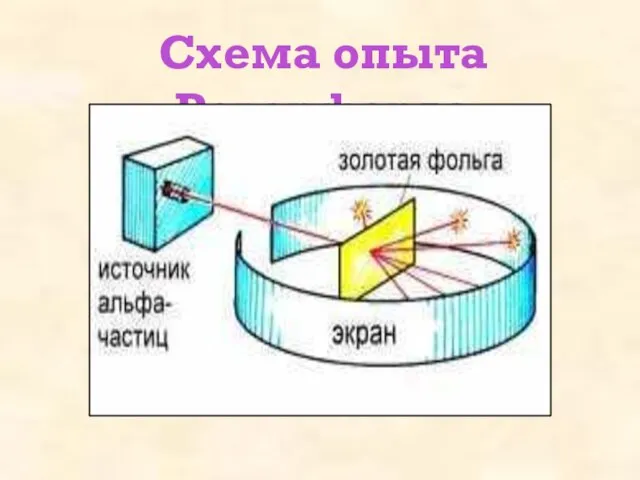
- 8. 1911 г- Эрнест Резерфорд Зондировать атом альфа–частицами. Альфа-частицы возникают при распаде радия. Масса альфа-частицы в 8000
- 9. Схема опыта Резерфорда
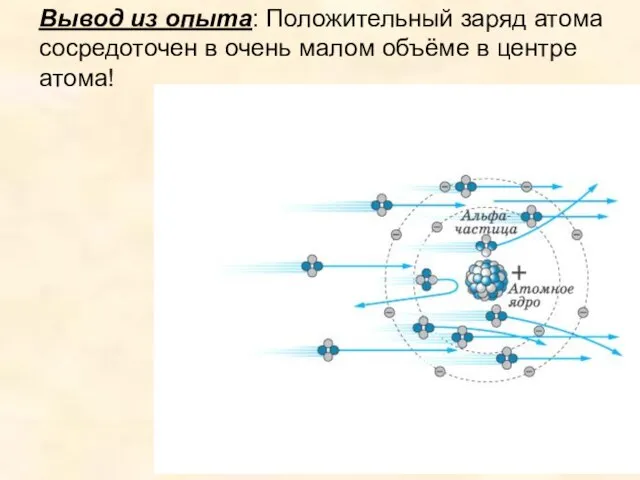
- 12. Вывод из опыта: Положительный заряд атома сосредоточен в очень малом объёме в центре атома!
- 13. Модель атома Резерфорда (планетарная) В центре атома находится положительно заряженное ядро, а вокруг ядра движутся отрицательно
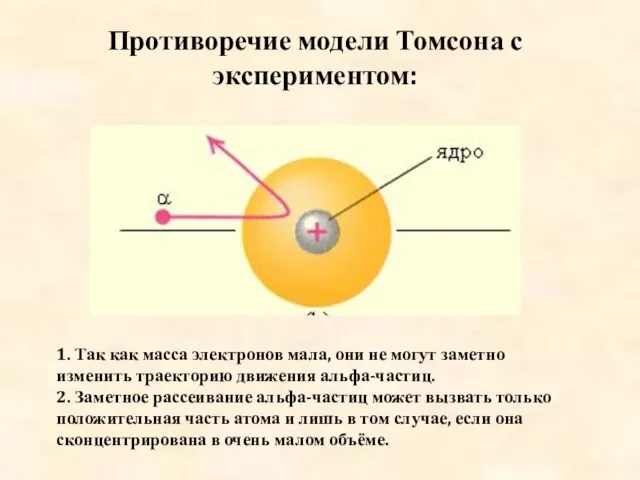
- 14. 1. Так как масса электронов мала, они не могут заметно изменить траекторию движения альфа-частиц. 2. Заметное
- 15. АТОМ Состоит из ядра Вокруг ядра вращаются электроны
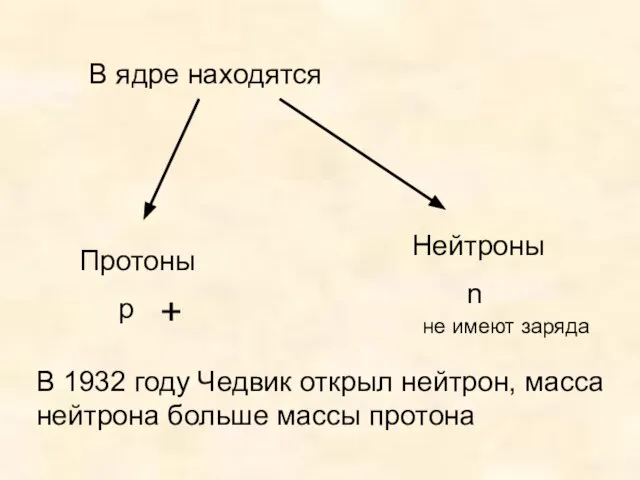
- 16. В ядре находятся Протоны p Нейтроны n + не имеют заряда В 1932 году Чедвик открыл
- 18. Электрон заряжен отрицательно Заряд электрона равен е = -1,6 10 ¯ Кл 19 Заряд протона равен
- 19. В нормальном состоянии атом нейтрален. ∑ +p = ∑ -e qэл=-Ze Если атом теряет один электрон,
- 20. Z- заряд ядра = порядковому номеру химического элемента. А –массовое число. А=Z+N полное число нуклонов в
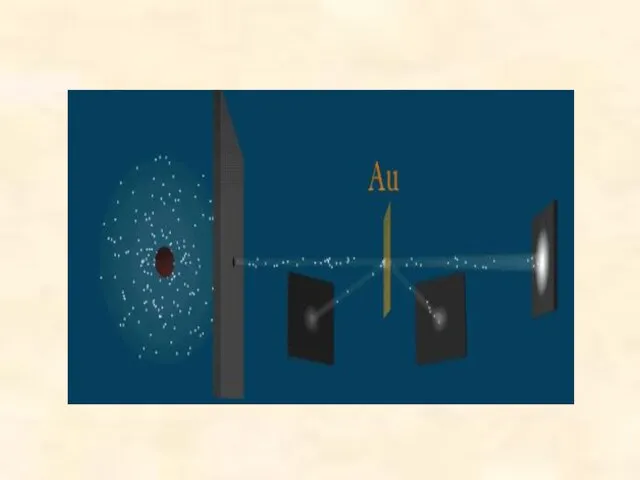
- 21. Результаты опыта: При отсутствии на пути α-частиц фольги на экране возникал светлый кружок, вызванный тонким пучком
- 22. Выводы из опыта по рассеиванию альфа-частиц Резерфорда: 1. Существует атомное ядро, т.е. тело малых размеров, в
- 23. Выводы: В центре атома находится положительно заряженное ядро, вокруг которого вращаются по определенным орбитам электроны. Основная
- 24. Это важно запомнить: В состав ядра входят положительные протоны и неимеющие заряда нейтроны; Количество протонов равно
- 25. Недостаток планетарной модели атома: Нельзя объяснить факт существования атома; Нельзя объяснить устойчивость атома.
- 26. Вопросы на закрепление: 1. В чём заключается сущность модели Томсона? 2. В чём заключалась идея опыта
- 27. + знаю, знал, но забыл новое что поразило, удивило что не понял + - ! ?
- 29. Скачать презентацию




















 Тренажер формул по физике. Электромагнетизм
Тренажер формул по физике. Электромагнетизм Интерференция света
Интерференция света Магнитотерапия. Физическая характеристика
Магнитотерапия. Физическая характеристика Закон Джоуля-Ленца. Решение задач
Закон Джоуля-Ленца. Решение задач Преломление света. Дисперсия. Цвета тел. (6 класс)
Преломление света. Дисперсия. Цвета тел. (6 класс)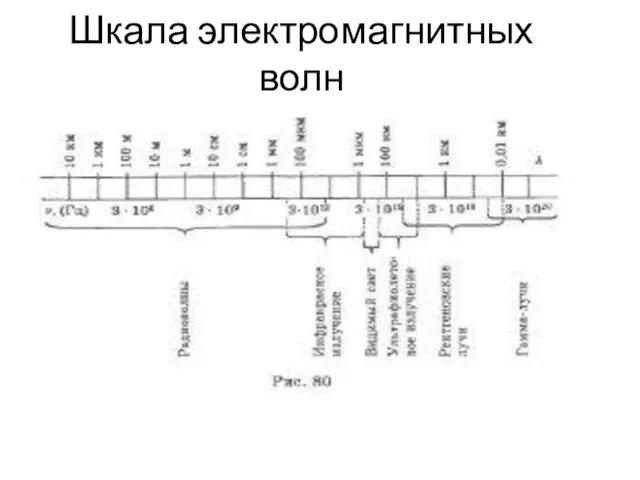 Шкала электромагнитных волн
Шкала электромагнитных волн Муниципальное автономное общеобразовательное учреждение Муниципальное автономное общеобразовательное учреждение «Средняя об
Муниципальное автономное общеобразовательное учреждение Муниципальное автономное общеобразовательное учреждение «Средняя об Термоядерные реакции - источники энергии на Солнце
Термоядерные реакции - источники энергии на Солнце Струм у напівпровідниках
Струм у напівпровідниках Проверка и наладка электрооборудования стационарной сварочной машины №3
Проверка и наладка электрооборудования стационарной сварочной машины №3 Давление тел
Давление тел Работа силы упругости. Потенциальная энергия упруго деформированного тела
Работа силы упругости. Потенциальная энергия упруго деформированного тела Б1. В 16. Типаж технологического оборудования. Практическое занятие № 2. Методы и средства диагностирования
Б1. В 16. Типаж технологического оборудования. Практическое занятие № 2. Методы и средства диагностирования Токи, протекающие в выключателях ВЛ при КЗ и каскадном отключении короткого замыкания
Токи, протекающие в выключателях ВЛ при КЗ и каскадном отключении короткого замыкания Циркуляция вод океана
Циркуляция вод океана Презентация на тему Физика в спорте
Презентация на тему Физика в спорте  Назначение релейной защиты
Назначение релейной защиты Методы и средства измерения. Тема 4
Методы и средства измерения. Тема 4 Обратимые и необратимые термодинамические процессы. (Лекция 8)
Обратимые и необратимые термодинамические процессы. (Лекция 8) Презентация на тему Взаимодействие электрических токов
Презентация на тему Взаимодействие электрических токов  Магнитный поток. Вектор магнитной индукции
Магнитный поток. Вектор магнитной индукции Эффекты квантования чисел в цифровых цепях
Эффекты квантования чисел в цифровых цепях Создание приложения для решения задач по физике
Создание приложения для решения задач по физике Ядерный реактор
Ядерный реактор Исследование ОУ и схем их включения
Исследование ОУ и схем их включения Физическая величина
Физическая величина Система согласованного управления двумя электроприводами в технологическом оборудовании
Система согласованного управления двумя электроприводами в технологическом оборудовании Магнитное поле, его свойства
Магнитное поле, его свойства