Содержание
- 2. Атом водорода и водородоподобные системы - это системы, состоящие из ядра с зарядом Ze и одного
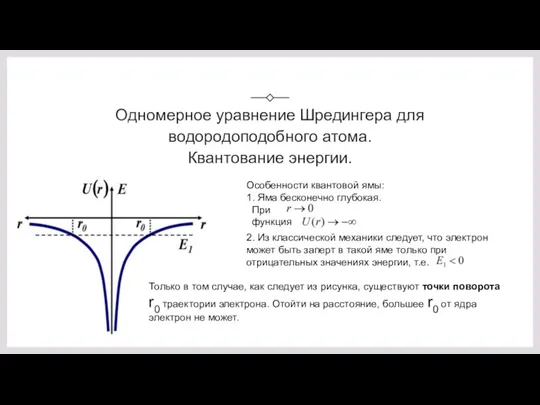
- 3. Одномерное уравнение Шредингера для водородоподобного атома. Квантование энергии. Особенности квантовой ямы: 1. Яма бесконечно глубокая. При
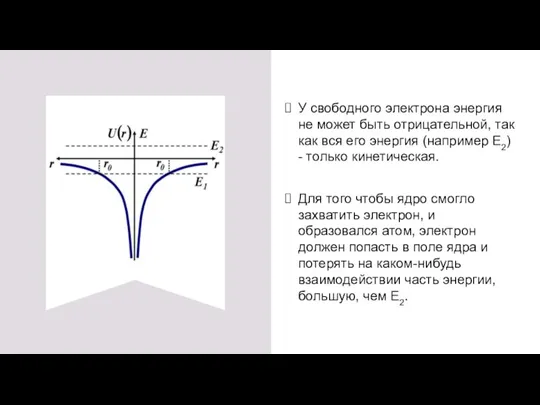
- 4. У свободного электрона энергия не может быть отрицательной, так как вся его энергия (например E2) -
- 5. Квантово-механическая модель атома водорода Решение уравнения Шредингера для электрона в центрально-симметричном поле ядра Система: ядро с
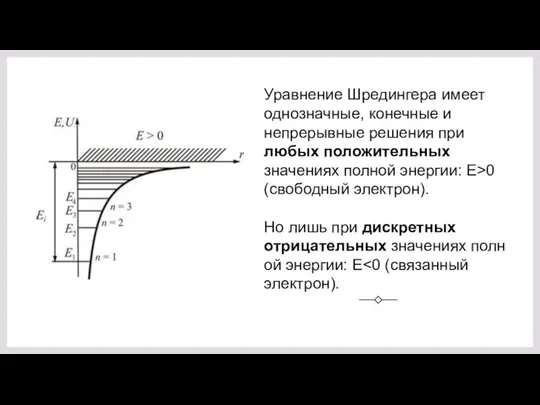
- 6. Уравнение Шредингера имеет однозначные, конечные и непрерывные решения при любых положительных значениях полной энергии: E>0 (свободный
- 7. Результат решения: собственные значения энергии Совпадает с En , полученной Бором. Но здесь получается из уравнения
- 8. Таким образом, как и в случае "потенциальной ямы" с бесконечно высокими "стенками", решение уравнения Шредингера для
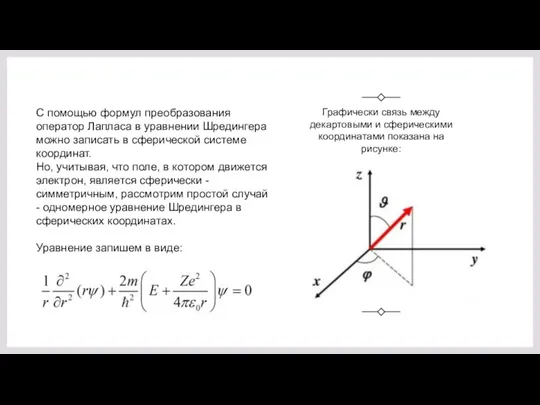
- 9. Так как "потенциальная яма" имеет центрально симметричную форму, то оператор Лапласа необходимо взять в сферической системе
- 10. Графически связь между декартовыми и сферическими координатами показана на рисунке: С помощью формул преобразования оператор Лапласа
- 11. Общее решение уравнения Шредингера, зависящее от всех трех сферических координат , может быть найдено методом разделения
- 12. Определим смысл квантовых чисел Из квантовомеханических представлений: состояние электрона в атоме водорода полностью определяется значениями четырех
- 13. Орбитальный механический момент импульса L. Всякая частица, совершающая движение по траектории, обладает моментом импульса. Это вектор,
- 14. Из решения уравнения Шредингера вытекает, что механический орбитальный момент импульса электрона квантуется, т.е. не может быть
- 15. Азимутальное (орбитальное) квантовое число - азимутальное квантовое число - определяет величину (модуль) момента импульса электрона в
- 16. Значения азимутального (орбитального) числа l при n > 1
- 17. Классификация стационарных состояний электрона в водородоподобном атоме Энергетическому уровню может соответствовать несколько квантовых состояний. В атомной
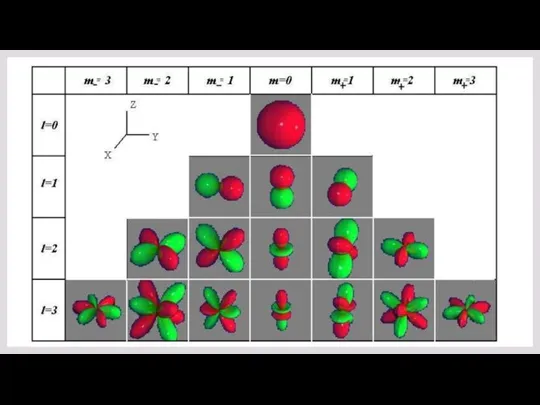
- 18. ОРБИТАЛЬНОЕ КВАНТОВОЕ ЧИСЛО ХАРАКТЕРИЗУЕТ ЭЛЛИПТИЧНОСТЬ ОРБИТЫ ЭЛЕКТРОНА И ОПРЕДЕЛЯЕТ МОМЕНТ ИМПУЛЬСА ЭЛЕКТРОНА l=0 l=1 l=2 Состояния,
- 19. Различные состояния орбитального квантового числа электрона служат для систематики электронных состояний в атомах и молекулах. Приняты
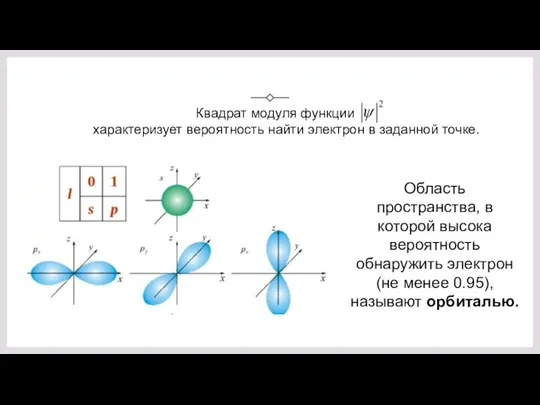
- 20. Квадрат модуля функции характеризует вероятность найти электрон в заданной точке. Область пространства, в которой высока вероятность
- 21. Магнитное квантовое число - магнитное квантовое число определяет проекцию момента импульса на выделенное направление (например, направление
- 22. Атом водорода: вырожденные состояния - главное квантовое число, - азимутальное квантовое число, - магнитное квантовое число,
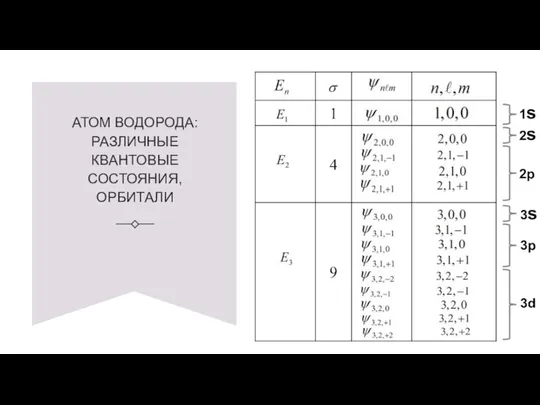
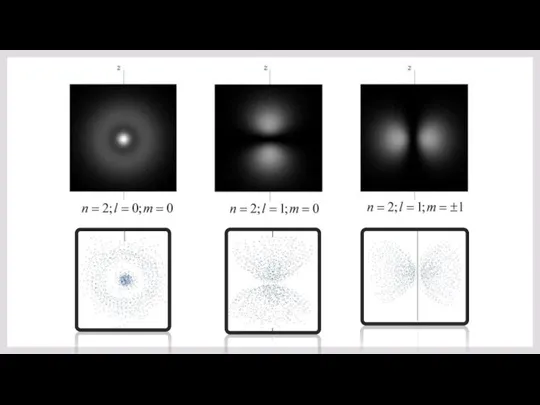
- 23. АТОМ ВОДОРОДА: РАЗЛИЧНЫЕ КВАНТОВЫЕ СОСТОЯНИЯ, ОРБИТАЛИ 1s 2s 3s 2p 3p 3d
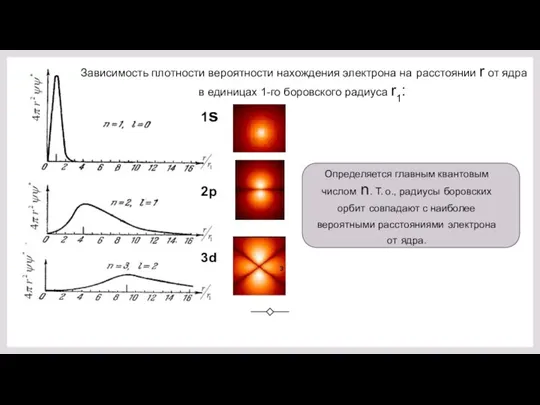
- 24. 1s 2p 3d Зависимость плотности вероятности нахождения электрона на расстоянии r от ядра в единицах 1-го
- 26. ОПЫТЫ ШТЕРНА И ГЕРЛАХА. ПРОСТРАНСТВЕННОЕ КВАНТОВАНИЕ. ОТКРЫТИЕ СПИНА ЭЛЕКТРОНА. 1922 Г.
- 27. Пучок атомов серебра пропускали через сильно неоднородное магнитное поле, создаваемое мощным постоянным магнитом. При прохождении атомов
- 28. Вращающийся заряженный шарик должен обладать магнитным моментом, причем отношение магнитного момента к механическому должно иметь значение:
- 29. Электрон, наряду с собственным механическим моментом, обладает также и собственным магнитным моментом . Но ряд опытных
- 30. Наличие спина и все его свойства вытекают из установленного Дираком уравнения квантовой механики, удовлетворяющего требованиям теории
- 31. Спин электрона является свойством одновременно квантовым и релятивистским. Спином обладают и другие элементарные частицы: протоны, нейтроны,
- 32. Величина собственного момента импульса электрона определяется по общим законам квантовой механики так называемым спиновым квантовым числом
- 33. Чтобы найти величину собственного магнитного момента электрона, умножим Ms на отношение к Ms : Знак минус
- 34. Проекция собственного магнитного момента электрона на заданное направление может иметь следующие значения: Минус получается, если плюс
- 35. Проекция собственного момента импульса электрона может принимать значения или а собственного магнитного момента - значения и
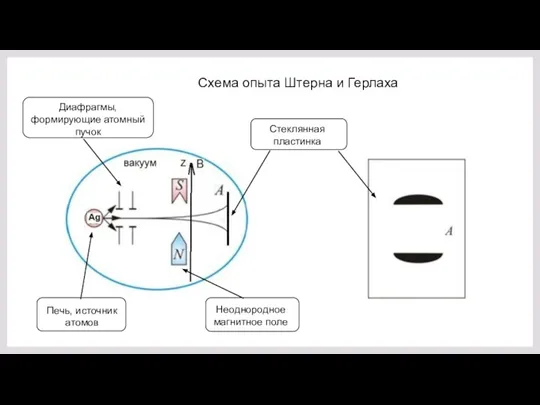
- 36. Схема опыта Штерна и Герлаха Диафрагмы, формирующие атомный пучок Печь, источник атомов Неоднородное магнитное поле Стеклянная
- 37. Идея опыта Если магнитный момент атомов серебра равен то в магнитном поле B, направленном по оси
- 38. При отсутствии у атома магнитного момента (щелочные металлы, Ag) в опыте Штерна и Герлаха не должно
- 39. Принцип Паули. Распределению электронов по энергетическом уровням в атомах. Периодическая таблица элементов Менделеева.
- 40. Распределение электронов по энергетическим уровням в многоэлектронных атомах. Принцип Паули. 1) Квантовое состояние каждого электрона в
- 41. Электронная оболочка - совокупность электронов в атоме, состояния которых характеризуются определенными главным квантовым числом n и
- 42. Пример электронной конфигурации
- 43. Для полностью заполненной оболочки и, соответственно, слоя характерно равенство нулю суммарного орбитального и спинового моментов. Состояния
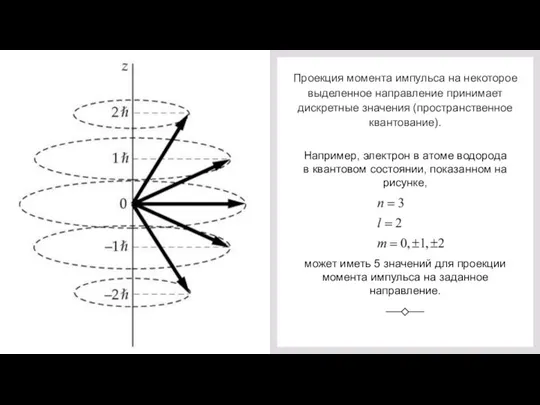
- 44. Проекция момента импульса на некоторое выделенное направление принимает дискретные значения (пространственное квантование). Например, электрон в атоме
- 47. Правила отбора: 1s - основное состояние электрона в атоме водорода
- 49. Скачать презентацию



































 Сообщающиеся сосуды
Сообщающиеся сосуды Разработка стенда для исследования импульсных источников питания
Разработка стенда для исследования импульсных источников питания Механика. Введение
Механика. Введение СИЛА ТРЕНИЯ, ЕЕ РОЛЬ В ПРИРОДЕ, ТЕХНИКЕ И ПОВСЕДНЕВНОЙ ЖИЗНИ. Выполнил: Кишко А. 7 класс МКОУ Атамановской СОШ Учитель: Янюшкина
СИЛА ТРЕНИЯ, ЕЕ РОЛЬ В ПРИРОДЕ, ТЕХНИКЕ И ПОВСЕДНЕВНОЙ ЖИЗНИ. Выполнил: Кишко А. 7 класс МКОУ Атамановской СОШ Учитель: Янюшкина  Поступательное движение
Поступательное движение Относительность движения
Относительность движения Растяжение и сжатие
Растяжение и сжатие Жан Лерон Д' Аламбер. Трактат о динамике
Жан Лерон Д' Аламбер. Трактат о динамике Звук. Колебательные системы
Звук. Колебательные системы Внедрение гибридных солнечно-ветровых систем электропитания для развития ИКТ в предгорных населенных пунктах и регионах
Внедрение гибридных солнечно-ветровых систем электропитания для развития ИКТ в предгорных населенных пунктах и регионах Презентация на тему Тепловые двигатели
Презентация на тему Тепловые двигатели  Основы электричества
Основы электричества Измерительный прибор для определения влажности воздуха - гигрометр
Измерительный прибор для определения влажности воздуха - гигрометр Исследование возникновения и развития скольжения в поликристаллических образцах алюминия с помощью лазерной методики
Исследование возникновения и развития скольжения в поликристаллических образцах алюминия с помощью лазерной методики Кристаллические и аморфные тела. Механические свойства твердых тел
Кристаллические и аморфные тела. Механические свойства твердых тел В.А. Грибов. Я сдам ЕГЭ. Физика
В.А. Грибов. Я сдам ЕГЭ. Физика Гальванічні реакції
Гальванічні реакції Ядерные реакции. Атом, атомное ядро, атомная энергия (Лекция 2)
Ядерные реакции. Атом, атомное ядро, атомная энергия (Лекция 2) Теоретическая механика. Задачи
Теоретическая механика. Задачи Кинематика твердого тела/ Простейшие движения твердого тела
Кинематика твердого тела/ Простейшие движения твердого тела Компенсация реактивной мощности
Компенсация реактивной мощности Исследование процесса образования ядер капель и кристаллов в атмосфере. Лабораторная работа №2
Исследование процесса образования ядер капель и кристаллов в атмосфере. Лабораторная работа №2 Перемещение при прямолинейном равноускоренном движении (9 класс)
Перемещение при прямолинейном равноускоренном движении (9 класс) Действие жидкости на погруженное в нее тело. Сила Архимеда
Действие жидкости на погруженное в нее тело. Сила Архимеда Розв'язування задач на тему Закони вiдбивання свiтла
Розв'язування задач на тему Закони вiдбивання свiтла Дала,прерия
Дала,прерия Сравнение основных параметров импульсных и линейных источников питания
Сравнение основных параметров импульсных и линейных источников питания Посадочный размер блока. Диаметр ТЭНа
Посадочный размер блока. Диаметр ТЭНа