Содержание
- 2. Лекция 3. Теплота, работа и изменение внутренней энергии для различных процессов в идеальном газе Энтальпия. Вычисление
- 3. 1 балл Первый закон термодинамики утверждает, что внутренняя энергия постоянна 1. В любой системе. 2. В
- 4. 1 балл Выражение δQ+δW=dU 1) Это первый закон термодинамики для изолированных систем 2) В закрытой системе
- 5. ПЕРВЫЙ ЗАКОН и ХИМИЧЕСКАЯ РЕАКЦИЯ «Состояние 1, Т1;р1» «Состояние 2,Т1;р1» «Состояние 1» - реагенты реакции; «Состояние
- 6. ЭНТАЛЬПИЯ. У любой системы существует функция состояния, называемая энтальпией, H.
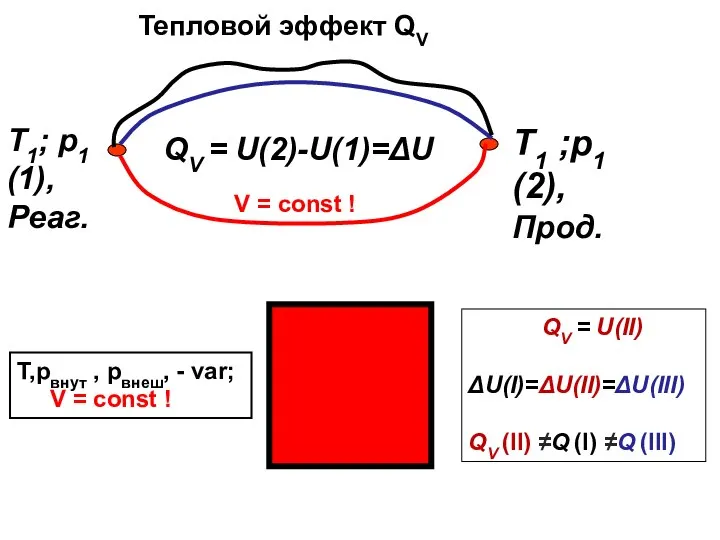
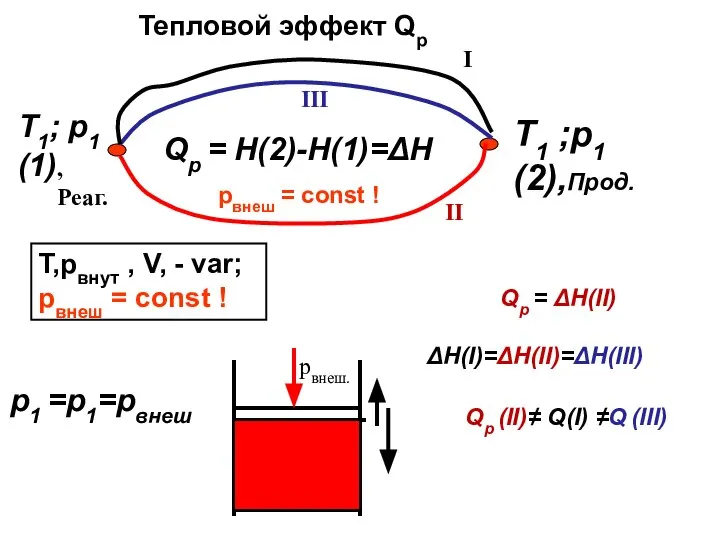
- 7. ТЕПЛОВЫЕ ЭФФЕКТЫ QV и Qр
- 8. QV = U(2)-U(1)=ΔU T,pвнут , pвнеш, - var; V = const ! Т1; р1 (1), Реаг.
- 9. Qp = H(2)-H(1)=ΔH T,pвнут , V, - var; pвнеш = const ! Тепловой эффект Qp рвнеш.
- 10. Обычный «путь» в калориметрии
- 11. Связь ∆Н и ∆U химической реакции. Для идеальных газов: pV = nRT Для твердых и жидких:
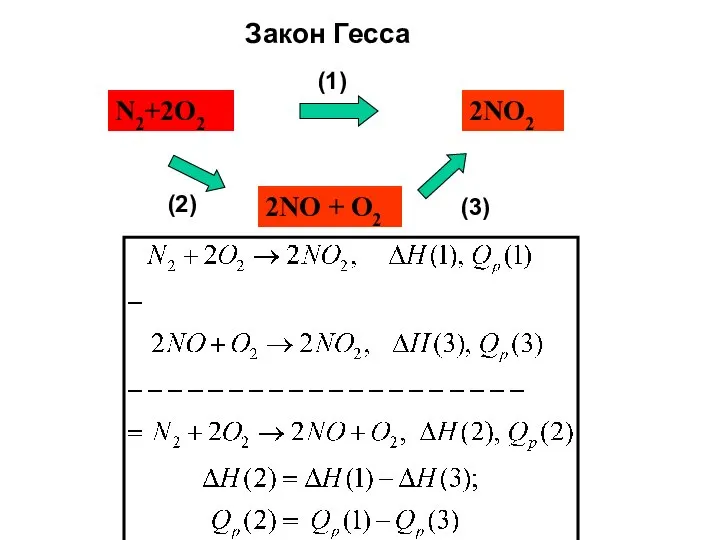
- 12. Энтальпии реакций. Закон Гесса.
- 13. N2+2O2 2NO2 2NO + O2 Закон Гесса (1) (2) (3)
- 14. Что такое закон Гесса ? Энтальпия химической реакции не зависит от способа её проведения. 2. Теплота
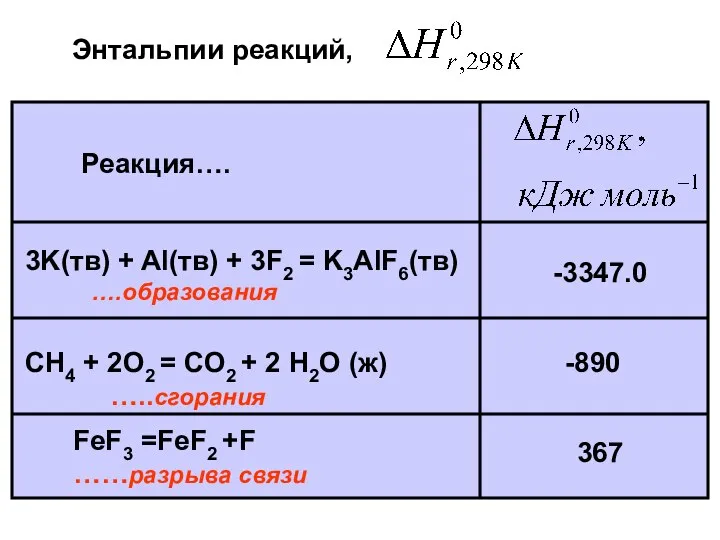
- 15. Реакция…. 3K(тв) + Al(тв) + 3F2 = K3AlF6(тв) ….образования FeF3 =FeF2 +F ……разрыва связи СH4 +
- 16. ЭНТАЛЬПИИ ОБРАЗОВАНИЯ Это энтальпии образования химических соединений из простых веществ: Простые вещества (элементы в своем естественном
- 17. Энтальпии образования простых веществ равны нулю: Энтальпия любой реакции равна разности энтальпий образования продуктов и реагентов
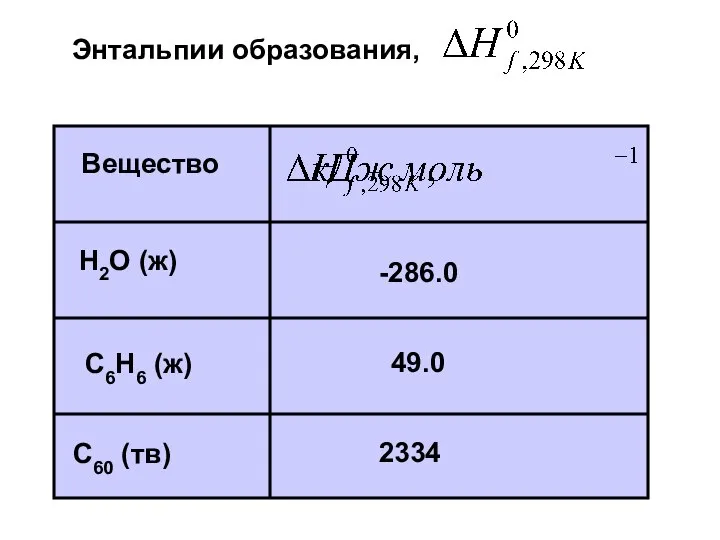
- 18. Вещество H2O (ж) C60 (тв) С6H6 (ж) -286.0 2334 49.0 Энтальпии образования,
- 19. 1 балл
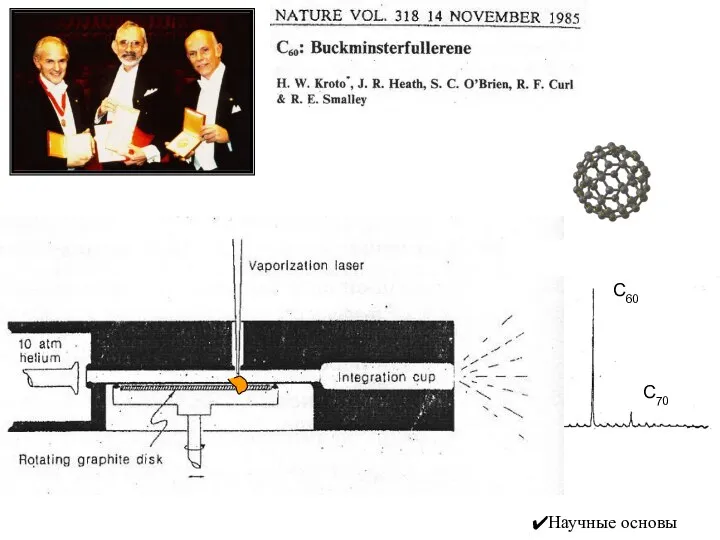
- 20. С60 С70 Научные основы
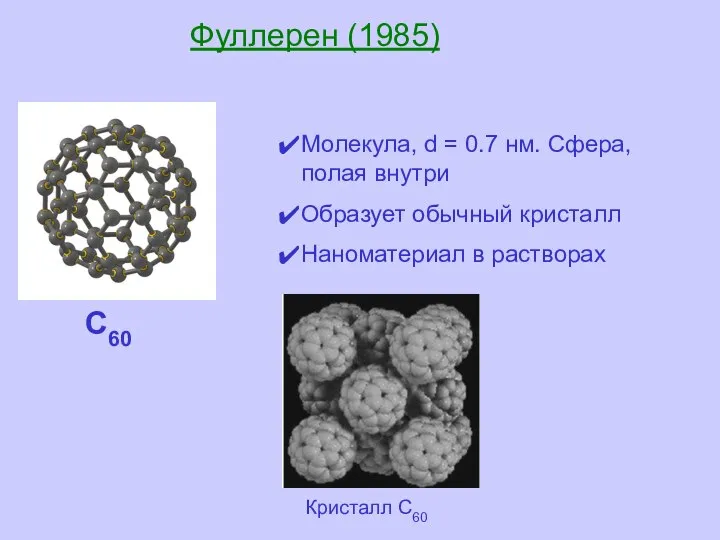
- 21. Фуллерен (1985) Молекула, d = 0.7 нм. Сфера, полая внутри Образует обычный кристалл Наноматериал в растворах
- 22. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ С60
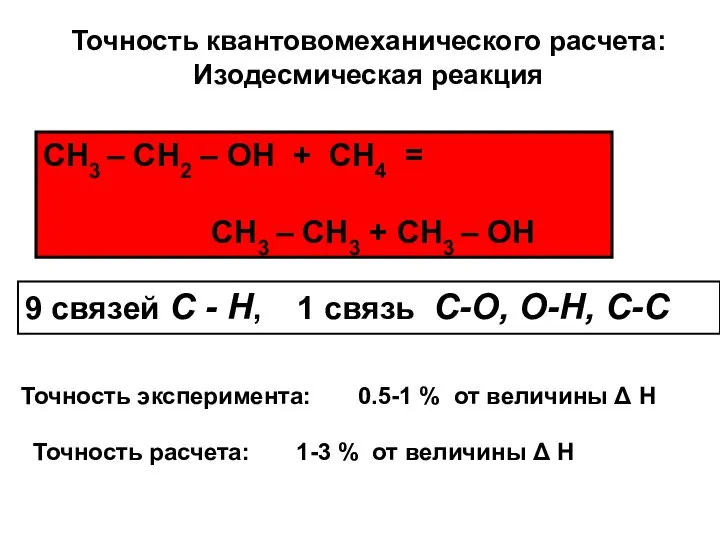
- 23. Точность квантовомеханического расчета: Изодесмическая реакция СН3 – СН2 – ОН + СН4 = СН3 – СН3
- 24. ТЕМПЕРАТУРНАЯ ЗАВИСИМОСТЬ ЭНТАЛЬПИЙ ХИМИЧЕСКИХ РЕАКЦИЙ
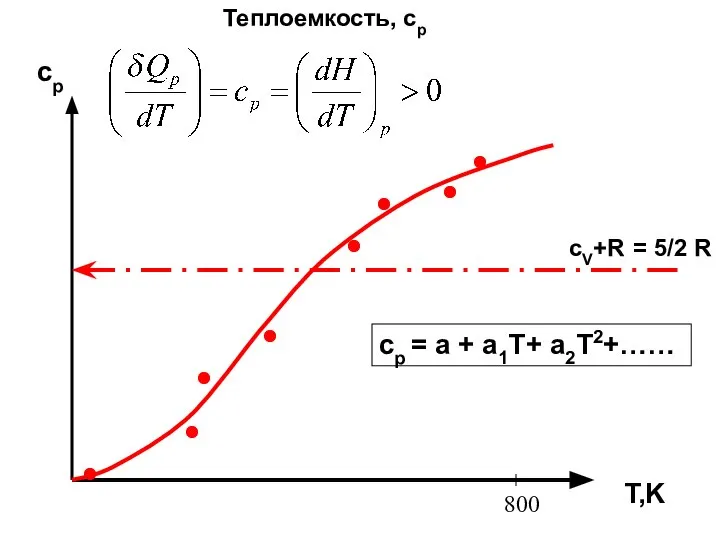
- 25. ЧТО ТАКОЕ ТЕПЛОЕМКОСТЬ ср?
- 26. Теплоемкость, ср T,K cp 800 cV+R = 5/2 R cp = a + a1T+ a2T2+……
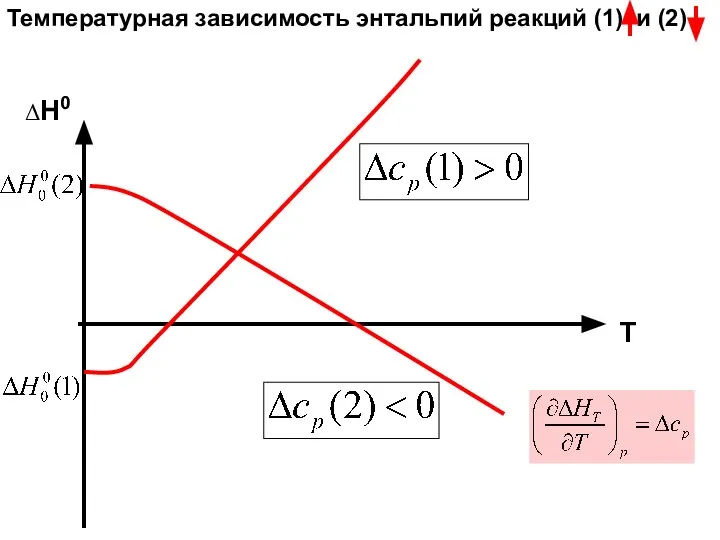
- 27. Температурная зависимость энтальпий реакций (1) и (2) Закон Кирхгофа.
- 28. ΔН0 Т Температурная зависимость энтальпий реакций (1) и (2)
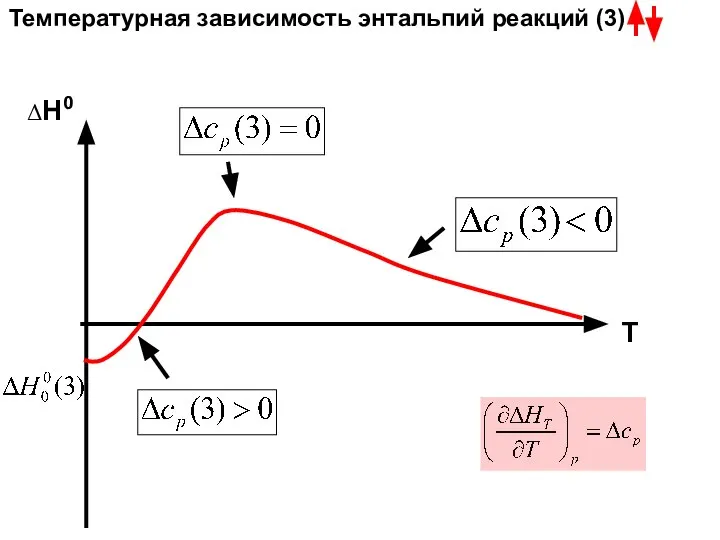
- 29. ΔН0 Т Температурная зависимость энтальпий реакций (3)
- 30. 1) Соответствует реакции, протекающей при постоянной температуре T; 2) Растет с увеличением температуры Т; 3) Если
- 31. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
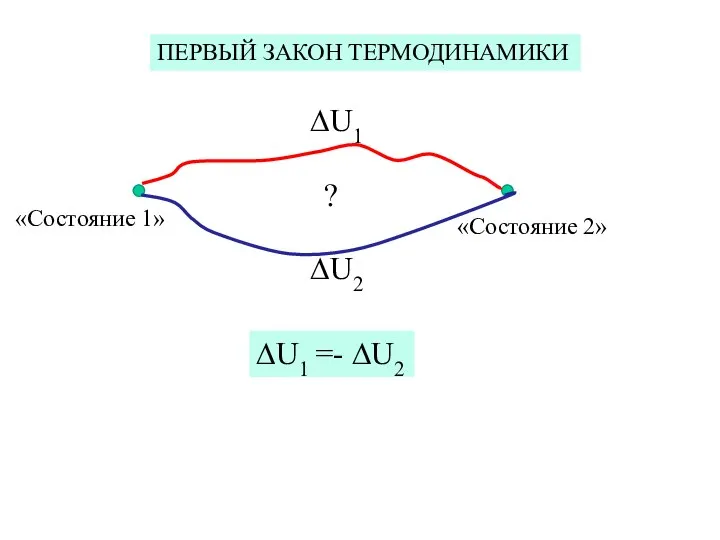
- 32. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ «Состояние 1» «Состояние 2» ∆U1 ∆U2 ∆U1 =- ∆U2 ?
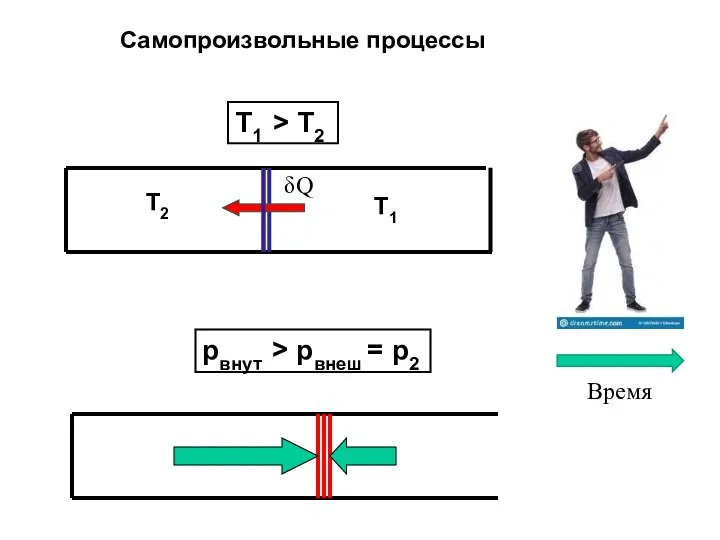
- 33. Т1 > T2 pвнут > pвнеш = p2 Самопроизвольные процессы Т1 T2 δQ Время
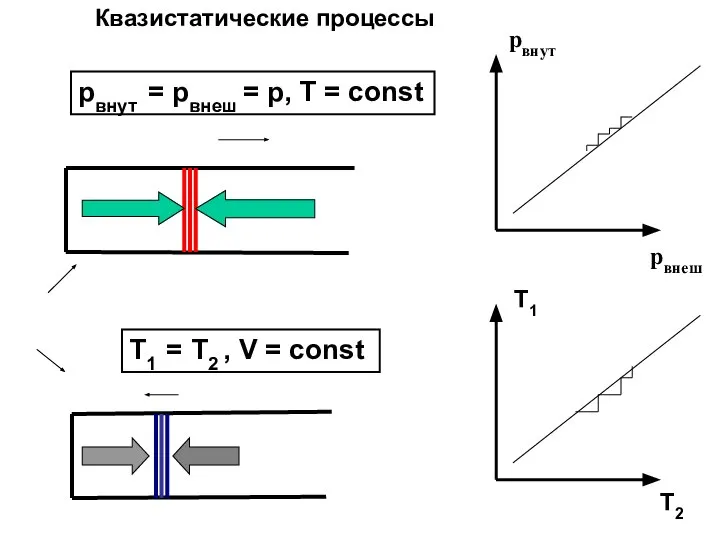
- 34. pвнут = pвнеш = p, T = const Т1 = Т2 , V = const Квазистатические
- 35. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ «Состояние 1» «Состояние 2» Q1 Q2
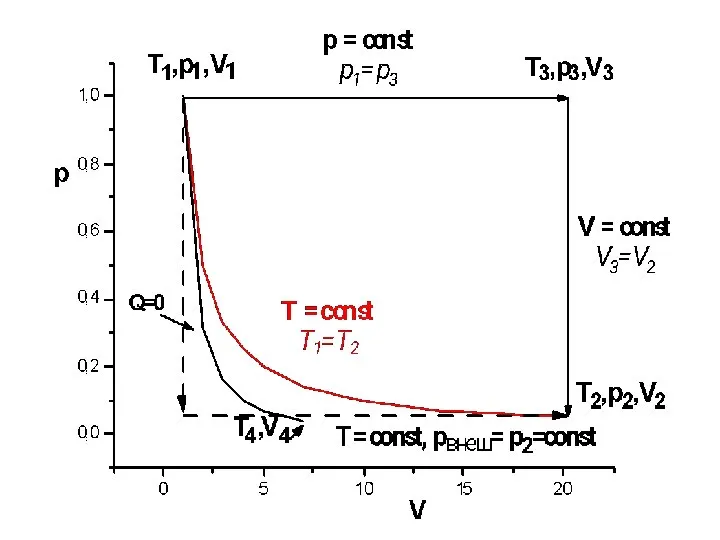
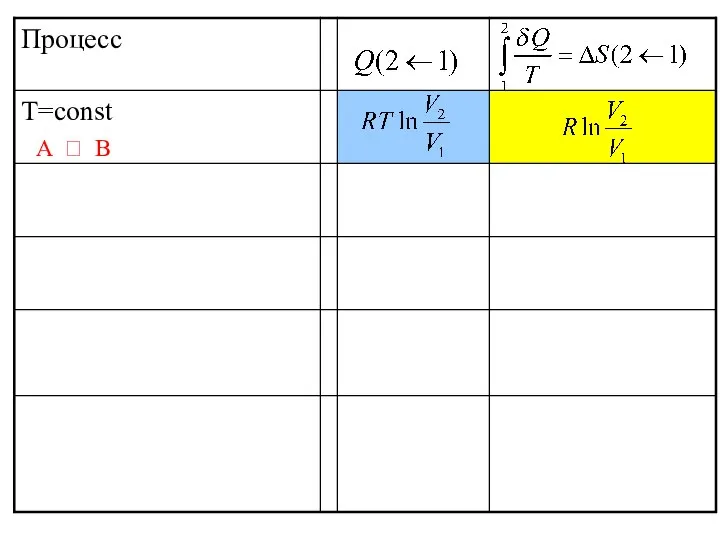
- 38. КВАЗИСТАТИЧЕСКИЙ, ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС. ИДЕАЛЬНЫЙ ГАЗ ∆U = 0 ; dU = δQ + δW ; δW
- 39. A ? B
- 41. КВАЗИСТАТИЧЕСКИЙ, ИЗОХОРИЧЕСКИЙ ПРОЦЕСС. ИДЕАЛЬНЫЙ ГАЗ dU = δQ + δW ; δQ = cVdT
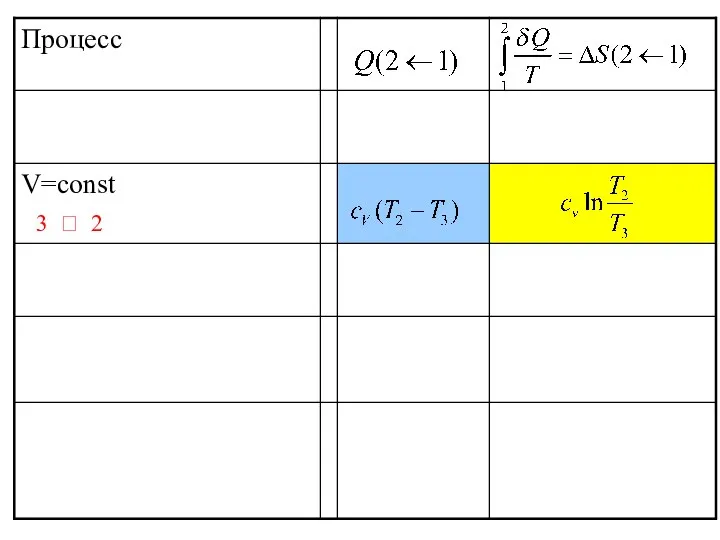
- 42. 3 ? 2
- 44. КВАЗИСТАТИЧЕСКИЙ, ИЗОБАРИЧЕСКИЙ ПРОЦЕСС. ИДЕАЛЬНЫЙ ГАЗ dU = δQ + δW ; δQ = cрdT
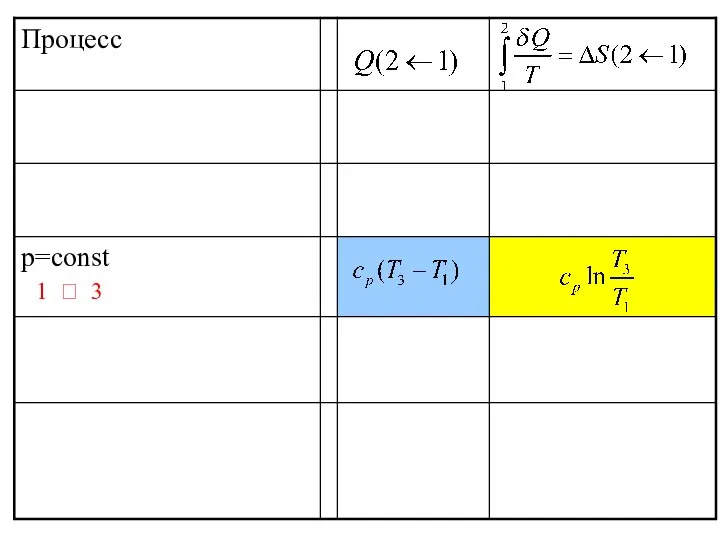
- 45. 1 ? 3
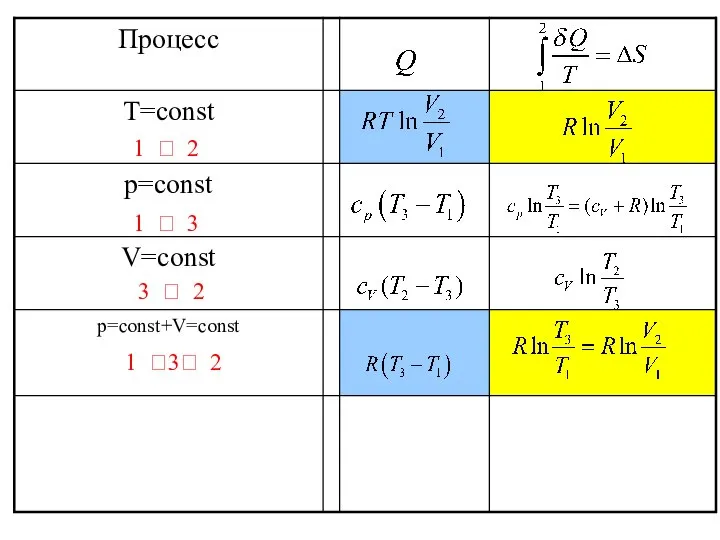
- 46. 1 ? 2 1 ?3? 2 3 ? 2 1 ? 3
- 48. Скачать презентацию


























 Теплофизика процесса резания
Теплофизика процесса резания Сила трения (7 класс)
Сила трения (7 класс) Давление твердых тел. Способы уменьшения и увеличения давления
Давление твердых тел. Способы уменьшения и увеличения давления Тема 3.2
Тема 3.2 тех мех. 2
тех мех. 2 Сложение ускорений. Теоретическая механика. Задачи
Сложение ускорений. Теоретическая механика. Задачи Движение тела в поле сил земного тяготения с учетом зависимости ускорения свободного падения от высоты
Движение тела в поле сил земного тяготения с учетом зависимости ускорения свободного падения от высоты Исаак Ньютон
Исаак Ньютон Магниты и их свойства. Магнетизм
Магниты и их свойства. Магнетизм Швидкість реакції між металом або сплавом з реакційним газом
Швидкість реакції між металом або сплавом з реакційним газом Источники звука. Звуковые колебания
Источники звука. Звуковые колебания Определение уравнения движения. Общий случай интегрального уравнения
Определение уравнения движения. Общий случай интегрального уравнения Исследовательская работа по физике на тему: Искусственные источники света и их практическая ценность. Автор: Дуров Лев 9б класс Н
Исследовательская работа по физике на тему: Искусственные источники света и их практическая ценность. Автор: Дуров Лев 9б класс Н Динамика материальной точки
Динамика материальной точки Идеальный газ
Идеальный газ Магнитное поле
Магнитное поле Контрольная
Контрольная Презентация на тему Плавание тел
Презентация на тему Плавание тел  Презентация на тему Молекулярная физика. Ученые и их открытия
Презентация на тему Молекулярная физика. Ученые и их открытия 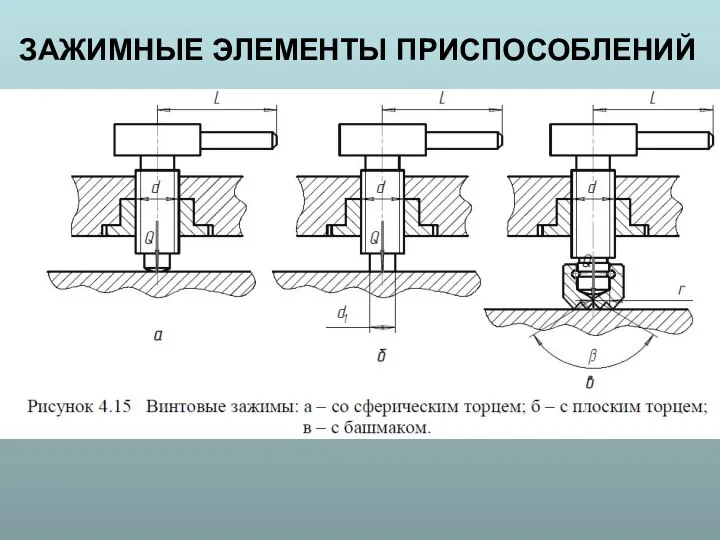 Зажимные элементы приспособлений
Зажимные элементы приспособлений Магнитный поток. 11 класс
Магнитный поток. 11 класс Электрические конденсаторы
Электрические конденсаторы Математическое моделирование процесса теплопередачи в атмосферном газификаторе СПГ
Математическое моделирование процесса теплопередачи в атмосферном газификаторе СПГ Учебное Занятие по устройству автомобилей в гр.КТ-85, КТ-32 прошло на выставке SPB Transport Fest
Учебное Занятие по устройству автомобилей в гр.КТ-85, КТ-32 прошло на выставке SPB Transport Fest Серво привод с электромеханическим распором
Серво привод с электромеханическим распором История тепловых двигателей
История тепловых двигателей Магнитостатическое поле в вакууме. Часть 3
Магнитостатическое поле в вакууме. Часть 3 ВКР: Розрахунок режимів роботи електричних мереж
ВКР: Розрахунок режимів роботи електричних мереж