Содержание
- 3. Что такое химическая связь? Под химической связью понимают электрические силы притяжения, удерживающие частицы (атомы, ионы, молекулы)
- 4. В чем причина образования химической связи? Причиной образования химической связи является стремление атома завершить свой внешний
- 5. Что такое электроотрицательность (Э.О.)? Электроотрицательность – это способность атомов оттягивать на себя электроны от соседнего атома
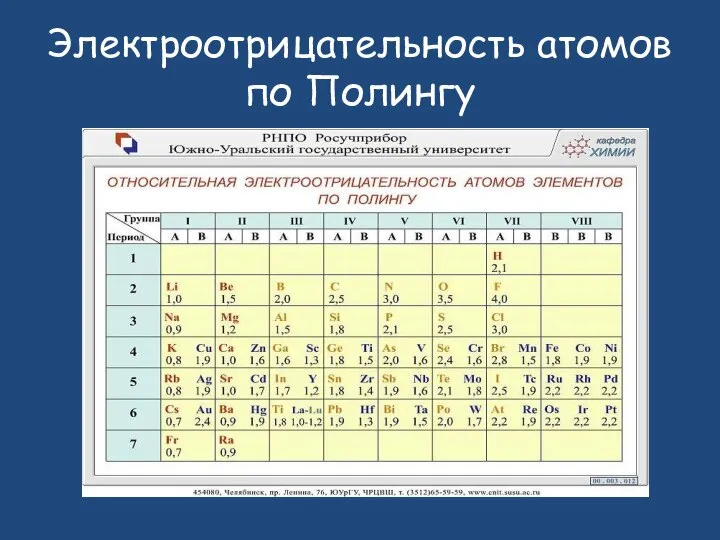
- 6. Электроотрицательность атомов по Полингу
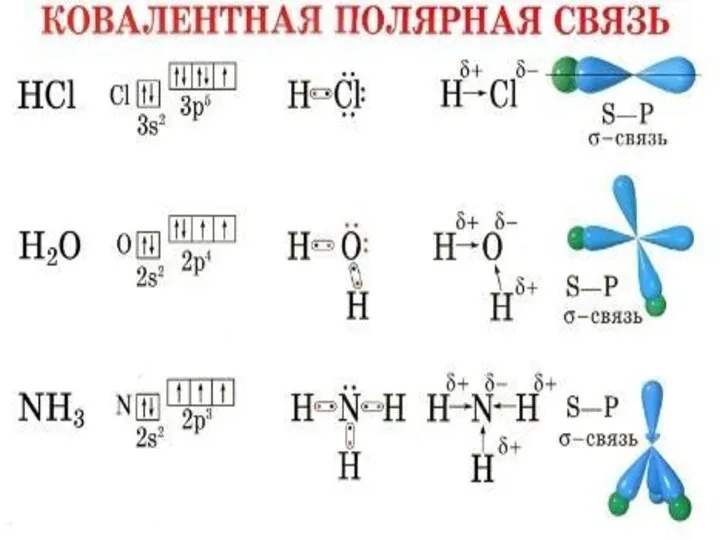
- 7. Какие существуют виды химической связи? Ковалентная неполярная – если атомы не отличаются по электроотрицательности. Ковалентная полярная
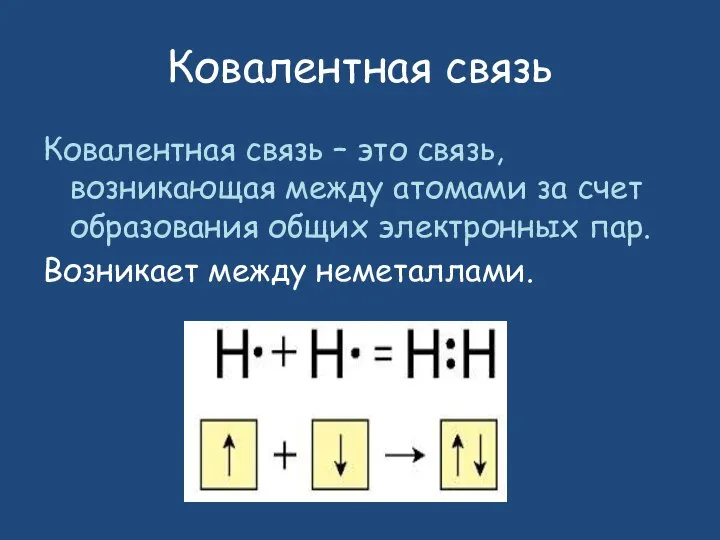
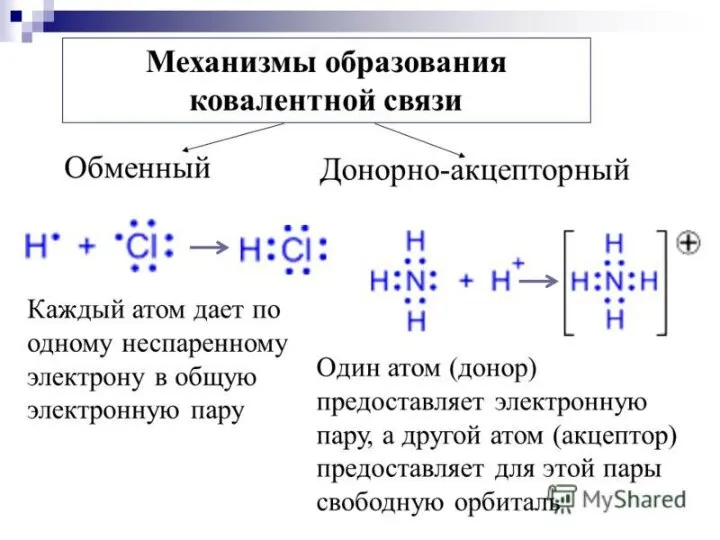
- 8. Ковалентная связь Ковалентная связь – это связь, возникающая между атомами за счет образования общих электронных пар.
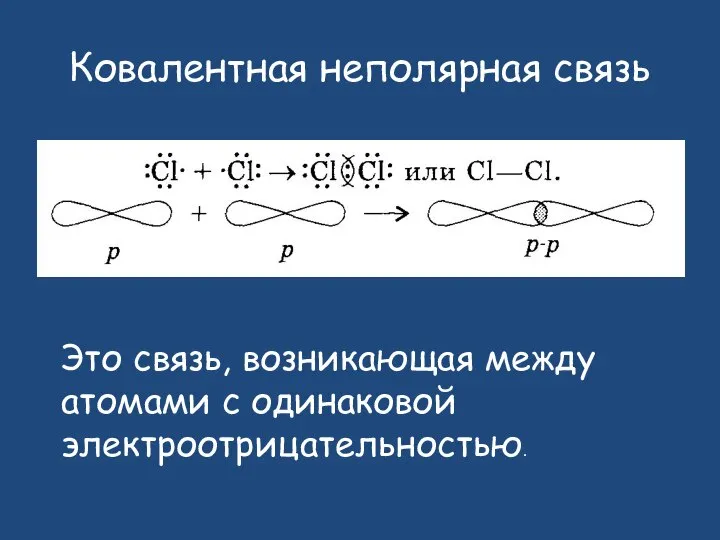
- 10. Ковалентная неполярная связь Это связь, возникающая между атомами с одинаковой электроотрицательностью.
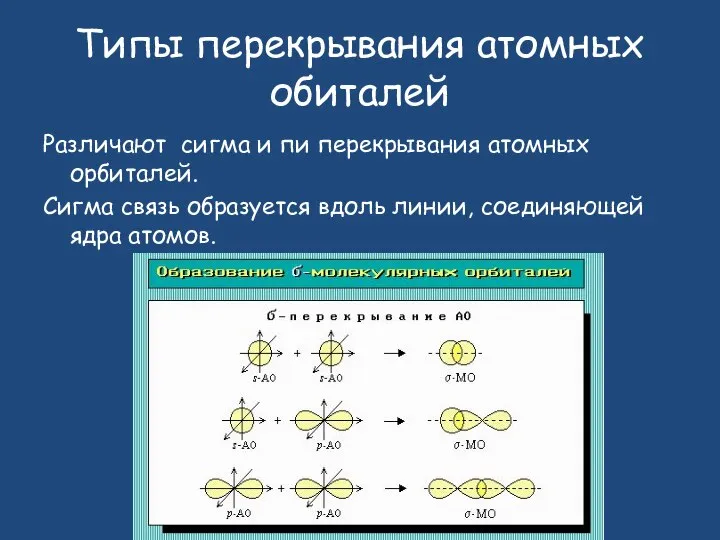
- 12. Типы перекрывания атомных обиталей Различают сигма и пи перекрывания атомных орбиталей. Сигма связь образуется вдоль линии,
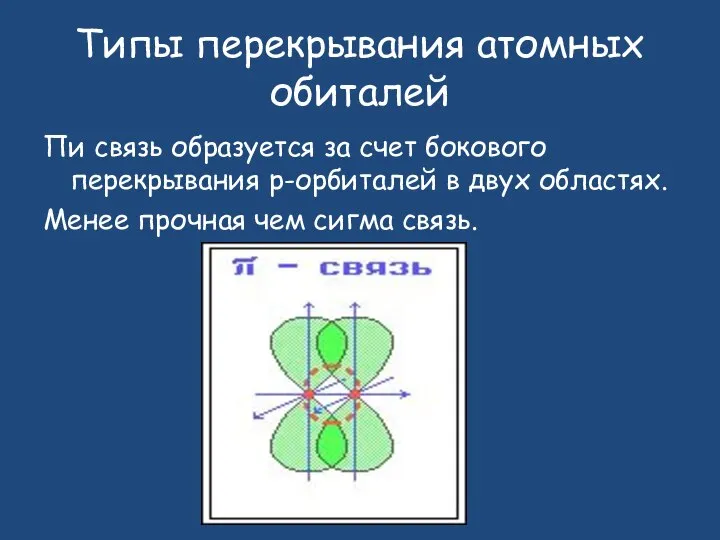
- 13. Пи связь образуется за счет бокового перекрывания р-орбиталей в двух областях. Менее прочная чем сигма связь.
- 14. Кратность ковалентной связи Различают: Одинарные (только сигма связь) F – F; Двойные (сигма + пи связи)
- 15. Ионная связь Связь, которая образуется за счет электростатического притяжения противоположно заряженных частиц (ионов). При образовании ионной
- 16. Ионная связь Атом, принимающий электроны, называется анионом, он приобретает отрицательный заряд (т.е. имеет избыток электронов). +
- 18. Задания: Напишите механизм образования химической связи для следующих соединений: сульфид натрия, карбид алюминия, нитрид кальция, нитрид
- 20. Водородная связь Это связь, возникающая между положительно поляризованными атомами водорода одной молекулы (или ее части) и
- 21. Водородная связь Механизм образования водородной связи частично имеет электростатический, а частично донорно-акцепторный механизм. Наличие водородной связи
- 22. Типы кристаллических решеток Кристаллическая решетка – это упорядоченное расположение частиц вещества. Различают следующие типы: атомная; молекулярная
- 23. Ионная кристаллическая решетка Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с
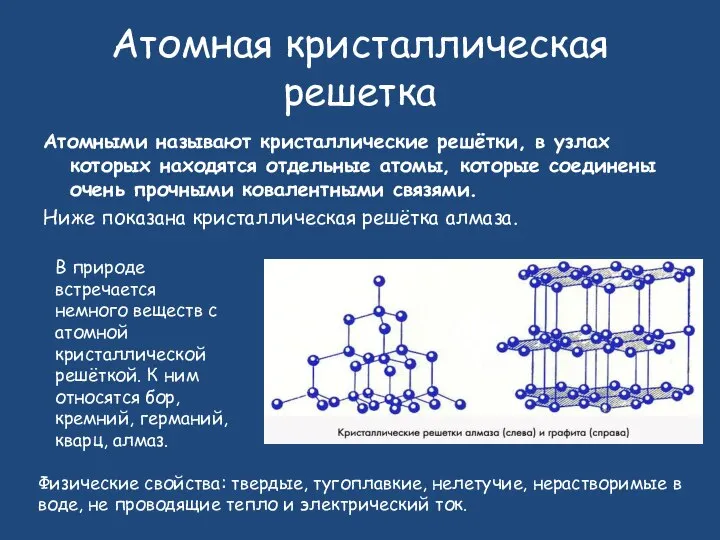
- 24. Атомная кристаллическая решетка Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень
- 25. Молекулярная кристаллическая решетка Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них
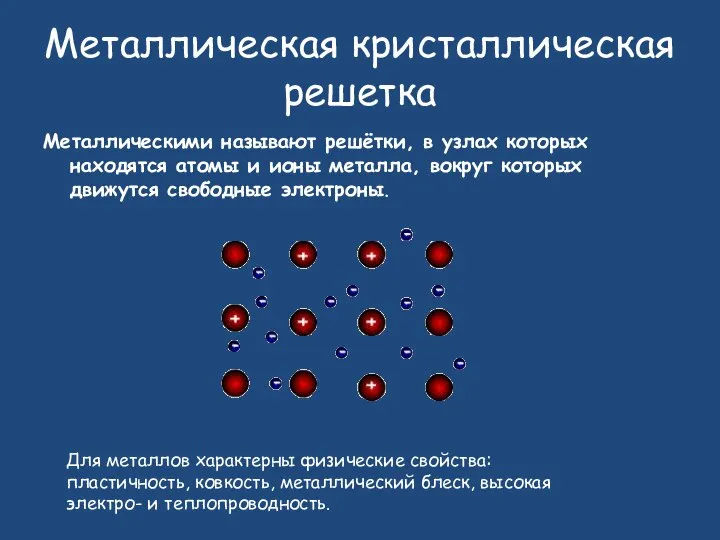
- 26. Металлическая кристаллическая решетка Металлическими называют решётки, в узлах которых находятся атомы и ионы металла, вокруг которых
- 27. Единая природа химической связи Деление химических связей на типы носит условный характер. Это доказывает то, что:
- 29. Скачать презентацию

















 Неметаллы
Неметаллы Искусственные и синтетические полимеры
Искусственные и синтетические полимеры Медь и ее сплавы
Медь и ее сплавы Хлордың қолданылуы
Хлордың қолданылуы Соединения серы. Сернистая и серная кислоты
Соединения серы. Сернистая и серная кислоты Строение вещества
Строение вещества Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Виды химической связи
Виды химической связи Презентация на тему Алкины
Презентация на тему Алкины  Олово
Олово Сложные неорганические вещества
Сложные неорганические вещества Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски Типы кристаллических решеток
Типы кристаллических решеток Алкены
Алкены Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Карбоновые кислоты
Карбоновые кислоты Примеры карбоновых кислот
Примеры карбоновых кислот Презентация на тему Нанотехнологии и Наноматериалы
Презентация на тему Нанотехнологии и Наноматериалы  Дисперсные системы. Тест
Дисперсные системы. Тест Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева
Металлы и неметаллы. Знакомство с периодической системой Д. И. Менделеева Щелочные металлы
Щелочные металлы Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Значение химии в медицине
Значение химии в медицине Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс  Производство аммиака
Производство аммиака кинетика (1)
кинетика (1) Коррозия металлов. Лекция №8
Коррозия металлов. Лекция №8