Содержание
- 2. Химическая кинетика – раздел химии, изучающий закономерности протекания химических процессов во времени Основное понятие химической кинетики
- 3. Основные понятия химической кинетики Химическая кинетика изучает скорости и механизмы химических процессов, а также факторы, влияющие
- 4. Типы химических реакций I. Элементарные реакции (одностадийные, простые) протекают в одну стадию: 2NO + O2 →
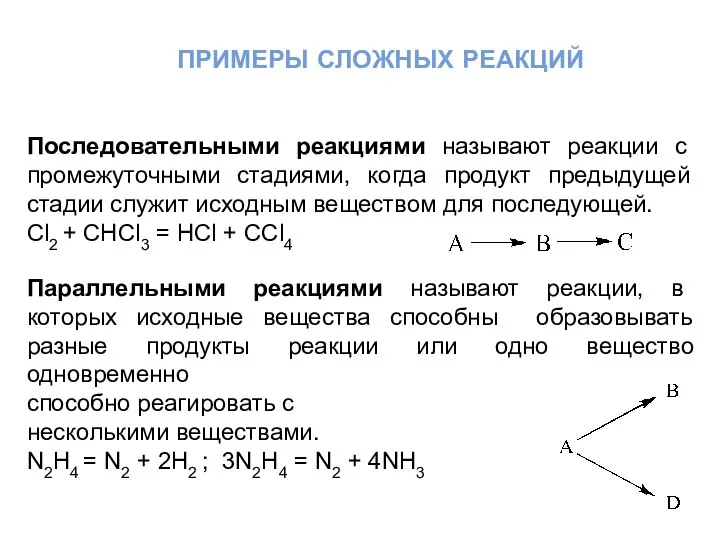
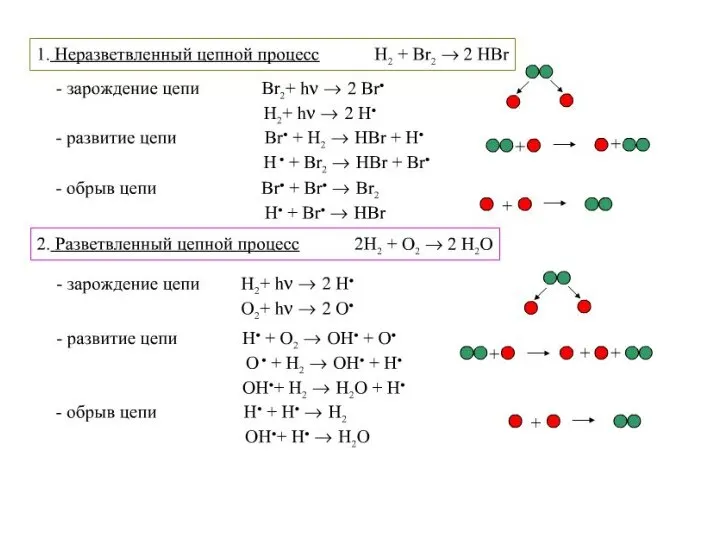
- 5. примеры сложных реакций Последовательными реакциями называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным
- 6. II Гомогенные реакции – протекают в объеме одной фазы: NaOH (раствор)+ НCl (раствор) = = NaCl
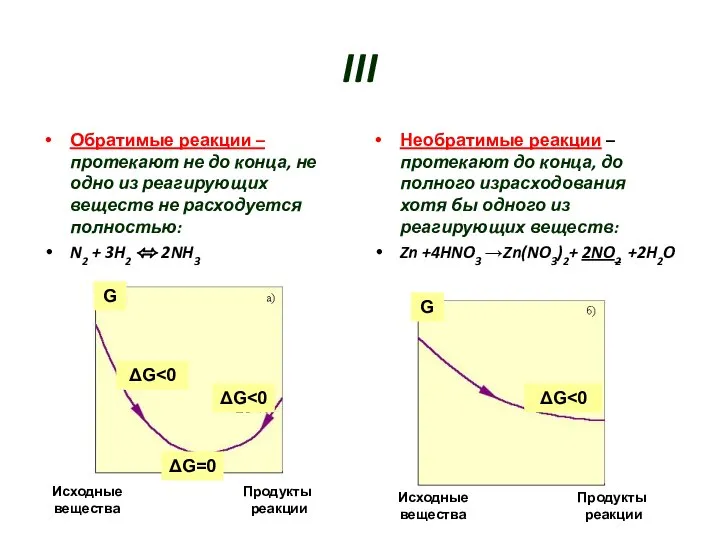
- 7. III Обратимые реакции – протекают не до конца, не одно из реагирующих веществ не расходуется полностью:
- 8. Молекулярность реакции определяется числом молекул, одновременным взаимодействием между которыми осуществляется элементарный химический акт Мономолекулярная реакция: N2O5
- 9. скорость химической реакции Под скоростью гомогенной химической реакции (ν) понимают изменение количества вещества (∆n) за единицу
- 10. Скорость реакции в гомогенных системах – средняя скорость реакции в интервале времени , – изменение количества
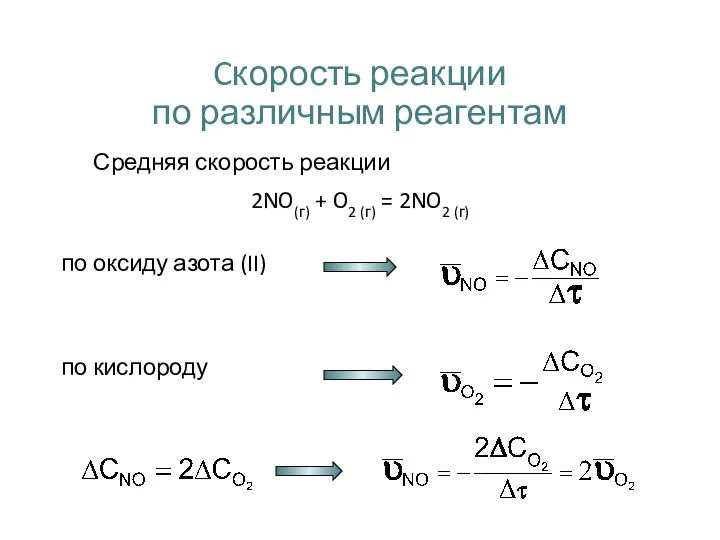
- 11. Cкорость реакции по различным реагентам Средняя скорость реакции 2NO(г) + O2 (г) = 2NO2 (г) по
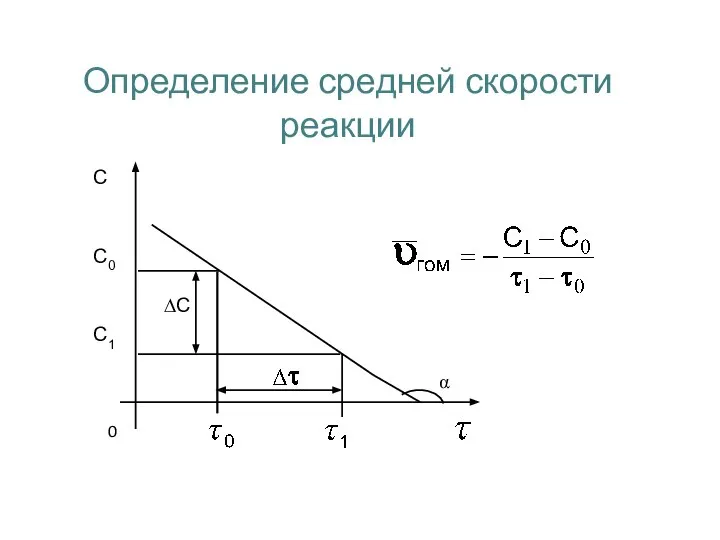
- 12. Определение средней скорости реакции 0 α ∆С С0 С1 С
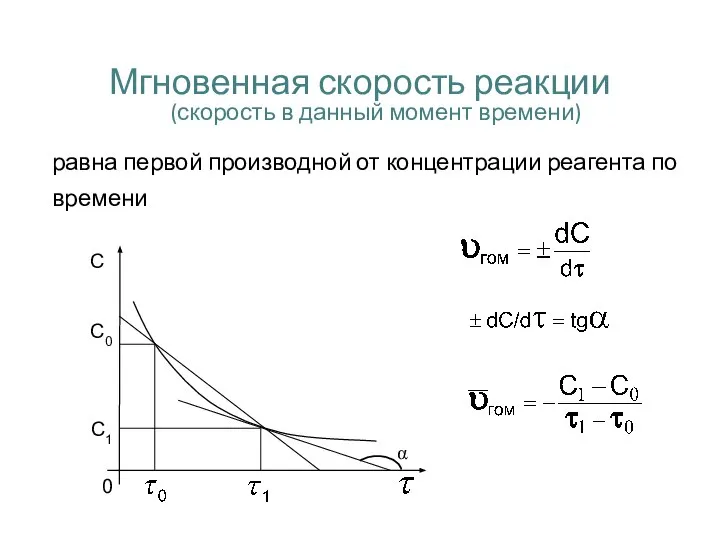
- 13. Мгновенная скорость реакции (скорость в данный момент времени) равна первой производной от концентрации реагента по времени
- 14. Скорость реакции в гетерогенных системах В гетерогенной системе взаимодействие компонентов происходит на поверхности раздела фаз S
- 16. Закон: Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. aA
- 17. константа скорости реакции k – коэффициент пропорциональности, называемый константой скорости реакции физический смысл Константа скорости численно
- 18. кинетические уравнения Кинетическое уравнение – это математическое выражение, связывающие скорость реакции с концентрацией реагирующих веществ. Для
- 19. Порядок реакции Показатель степени при концентрации каждого из реагирующих веществ в кинетическом уравнении химической реакции есть
- 23. Особенности гетерогенных реакций Стадии гетерогенных реакций : подвод вещества к реакционной поверхности химическое взаимодействие отвод продукта
- 24. Влияние давления на скорость химической реакции Влияние давления существенно для реакций с участием газообразных веществ, так
- 25. Зависимость скорости от температуры Правило Вант-Гоффа При повышении температуры на каждые 100 скорость большинства реакций увеличивается
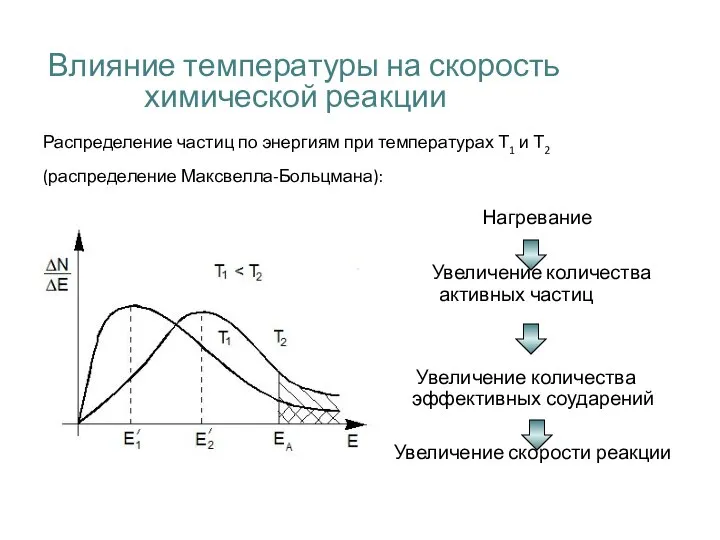
- 26. Влияние температуры на скорость химической реакции Распределение частиц по энергиям при температурах Т1 и Т2 (распределение
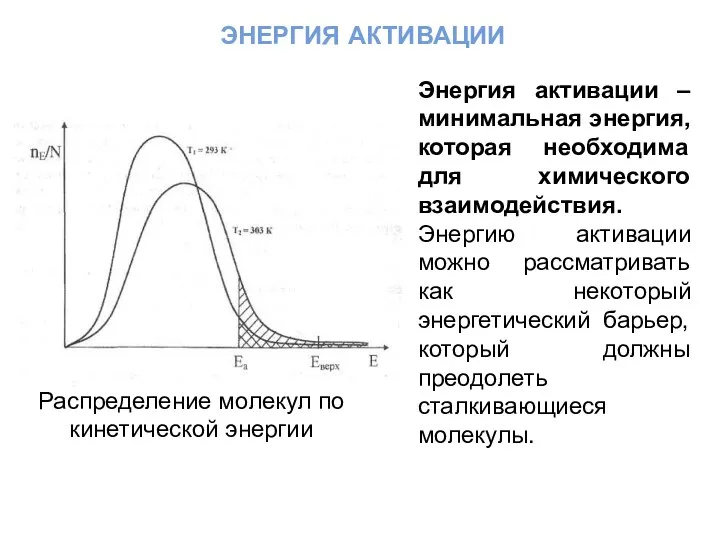
- 27. энергия активации Распределение молекул по кинетической энергии Энергия активации –минимальная энергия, которая необходима для химического взаимодействия.
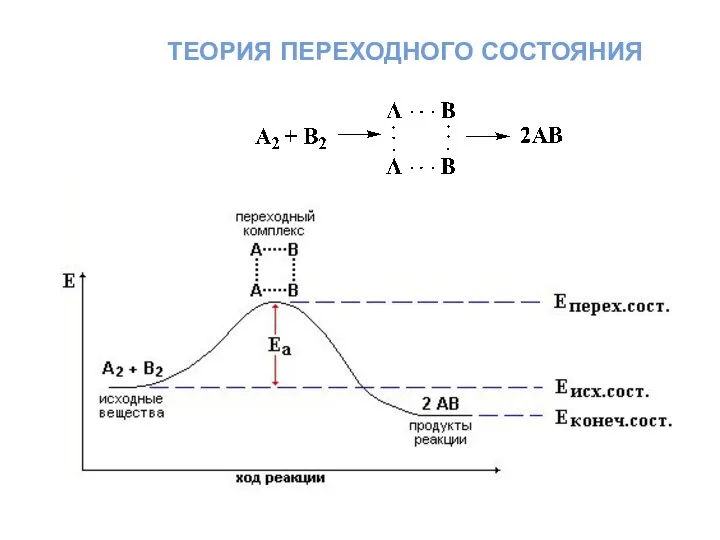
- 28. теория переходного состояния
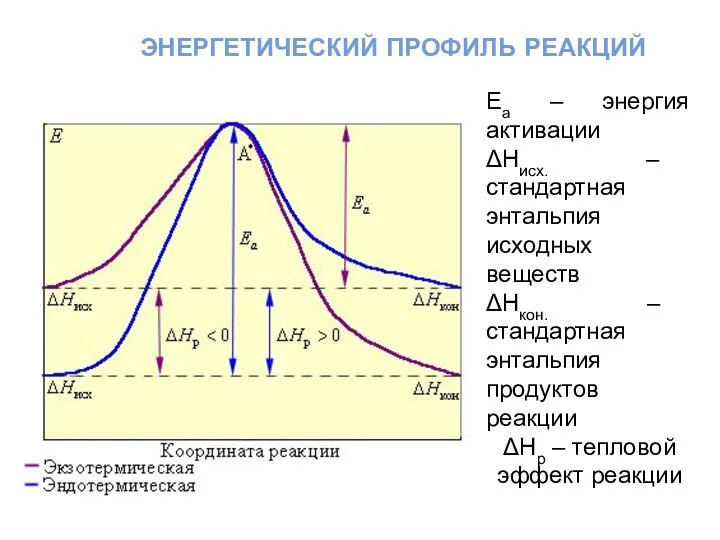
- 29. энергетический профиль реакций Еа – энергия активации ΔНисх. – стандартная энтальпия исходных веществ ΔНкон. – стандартная
- 30. Зависимость константы скорости от температуры Уравнение Аррениуса Еа ‑ энергия активации, кДж/моль R ‑ универсальная газовая
- 31. катализатор Вещества, не расходующиеся в результате протекания реакции, но влияющие на ее скорость называются катализаторами. Явление
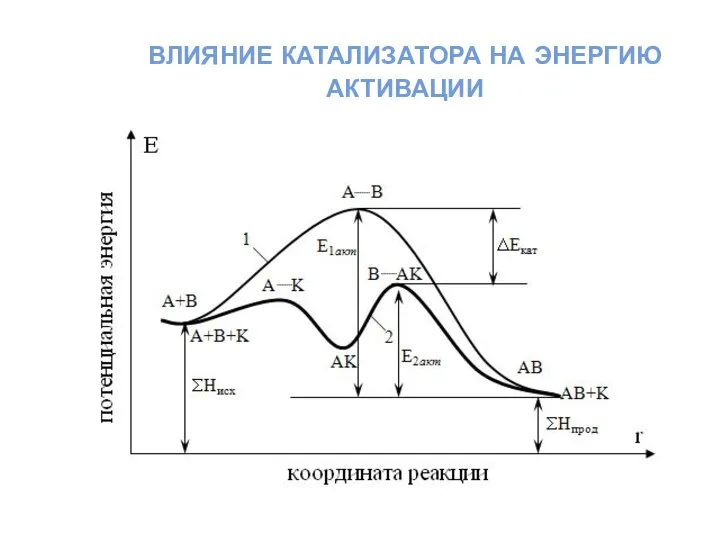
- 32. влияние катализатора на энергию активации
- 34. Примеры катализа Гомогенный катализ I- схема реакции: 2H2O2 →2H2O+O2 1. H2O2 + I- ⇔ H2O +
- 35. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 36. обратимые и необратимые реакции Обратимые реакции - это реакции, которые при одних и тех же условиях
- 37. химическое равновесие Состояние обратимой реакции, при котором скорость прямой реакции равна скорости обратной реакции, называется химическим
- 39. константа химического равновесия Константа химического равновесия - это отношение произведения равновесных концентраций продуктов реакции к произведению
- 40. Константы равновесия некоторых реакций
- 41. Анри Луи Ле Шателье (1884)
- 42. факторы, влияющие на смещение химического равновесия 1. Концентрация. При увеличении концентрации исходных веществ химическое равновесие смещается
- 44. Скачать презентацию





























 Презентация на тему Химия и здоровье человека (10 класс)
Презентация на тему Химия и здоровье человека (10 класс)  Ионная хроматография
Ионная хроматография Причины протекания химических реакций
Причины протекания химических реакций Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Окисление этанола оксидом меди
Окисление этанола оксидом меди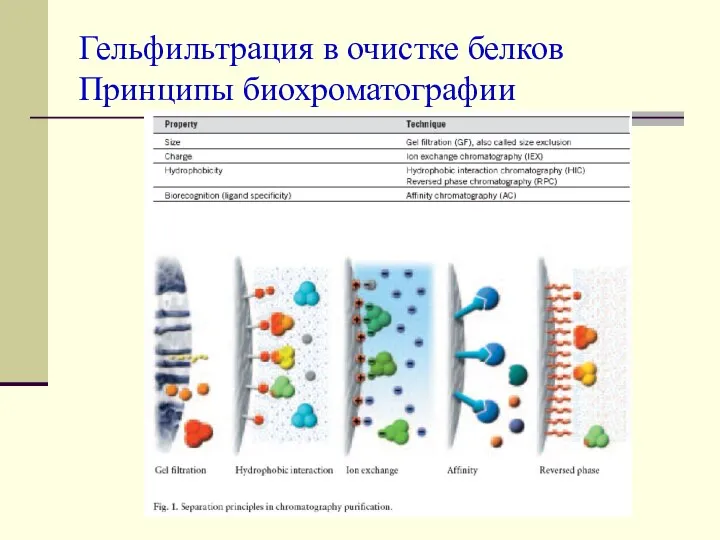 Гельфильтрация в очистке белков. Принципы биохроматографии
Гельфильтрация в очистке белков. Принципы биохроматографии Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Красители для волос. Первая группа
Красители для волос. Первая группа Минеральные вещества и здоровье
Минеральные вещества и здоровье Эпоксидті полимер материалдарының қасиеттерін зерттеу
Эпоксидті полимер материалдарының қасиеттерін зерттеу Какой химический элемент алхимики обозначали таким символом? Интеллектуальная игра
Какой химический элемент алхимики обозначали таким символом? Интеллектуальная игра Путешествие по морю
Путешествие по морю Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах
Закономерности изменения окислительно-востановительных свойств соединений в периодах и группах Органическая геохимия
Органическая геохимия Кремний Полупроводники в электронике_Горб
Кремний Полупроводники в электронике_Горб Материаловедение. Полимерные материалы
Материаловедение. Полимерные материалы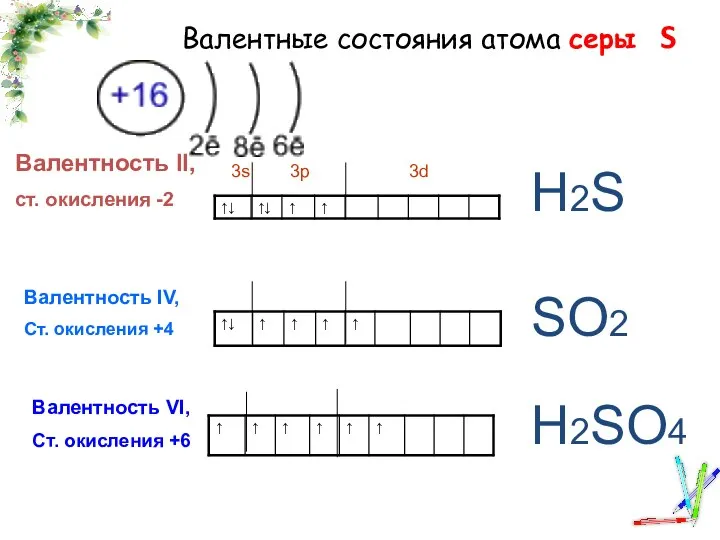 Валентные состояния атома серы
Валентные состояния атома серы Реакционная способность углеводородов. Реакции SR, АЕ , SЕ
Реакционная способность углеводородов. Реакции SR, АЕ , SЕ Олимпиада Ломоносов
Олимпиада Ломоносов Получение галогеноалканов
Получение галогеноалканов Алюміній. Фізичні та хімічні властивості
Алюміній. Фізичні та хімічні властивості Таблица Менделеева
Таблица Менделеева Изучение свойств пластичных масс для лепки
Изучение свойств пластичных масс для лепки Водные растворы электролитов
Водные растворы электролитов Минерал дунит
Минерал дунит Генетическая связь между классами неорганических веществ
Генетическая связь между классами неорганических веществ Неон
Неон