Содержание
- 2. Цели урока: В занимательной форме обобщить, закрепить, систематизировать и проверить степень усвоения знаний о свойствах азота,
- 3. Девиз урока: « Мало знать, надо и применять. Мало хотеть, надо и делать» Гёте
- 4. Приветствуем участников игры: 1 команда «Азот»; 2 команда «Аммиак»; 3 команда «Азотная кислота»; 4 команда «Фосфор».
- 5. 1 конкурс «Презентация команд» Придумать девиз и сделать сообщение о веществе, которым названа ваша команда, рассказать
- 6. Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ
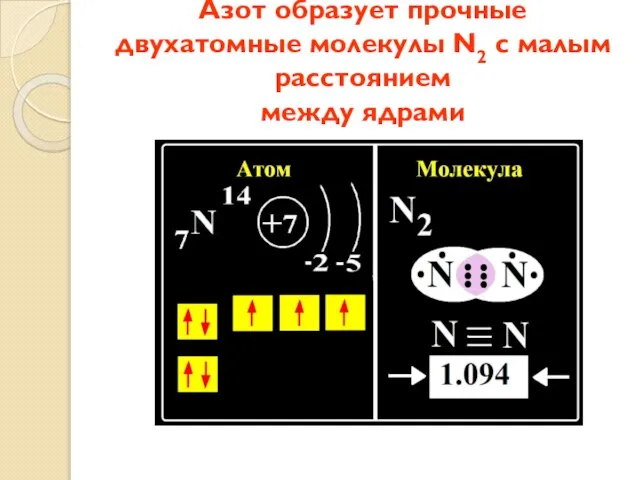
- 7. Азот образует прочные двухатомные молекулы N2 с малым расстоянием между ядрами
- 8. Азот в соединениях может проявлять как отрицательную, так и положительную СО.
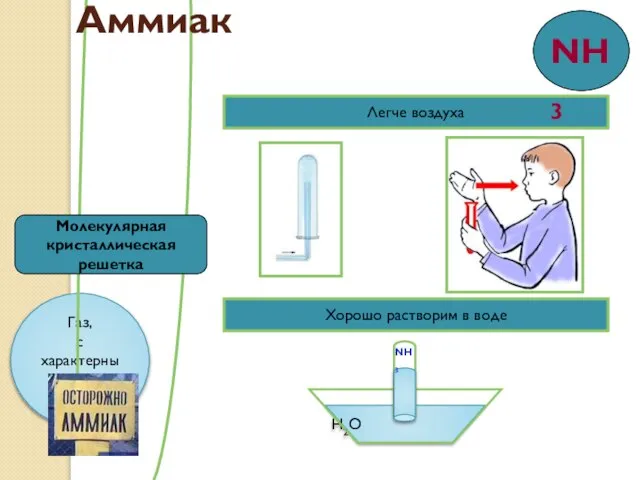
- 9. Легче воздуха Хорошо растворим в воде H2O NH3 Молекулярная кристаллическая решетка Аммиак
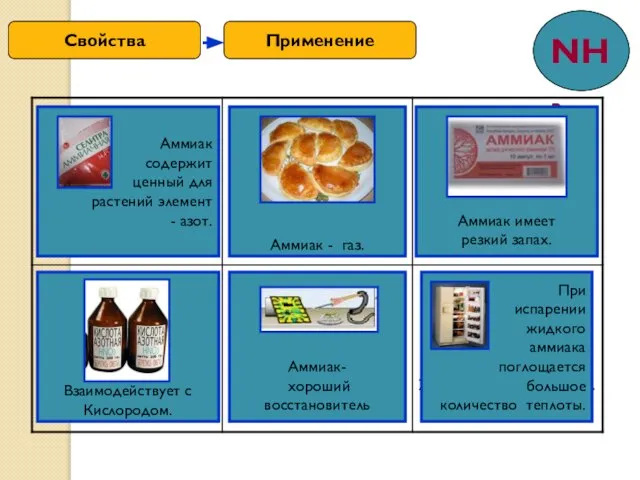
- 10. Применение Свойства
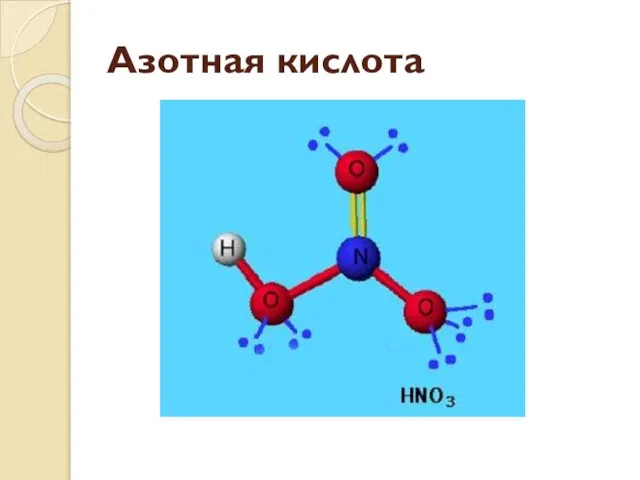
- 11. Азотная кислота
- 12. Одна связь с кислородом образуется по донорно-акцепторному механизму, но из-за близости расположения атомов в молекуле становятся
- 13. Азотная кислота широко используется для производства азотных удобрений, искусственных волокон, органических красителей, лаков и взрывчатых веществ.
- 14. неметалл, Ar=31 V группа, главная подгруппа 3 период, 3 ряд степени окисления -3.0,+1,+3,+5. оксиды Р2О3 и
- 15. 8.Применение. Белый фосфор применяют для получения других его аллотропных модификаций, фосфорных кислот, фосфатов, как боевое зажигательное
- 16. Красный фосфор применяют для изготовления спичек и как наполнитель (пары) в лампах накаливания для производства удобрений
- 17. История открытия. В поисках “философского камня” немецкий алхимик Х. Бранд занимался перегонкой сухого остатка от выпаривания
- 18. 2 конкурс «Самый быстрый» 1. Почему Даниэль Резерфорд назвал открытый им газ «зловредным», а Антуан Лавуазье
- 19. 2 конкурс «Самый быстрый» 4. Как получают азот в промышленности? 5. Почему азот называют «элементом жизни»?
- 20. 2 конкурс «Самый быстрый» 8. Каким способом следует собирать аммиак? Почему? 9. Как можно распознать аммиак?
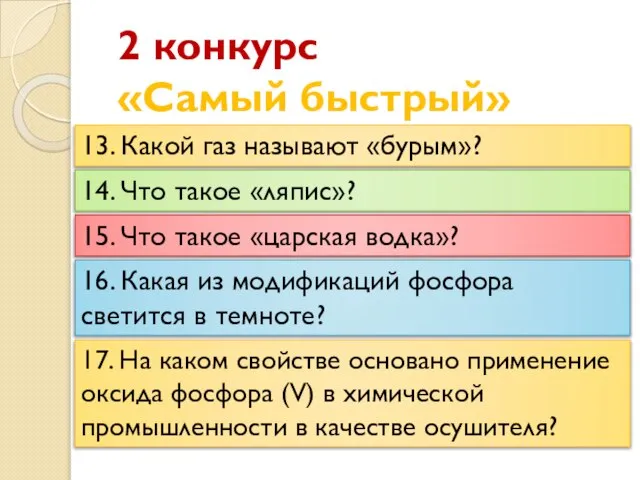
- 21. 2 конкурс «Самый быстрый» 13. Какой газ называют «бурым»? 14. Что такое «ляпис»? 15. Что такое
- 22. По одному представителю от каждой команды выбирают конверт с условием задачи и решают её у доски.
- 23. Все члены команд разгадывают кроссворд. Команда, первая отгадавшая кроссворд поднимает руку и оформляет ответы на доске.
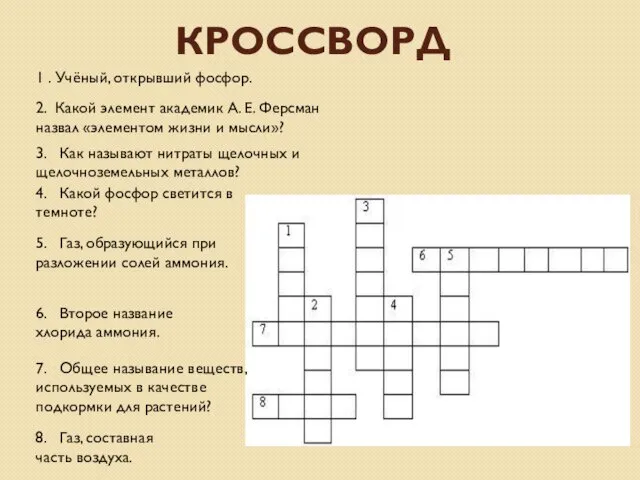
- 24. КРОССВОРД 1 . Учёный, открывший фосфор. 2. Какой элемент академик А. Е. Ферсман назвал «элементом жизни
- 25. Какая из команд быстрее и больше заметит ошибок, допущенных в прочитанном тексте. Оценка конкурса: По 1
- 26. ТЕКСТ: «…Азот образует несколько соединений с водородом, из них наибольшее значение имеет аммиак. Это бесцветный газ,
- 27. Решение задач: Задача № 1 Дано:
- 28. Решение задач: Задача № 1 Дано:
- 29. Оценка конкурса: Команды, которые первые справились с заданием, сообщают результаты опытов, записывают на доске уравнения реакций,
- 30. 1. Доказать, что в состав сульфата аммония входят ионы аммония NH4+ и сульфат-ионы SO42-; 2. Распознать
- 31. Командам предлагается для эстафеты выбрать цепочку превращений и приступить к её решению у доски. 6 конкурс
- 32. Каждому участнику семинара выполнить тестовую работу на выданных карточках. Необходимо выделить правильный ответ. Заключение Например: Вопрос
- 34. Скачать презентацию

























 Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Процессы подготовки горючих ископаемых к переработке. Лекция № 2
Процессы подготовки горючих ископаемых к переработке. Лекция № 2 Алканы 10-класс
Алканы 10-класс Разбор задач
Разбор задач Алкины
Алкины Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич
Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Диффузия и осмос
Диффузия и осмос Методы изготовления из резины и латекса
Методы изготовления из резины и латекса Химия вокруг нас
Химия вокруг нас Силикатная промышленность: Вчера, сегодня, завтра
Силикатная промышленность: Вчера, сегодня, завтра История чернил
История чернил Виды изомерии. Углеводороды
Виды изомерии. Углеводороды Радон (222Rn)
Радон (222Rn) Материаловедение. Стали. Свойства сталей. Классификация сталей
Материаловедение. Стали. Свойства сталей. Классификация сталей Электронные оболочки атомов
Электронные оболочки атомов Полупроводниковые твердые растворы
Полупроводниковые твердые растворы Ацетиленовые углеводороды (алкины). Лекция №7
Ацетиленовые углеводороды (алкины). Лекция №7 Problem-solving. Test: real-time polymerase chain reaction
Problem-solving. Test: real-time polymerase chain reaction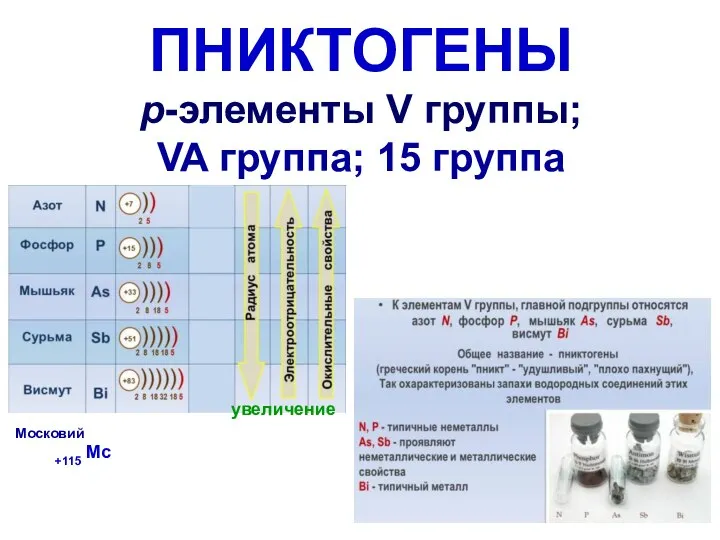 Пниктогены р-элементы V группы; VA группа; 15 группа
Пниктогены р-элементы V группы; VA группа; 15 группа Химия 11 класс
Химия 11 класс Сульфиды (2)
Сульфиды (2) Валентность
Валентность Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители Enantioselective Total Synthesis of (−)-Caldaphnidine O
Enantioselective Total Synthesis of (−)-Caldaphnidine O Лекция 3
Лекция 3 Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода