Содержание
- 2. Почему атомы взаимодействуют между собой? Что такое химическая связь? Каждый атом стремится к завершению своей наружной
- 3. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
- 4. Как определить число электронов на наружном слое атомов элементов главных подгрупп? Число электронов = номеру группы.
- 5. Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам Задание: Выпишите формулы
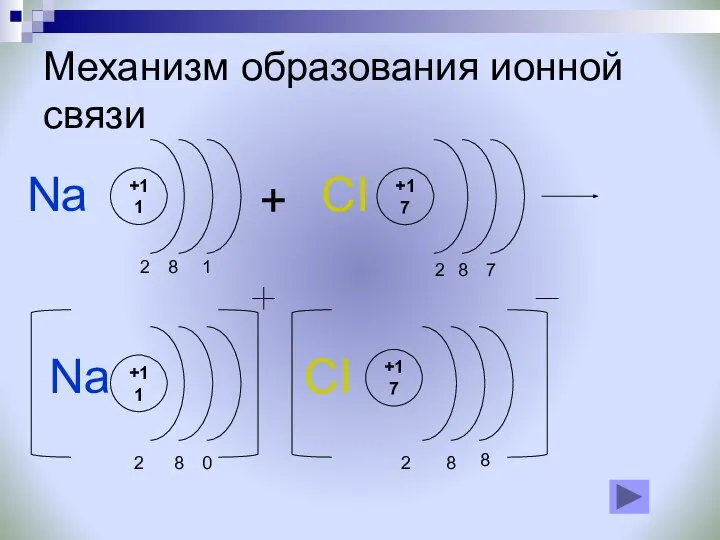
- 6. ИОННАЯ СВЯЗЬ Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из
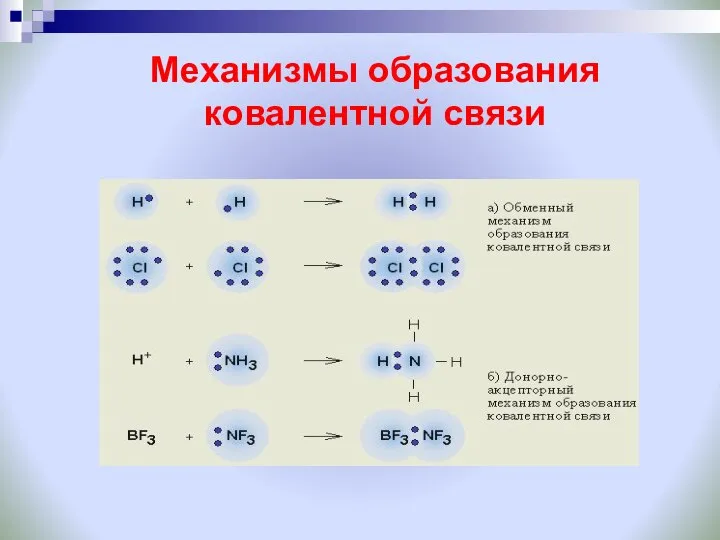
- 7. Механизмы образования ковалентной связи
- 8. Механизм образования ионной связи +11 0 8 2 +17 8 2 + Na Na +11 2
- 9. Физические свойства веществ с ионным типом связи: твердые, тугоплавкие, не имеющие запаха, часто хорошо растворимые в
- 10. Металлическая связь связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в
- 11. Физические свойства. Валентные электроны принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Образуя единое
- 12. Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих электронных пар Обменный Донорно-акцепторный
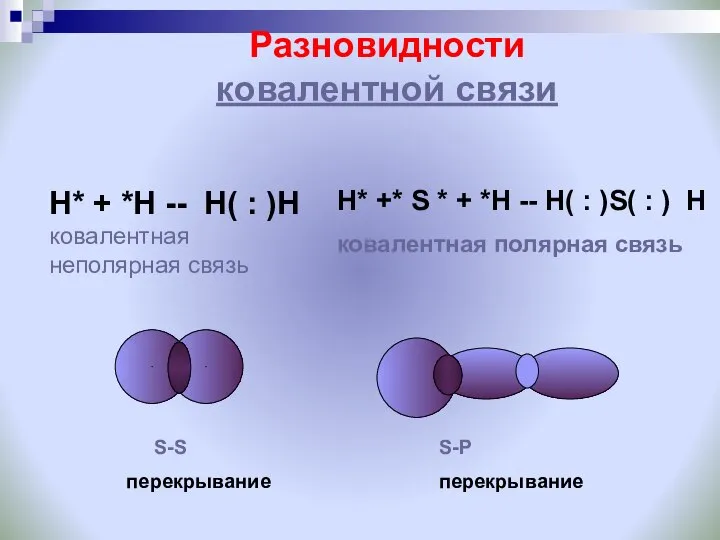
- 13. Разновидности ковалентной связи Н* + *Н -- Н( : )Н ковалентная неполярная связь Н* +* S
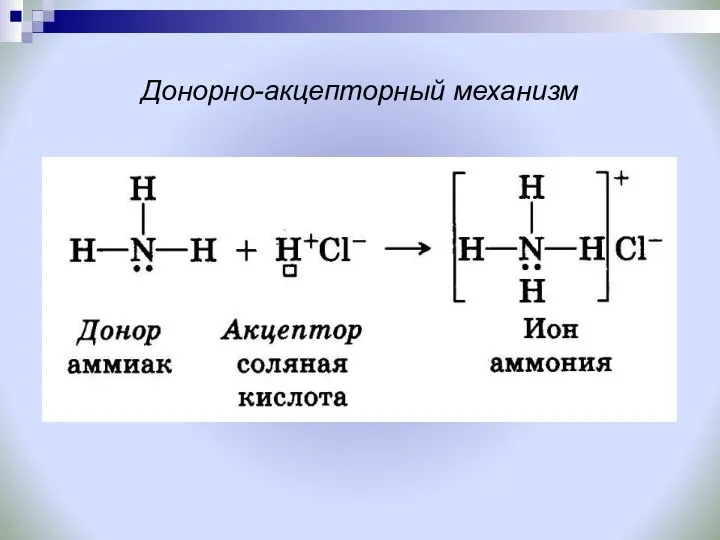
- 15. Донорно-акцепторный механизм
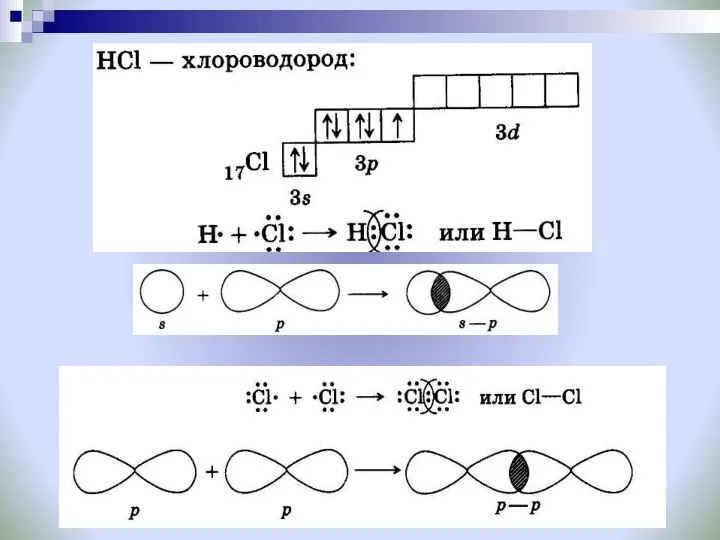
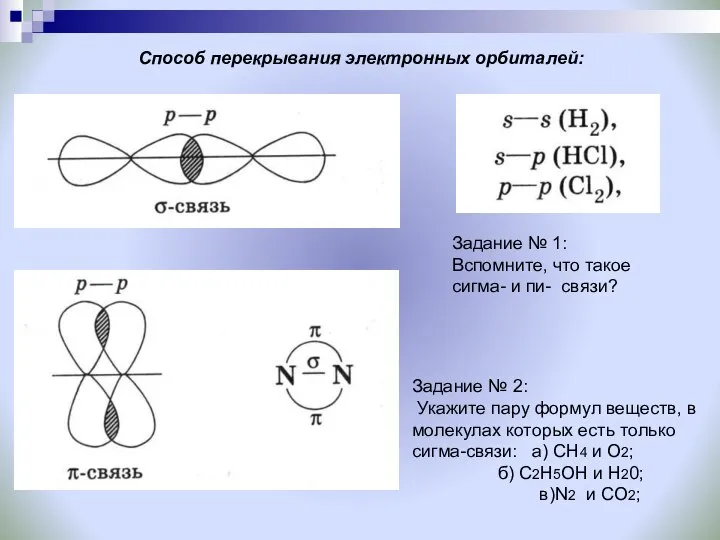
- 16. Способ перекрывания электронных орбиталей: Задание № 1: Вспомните, что такое сигма- и пи- связи? Задание №
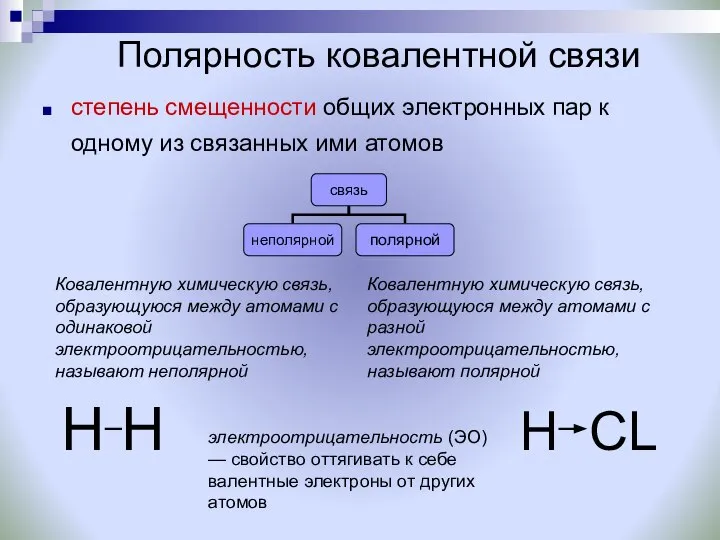
- 17. Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов электроотрицательность (ЭО)
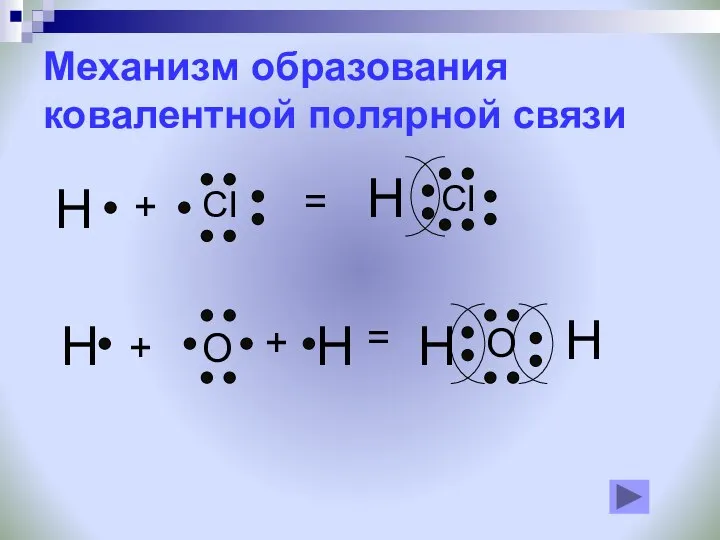
- 18. Механизм образования ковалентной полярной связи H CI + = H CI H O H H H
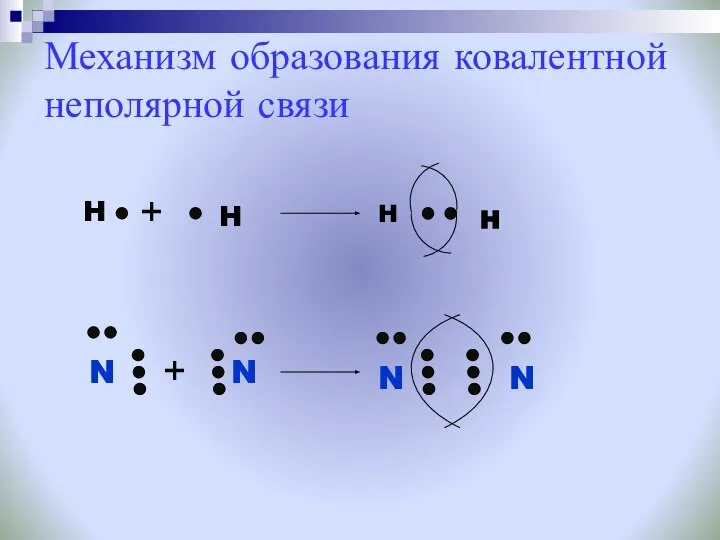
- 19. Механизм образования ковалентной неполярной связи H H N N H H N N + +
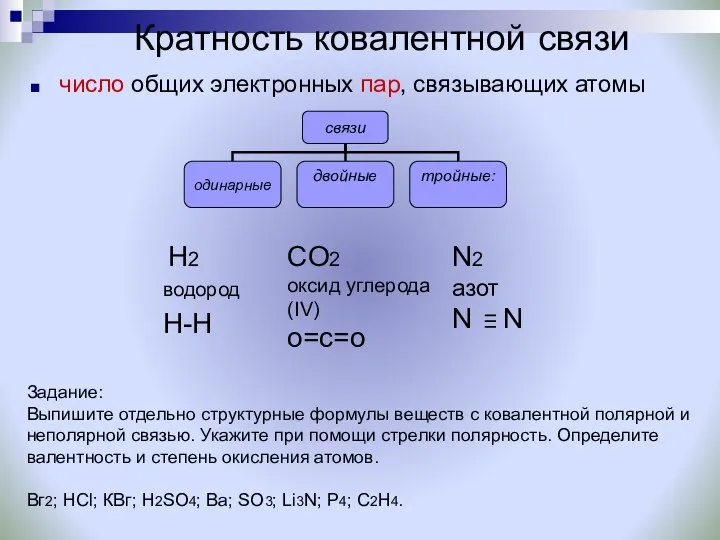
- 20. Кратность ковалентной связи число общих электронных пар, связывающих атомы CO2 оксид углерода (IV) о=с=о N2 азот
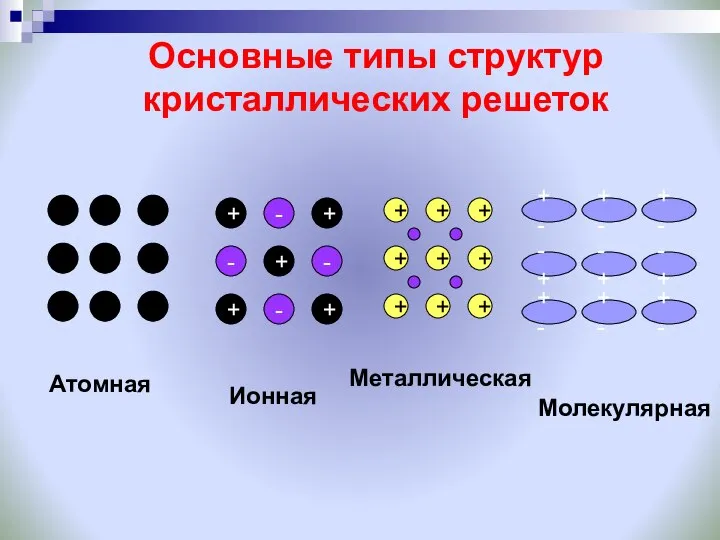
- 21. Основные типы структур кристаллических решеток + + - + - + + - - + +
- 22. ВЕЩЕСТВА С АТОМНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ АЛМАЗ(С), КРЕМНИЙ (Si), КВАРЦ (SiO2). Они состоят из атомов, связанных друг
- 23. ВЕЩЕСТВА С МОЛЕКУЛЯРНОЙ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКОЙ В УЗЛАХ – НАХОДЯТСЯ МОЛЕКУЛЫ. УДЕРЖИВАЮТСЯ СЛАБЫМИ МЕЖМОЛЕКУЛЯРНЫМИ СИЛАМИ. ВЕЩЕСТВА ЛЕГКОПЛАВКИ,
- 24. Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно
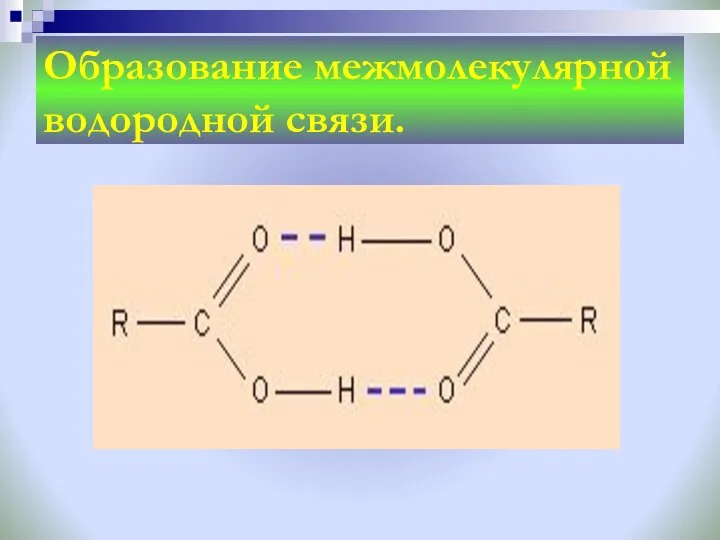
- 25. Образование межмолекулярной водородной связи.
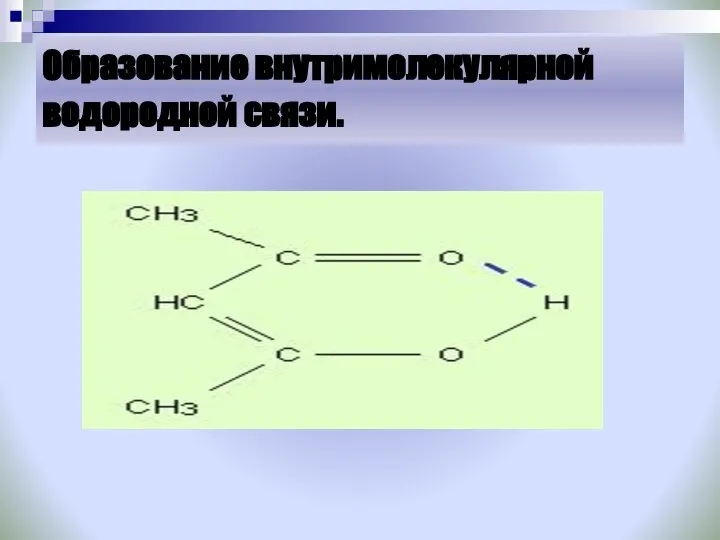
- 26. Образование внутримолекулярной водородной связи.
- 27. Механизм образования водородной связи имеет частично электростатический, частично донорно-акцепторный характер. Примеры межмолекулярной водородной связи:
- 28. Самостоятельная работа Определите типы химических связей между атомами в веществах. CaВг2; НСl; К; H2SO3; BaO; SO2;
- 30. Скачать презентацию














 Химия и нанотехнологии
Химия и нанотехнологии Диссоциация кислот
Диссоциация кислот Гальванические элементы
Гальванические элементы Химические методы анализа. Гравиметрический метод анализа
Химические методы анализа. Гравиметрический метод анализа Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите
Анодное растворение mn5si3-электрода в сернокислом фторидсодержащем электролите Моносахариды
Моносахариды Химическая промышленность. Аварии на химических предприятиях
Химическая промышленность. Аварии на химических предприятиях Гетерогенные дисперсные системы
Гетерогенные дисперсные системы Каталітичні процеси нафтопереробки
Каталітичні процеси нафтопереробки Презентация на тему Химия и проблемы экологии. Кислотные дожди
Презентация на тему Химия и проблемы экологии. Кислотные дожди  Углеродистые стали
Углеродистые стали Неметаллические материалы
Неметаллические материалы Бикомпонентные покрытия
Бикомпонентные покрытия Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры)
Карбонильные производные (кислоты, альдегиды, кетоны, сложные эфиры) Составление ионных уравнений
Составление ионных уравнений Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты)
Структуры кампестерина (первичный метаболит), экдизона и протопанаксатриола (вторичные метаболиты) Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Присадки для базовых масел. Присадки и наполнители пластичных смазок
Присадки для базовых масел. Присадки и наполнители пластичных смазок Стерилизация технологических потоков и оборудования
Стерилизация технологических потоков и оборудования Скорость химической реакции
Скорость химической реакции Физико-химические процессы в гидросфере
Физико-химические процессы в гидросфере Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Периодическая система химических элементов Д. И. Менделеева
Периодическая система химических элементов Д. И. Менделеева Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава  Классификация химических реакций
Классификация химических реакций Раздел 1
Раздел 1