Содержание
- 2. — это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу
- 3. Классификация химических реакций I. По числу и составу реагирующих и образующихся веществ II.По изменению степени окисления
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие БЕЗ ИЗМЕНЕНИЯ состава веществ В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие С ИЗМЕНЕНИЕМ состава веществ 1.
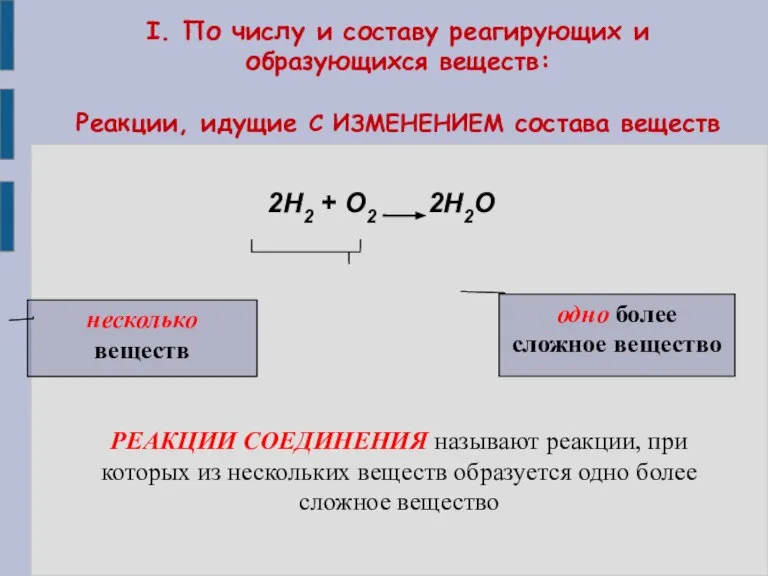
- 6. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие С ИЗМЕНЕНИЕМ состава веществ 2H2
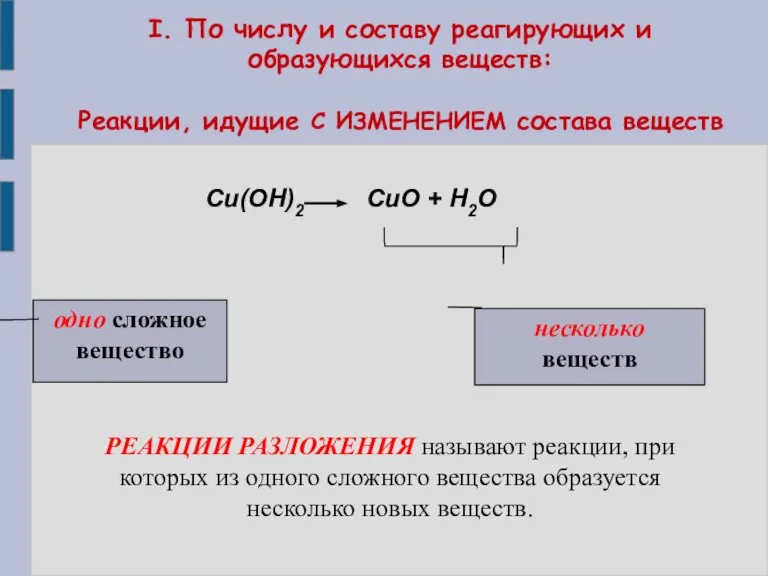
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие С ИЗМЕНЕНИЕМ состава веществ Cu(OH)2
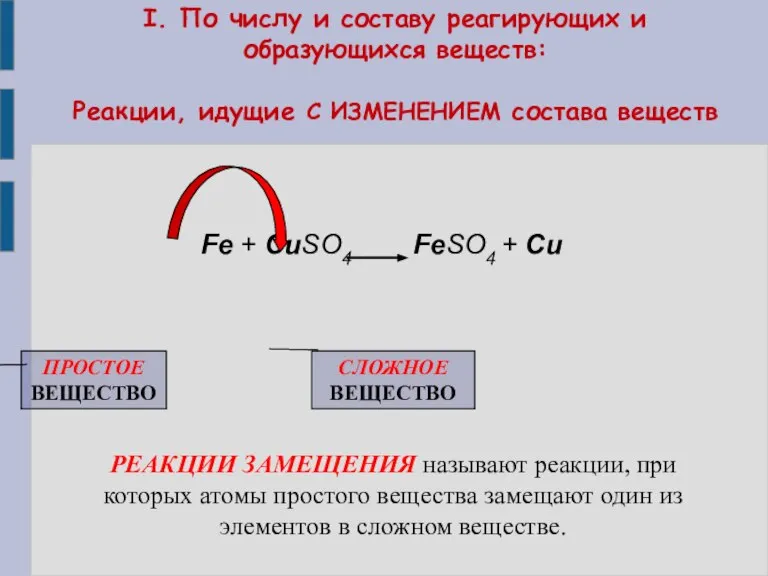
- 8. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие С ИЗМЕНЕНИЕМ состава веществ Fe
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие С ИЗМЕНЕНИЕМ состава веществ BaCl2+H2SO4
- 10. II. По изменению степеней окисления химических элементов 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней
- 11. III. По использованию катализатора 1. Некаталитические реакции – реакции, идущие без участия катализатора: 2HgO = 2Hg
- 12. III. По использованию катализатора 2. Каталитические реакции – реакции, идущие с участием катализатора: 2H2O2 = 2H2O
- 13. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Ba(ClO2)2 +
- 14. V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
- 15. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 16. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: 4P + 5O2 = 2P2O5
- 17. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: N2 + O2 = 2NO
- 18. VII. По виду энергии, инициирующей реакцию: 1. Фотохимические реакции инициируются световой энергией. 2. Радиационные реакции инициируются
- 19. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 21. Скачать презентацию















 Круговорот серы в природе
Круговорот серы в природе Курс химии для основных академических направлений подготовки специалистов НИЯУ МИФИ
Курс химии для основных академических направлений подготовки специалистов НИЯУ МИФИ Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Пименов_Химический состав
Пименов_Химический состав Синтетические материалы
Синтетические материалы Типы химических реакций
Типы химических реакций Основы химической кинетики
Основы химической кинетики Закон сохранения массы и энергии
Закон сохранения массы и энергии Vodík
Vodík Магматические горные породы
Магматические горные породы Виды нагрева и материалы резистивных нагревателей, их стойкость к температуре, ростовой атмосфере и расплаву
Виды нагрева и материалы резистивных нагревателей, их стойкость к температуре, ростовой атмосфере и расплаву ОВР. Метод электронного баланса
ОВР. Метод электронного баланса Презентация на тему Натуральные волокна
Презентация на тему Натуральные волокна  Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Обмен липидов
Обмен липидов Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Химия элементов (лекция 5)
Химия элементов (лекция 5) Биосинтез гема
Биосинтез гема Primenenie_kauchukov
Primenenie_kauchukov Презентация на тему Растворы
Презентация на тему Растворы  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Природные источники углеводородов
Природные источники углеводородов Транс-жиры
Транс-жиры Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича
Презентация учителя химии, биологии и экологии МОУ СОШ п.Алексеевка Бешагина Владимира Викторовича Презентация на тему Отравляющие вещества
Презентация на тему Отравляющие вещества  Алюминий
Алюминий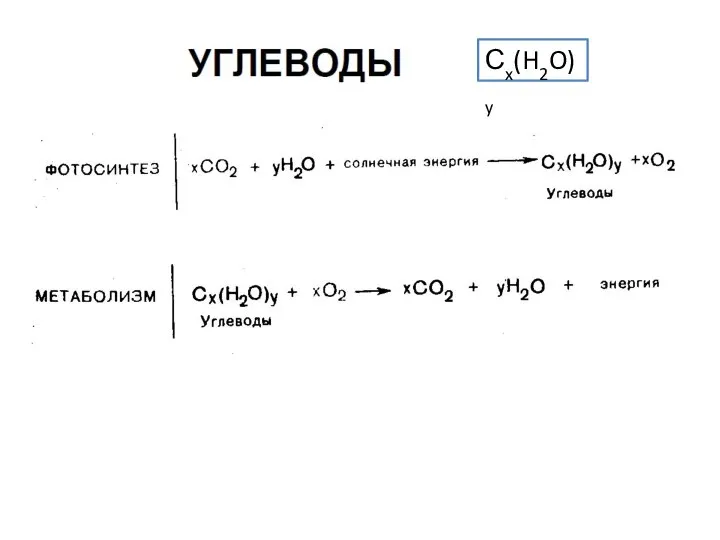 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение Предмет органической химии. Строение атома углерода
Предмет органической химии. Строение атома углерода